中国蚂蚁丰富度地理分布格局及其与环境因子的关系
沈梦伟, 陈圣宾, 毕孟杰, 陈文德, 周可新
1 成都理工大学旅游与城乡规划学院, 成都 610059 2 环境保护部南京环境科学研究所, 南京 210042 3 成都理工大学地球科学学院, 成都 610059
中国蚂蚁丰富度地理分布格局及其与环境因子的关系
沈梦伟1, 陈圣宾2,*, 毕孟杰3, 陈文德1, 周可新2
1 成都理工大学旅游与城乡规划学院, 成都 610059 2 环境保护部南京环境科学研究所, 南京 210042 3 成都理工大学地球科学学院, 成都 610059

生物地理学; 空间分布格局; 温度; 调查强度
大尺度的物种组成、分布及其成因一直是生物地理学和生物多样性科学的核心问题[1]。已有的研究主要以高等动植物为对象[2- 5]。昆虫是地球上物种多样性最高的多细胞生物类群,但大多数物种(或类群)的地理分布数据仍然缺乏;因此,与其高度的多样性相比,昆虫生物地理学研究严重不足[6]。蚂蚁是膜翅目(Hymenoptera)蚁科(Formicidae)社会性昆虫的俗称,种类繁多、分布广泛。据不完全统计,全球已知蚂蚁约为15700余种和亚种,并且不断有新物种被发现[7]。已有研究表明蚂蚁物种丰富度随纬度增加明显降低[8-13],且主要受能量的制约[14-15],其次为降水量、生境异质性和外来物种入侵等[12]。本文在省级尺度上,探讨中国蚂蚁物种丰富度的地理格局及其与环境因子,特别是温度(能量)的关系。基于其他地理区域的研究结果[14-15],温度可能是影响中国省级尺度蚂蚁物种丰富度的主要因素,具体为以下4个科学问题:(1)相比年降水量,年均温对蚂蚁丰富度的空间分异影响更大;(2)相比降水相关的生境异质性,蚂蚁丰富度更多受温度相关生境异质性的影响;(3)相比年均温,最冷月均温能更好地解释蚂蚁丰富度的空间分异;(4)相比降水季节性,温度季节性能更好地解释蚂蚁丰富度空间分异。
1 材料与方法
1.1 研究区及数据来源
本研究区域范围包括中国34个省、自治区、直辖市以及香港和澳门两个特别行政区。由于直辖市和特别行政区面积较小,将北京市和天津市并入河北省;将上海市并入浙江省;将重庆市并入四川省;将香港和澳门特别行政区并入广东省(图1)。
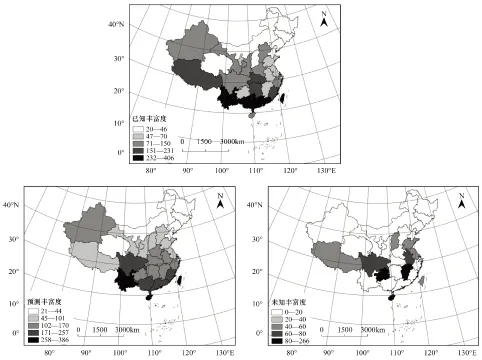
图1 中国省级行政区尺度蚂蚁丰富度和最优模型预测丰富度和未知丰富度Fig.1 The geographic pattern of observed ant richness, predicted ant richness from the best model, and unsampled at richness at provincial scale in China北京市和天津市并入河北省;将上海市并入浙江省;重庆市并入四川省;香港和澳门特别行政区并入广东省
Guénard和Dunn在2012年系统整理了中国各省蚂蚁名录[16],成为本文数据的主要来源。整合了刘霞等人2011年发表的数据[17],以弥补西藏地区调查强度的相对不足。以“1”或“0”记录某种蚂蚁在某省份的分布与否,建立中国蚂蚁分布数据库,进而计算各省份蚂蚁的物种丰富度。
本研究共选用15个环境因子(表1),分为4大类:能量、降水、生境异质性和季节性因子(表1)。能量因子包括年均温(TEM)、最冷月均温(TEMmin)、最暖月均温(TEMmax)和年潜在蒸发量(PET);水分因子包括年降雨量(PRE)、夏季降水量(PRECsum)、水分亏缺指数(WD;即PET与AET的差值)和湿润指数(MI;即AET/PET);季节性因子包括年温度变化范围(TEMvar;即TEMmax和TEMmin的差值)、月均温标准差(TEMsd)、年降水量变化范围(PRECvar, 即最大和最小月均降水量的差值)、月均降水量标准差(PRECsd);生境异质性因子包括各省的海拔变化范围(ELEVrange)、年均温空间变化范围(TEMrange)和年降水量空间变化范围(TEMrange)(表1)。
其中温度和降水量相关数据来源于WorldClim(http://www.worldclim.org),年潜在蒸发量(PET)和年实际蒸发量(AET)数据来自Ahn和Tateishi[18]。利用ArcGIS 9.3将中国矢量地图切割成3844个0.5度像元,提取每个像元中心点经纬度,通过运用DIVA-GIS软件,获取每个中心点的环境数据。各省内各像元环境因子的均值代表其平均环境条件,而各省海拔、年均温和年均降水量的相应最大值和最小值之差代表其生境异质性。

表1 中国省级行政区尺度蚂蚁丰富度与每个环境因子的线性回归关系
+正相关,-负相关;*P< 0.05,**P< 0.01,ns: 不显著
1.2 统计分析
本研究采用基于普通最小二乘法(Ordinary Least Squares, OLS)的一元线性回归模型考察各环境因子对蚂蚁丰富度的解释能力。然后采用前进法(Forward Selection),根据Akaike信息量准则(Akaike Information Criterion,AIC)筛选出最优模型(其AIC值最小)及其所包含的变量[19-20]。采用偏残差图分析当模型同时包括其他自变量时,某一自变量与因变量之间的关系[21]。
基于上述筛选的最优模型,笔者根据环境因子计算各省蚂蚁丰富度的预测值,并与实际丰富度进行对比。预测丰富度比实际丰富度多10种以上的8个省份是调查最不充分的。然后,利用其它20个调查相对充分的省份的数据,再次运行上述最优模型,确定所选环境因子的回归系数,并利用此回归系数计算全部省份蚂蚁丰富度的估计值。对于调查不充分的省份而言,此预测丰富度与实际丰富度的差异即为尚未调查到的蚂蚁物种数。由于总体而言蚂蚁区系调查尚不完全,实际开展蚂蚁区系调查所能发现的新记录很可能高于上述估计值。

2 结果
2.1 物种分布格局
中国蚂蚁物种丰富度热点地区主要集中在南方省份,而北方、西北干旱区和青藏高原的北部(青海)等省份物种丰富度较低(图1)。云南蚂蚁丰富度最高(406种),其次是台湾、广西、广东和湖南等省份,均在200种以上。蚂蚁丰富度最低的省份是山西,其次是内蒙古、黑龙江、吉林和辽宁等省份,均在40种以下。蚂蚁物种丰富度没有明显的经度梯度,而在纬度梯度上空间变异明显,即随纬度增加,物种丰富度显著降低(图2)。

图2 中国省级行政区尺度蚂蚁丰富度与经度(a)和纬度(b)的关系Fig.2 The relationships between ant richness and longitude (a) and latitude (b) at province scale in China
2.2 环境因子的影响

表2 采用前进法,基于Akaike信息量准则(AIC)筛选出的中国省级行政区蚂蚁丰富度最优模型
Table 2 The best model selected based on Akaike Information Criterion (AIC) through forward selection for ant richness at province scale in China

变量Variable标准回归系数StandardizedregressioncoefficientP全部28个省份年均温meanannualtemperature(TEM)0.780**海拔变化范围therangeofelevationwithinaprovince(ELErange)0.515**年温度变化范围annualtemperaturerange(TEMvar)-0.114nsR20.684***调查相对充分的20个省份年均温meanannualtemperature(TEM)0.755***海拔变化范围therangeofelevationwithinaprovince(ELErange)0.401***年温度变化范围annualtemperaturerange(TEMvar)-0.246*R20.950***
*P< 0.05,**P< 0.01,***P< 0.001,ns: 不显著
根据Akaike信息量准则(AIC)筛选出最优模型包含年均温(TEM)、年温度变化范围(TEMvar)和海拔变化范围(ELEVrange) 3个变量,能够解释蚂蚁丰富度空间变异的68.4% (表2)。其中最重要的预测因子是TEM和ELEVrange,分别能够解释偏残差的65.9%和45.7%,而TEMvar仅能解释偏残差的4.0%(图3)。

图3 最优模型中年温度变化范围(TEMvar) 、年均温(TEM) 和海拔变化范围(ELEVrange) 的偏残差图Fig.3 Partial residuals plots for TEMvar, TEM, and ELEVrange in the best model of provincial ant richness
2.3 未知蚂蚁丰富度
基于上述最优环境模型,安徽、贵州、海南、江西、山东、山西、四川和西藏8个省级行政区的已知蚂蚁物种数均低于预测值10种以上,因此对其他调查相对充分的20个省级行政区进行再次分析。年均温(TEM)、年温度变化范围(TEMvar)和海拔变化范围(ELEVrange)3个变量能解释20省份蚂蚁丰富度空间变异的95.0%(表2)。根据所获得的回归系数计算全部28个省份蚂蚁的预测丰富度,并与已知蚂蚁丰富度进行对比,发现海南、贵州和江西蚂蚁区系调查最不足,分别有至少266种、117种和115种蚂蚁未被记录;四川、安徽和山西未记录蚂蚁物种数在50—100之间(图1)。
3 讨论
本文结果表明,在省级行政区尺度上,中国蚂蚁物种丰富度随纬度的增加而降低,这与其他地区的研究结果一致[8-11,13,25-26]。由于海拔变化范围(ELEVrange)与年均温空间变化范围(TEMrange)的相关性(rs=0.791,P<0.001)远高于与年降水量空间变化范围(PRECrange)的相关性(rs=0.383,P=0.008),因此,海拔变化范围更多地反映与温度相关的生境异质性。基于AIC所筛选出的最优模型包括了年均温(TEM)、海拔变化范围(ELEVrange)和年温度变化范围(TEMvar),因此认为,温度是限制中国蚂蚁分布的最重要的因素。
相比水分因子,热量因子对蚂蚁丰富度的平均解释能力更高;而且,基于AIC所筛选出的最优模型所包括的因子全部与温度密切相关,而与水分的相关性较弱,即相比水分因素,温度对蚂蚁丰富度空间分异的影响更大。Gaston认为,植物可能受能量和水分的共同影响;而动物主要受能量的影响,水分的作用较小[27]。依据生态学代谢理论,物种丰富度的对数与绝对温度的倒数呈显著线性关系[28],即温度较高的地区,其物种丰富度也较高。尤其对蚂蚁而言,生理活动受环境温度影响较大,较高的温度,可降低其世代时间和提高突变速率,进而提高物种形成的速率和物种多样性。另外,Sanders等认为,温度也可通过对蚂蚁取食行为的限制而产生间接影响,从而成为影响蚂蚁海拔梯度分布的重要因子[15]。
相比降水相关的生境异质性,蚂蚁丰富度更多受温度相关生境异质性的影响。如前所述,海拔变化范围更多地反映与温度相关的生境异质性,笔者将最优模型中的ELEVrange替代为TEMrange,其解释能力为65.3%,略低于最优模型的68.4%;而将ELEVrange替代为PRECrange时,其解释能力下降为58.6%。Sanders等发现不同蚂蚁仅在一定海拔范围内出现,从而导致蚂蚁群落物种组成随海拔发生显著变化,特别是高海拔与低海拔蚂蚁群落组成截然不同[15]。最近,Smith等发现蚂蚁群落间物种组成的相似性随海拔距离增加而降低[29]。因此与温度相关的生境异质性是区域尺度蚂蚁物种多样性维持的重要机制。
单个异质性因子对蚂蚁丰富度的解释能力都较低,但却被选入最优模型(如ELEVrange);而且,TEM和TEMvar组成的模型解释能力为57.4%,当加入ELEVrange,其解释能力增加了11%至68.4%;再者,ELEVrange对偏残差的解释能力仅次于TEM,而大大高于TEMvar。因此,异质性的度量方式可能是导致这种现象的重要原因。例如,对于温度较低的省份而言,区域内最高年均温与最低年均温的空间差异可能高估了温度异质性,因为处于活性温度以上的区域较少,从而导致南方省份异质性程度与北方类似。与此同理,北方省份的ELEVrange和PRECrange也可能被高估。因此,只有在去除年均温的影响后,也就是说模型已包括TEM的情况下,异质性的效应才显示出来。这可以解释为什么解释能力低的ELEVrange反而进入最优模型。
无论就单个因子的解释能力还是从最优模型的构成,结果均显示,相比降水季节性,温度季节性能更好地解释蚂蚁丰富度空间分异,而且年温度变化范围(TEMvar)进入了最优模型。较高的温度季节性不仅意味着冬季低温,还可能包括夏季高温。对蚂蚁而言,冬季低温是冷害或冻害胁迫,而夏季高温则是干旱胁迫[30]。由于蚂蚁个体较小,对干旱胁迫更为敏感,特别是在低纬度地区[30]。并且,相比降水缺乏,高温导致蚂蚁受到干旱胁迫的可能性更高,因为蚂蚁不仅面临着环境干旱,还会由于温度升高而新陈代谢加快导致的体内缺水[28]。虽然TEMvar与TEMmin具有显著的负相关(rs=-0.857,P<0.001),但与TEM没有显著的相关性(rs=-0.758,P=0.06);况且TEMvar能比TEMmin表达更多的环境信息,因此,最优模型包含了TEMvar而非TEMmin。
因为纬度与温度密切相关,而温度对物种丰富度的分布具有重要影响[28,31],所以我国蚂蚁多样性热点地区主要分布在东南沿海和西南等省份的热带和亚热带地区,而北方地区的温带、寒温带物种丰富度较低。某些纬度相似省份间蚂蚁物种丰富度的差异也可由温度的差异来解释。例如,贵州蚂蚁物种数低于基本处在相同纬度的湖南,可能是由于贵州地处云贵高原,年均温低于湖南省1.2℃。虽然都处于内陆干旱区,新疆蚂蚁丰富度远高于纬度相似的内蒙古,可能是由于新疆年均温高于内蒙古3.0℃,而温度季节性却较低。
研究还表明,海南、贵州、江西、四川、安徽和山西等6省蚂蚁区系调查最不充分,应该作为未来野外蚂蚁采集和编目的重点区域,而且每省的新分布记录极有可能在50种以上。
[1] Beck J, Ballesteros-Mejia L, Buchmann C M, Dengler J, Fritz S A, Gruber B, Hof C, Jansen F, Knapp S, Kreft H, Schneider A K, Winter M, Dormann C F. What′s on the horizon for macroecology?. Ecography, 2012, 35(8): 673- 683.
[2] Chen S B, Jiang G M, Ouyang Z Y, Xu W H, Xiao Y. Relative importance of water, energy, and heterogeneity in determining regional pteridophyte and seed plant richness in China. Journal of Systematics and Evolution, 2011, 49(2): 95- 107.
[3] 于晓东, 罗天宏, 周红章. 长江流域鱼类物种多样性大尺度格局研究. 生物多样性, 2005, 13(6): 473- 495.
[4] Wu Y J, Colwell R K, Han N J, Zhang R Y, Wang W J, Quan Q, Zhang C L, Song G, Qu Y H, Lei F M. Understanding historical and current patterns of species richness of babblers along a 5000-m subtropical elevational gradient. Global Ecology and Biogeography, 2014, 23(11): 1167- 1176.
[5] Wu Y J, Colwell R K, Rahbek C, Zhang C L, Quan Q, Wang C K, Lei F M. Explaining the species richness of birds along a subtropical elevational gradient in the Hengduan Mountains. Journal of Biogeography, 2013, 40(12): 2310- 2323.
[6] Diniz-Filho J A F, De Marco Jr P, Hawkins B A. Defying the curse of ignorance: perspectives in insect macroecology and conservation biogeography. Insect Conservation and Diversity, 2010, 3(3): 172- 179.
[7] 郭萧, 林强, 崔晋波, 高冬梅, 许姗姗, 盛忠雷. 重庆市茶园蚂蚁物种多样性及空间分布格局. 中国生态农业学报, 2014, 22(5): 585- 593.
[8] Dunn R R, Agosti D, Andersen A N, Arnan X, Bruhl C A, Cerdá X, Ellison A M, Fisher B L, Fitzpatrick M C, Gibb H, Gotelli N J, Gove A D, Guenard B, Janda M, Kaspari M, Laurent E J, Lessard J P, Longino J T, Majer J D, Menke S B, McGlynn T P, Parr C L, Philpott S M, Pfeiffer M, Retana J, Suarez A V, Vasconcelos H L, Weiser M D, Sanders N J. Climatic drivers of hemispheric asymmetry in global patterns of ant species richness. Ecology Letters, 2009, 12(4): 324- 333.
[9] Terayama M. Structure of ant communities in East Asia. I. Regional differences and species richness. Bulletin of the Biogeographical Society of Japan, 1992, 47(4): 1- 31.
[10] Schlick-Steiner B C, Steiner F M, Pautasso M. Ants and people: a test of two mechanisms potentially responsible for the large-scale human population-biodiversity correlation for Formicidae in Europe. Journal of Biogeography, 2008, 35(12): 2195- 2206.
[11] Del Toro I. Diversity of Eastern North American Ant communities along environmental gradients. PLoS One, 2013, 8(7): e67973.
[12] Gotelli N J, Arnett A E. Biogeographic effects of red fire ant invasion. Ecology Letters, 2000, 3(4): 257- 261.
[13] Kaspari M. Using the metabolic theory of ecology to predict global patterns of abundance. Ecology, 2004, 85(7): 1800- 1802.
[14] Kusnezov N. Numbers of species of ants in faunae of different latitudes. Evolution, 1957, 11(3): 298- 299.
[15] Sanders N J, Lessard J P, Fitzpatrick M C, Dunn R R. Temperature, but not productivity or geometry, predicts elevational diversity gradients in ants across spatial grains. Global Ecology and Biogeography, 2007, 16(5): 640- 649.
[16] Guénard B, Dunn R R. A checklist of the ants of China. Zootaxa, 2012, 3558: 1- 77.
[17] 刘霞, 徐正会, 周雪英, 于娜娜, 张成林. 藏东南德姆拉山西坡及波密河谷蚂蚁群落研究. 林业科学研究, 2011, 24(4): 458- 463.
[18] Ahn C H, Tateishi R. Development of Global 30-minute grid potential evapotranspiration data set. Journal of the Japan Society of Photogrammetry and Remote Sensing, 1994, 33(2): 12- 21.
[19] 蔡波, 黄勇, 陈跃英, 胡军华, 郭宪光, 王跃招. 中国蛇类物种丰富度地理格局及其与生态因子的关系. 动物学研究, 2012, 33(4): 343- 353.
[20] 宋喜芳, 李建平, 胡希远. 模型选择信息量准则AIC及其在方差分析中的应用. 西北农林科技大学学报: 自然科学版, 2009, 37(2): 88- 92.
[21] Legendre P, Legendre L. Numerical Ecology. 2nd ed. Amsterdam: Elsevier Science, 1998.
[22] Diniz-Filho J A F, Bini L M, Hawkins B A. Spatial autocorrelation and red herrings in geographical ecology. Global ecology and Biogeography, 2003, 12(1): 53- 64.
[23] Dutilleul P, Clifford P, Richardson S, Hemon D. Modifying the t test for assessing the correlation between two spatial processes. Biometrics, 1993, 49(1): 305- 314.
[24] R Development Core Team. R: a language and environment for statistical computing. R foundation for statistical computing. Vienna, (2012). http://www.r-project.org/. (2015- 3-08)
[25] Cushman J H, Lawton J H, Manly B F J. Latitudinal patterns in European ant assemblages: variation in species richness and body size. Oecologia, 1993, 95(1): 30- 37.
[26] Gotelli N J, Ellison A M. Biogeography at a regional scale: determinants of ant species density in New England bogs and forests. Ecology, 2002, 83(6): 1604- 1609.
[27] Gaston K J. Global patterns in biodiversity. Nature, 2000, 405(6783): 220- 227.
[28] 王志恒, 唐志尧, 方精云. 物种多样性地理格局的能量假说. 生物多样性, 2009, 17(6): 613- 624.
[29] Smith M A, Hallwachs W, Janzen D H. Diversity and phylogenetic community structure of ants along a Costa Rican elevational gradient. Ecography, 2014, 37(8): 720- 731.
[30] 戈峰. 昆虫生态学原理与方法. 北京: 高等教育出版社, 2008.
[31] Evans K L, Greenwood J J D, Gaston K J. Dissecting the species-energy relationship. Proceedings of the Royal Society B: Biological Sciences, 2005, 272(1577): 2155- 2163.
Relationships between geographic patterns of ant species richness and environmental factors in China
SHEN Mengwei1, CHEN Shengbin2,*, BI Mengjie3, CHEN Wende1, ZHOU Kexin2
1CollegeofTourismandUrban-Ruralplanning,ChengduUniversityofTechnology,Chengdu610059,China2NanjingInstituteofEnvironmentalSciences,MinistryofEnvironmentalProtection,Nanjing210042,China3CollegeofEarthscience,ChengduUniversityofTechnology,Chengdu610059,China

biogeography; spatial distribution pattern; temperature; sampling effort
国家环境保护公益性行业科研专项(201409055);国家科技支撑计划(2012BAC01B08)
2015- 10- 31;
2016- 04- 29
10.5846/stxb201510312201
*通讯作者Corresponding author.E-mail: chainpin@126.com
沈梦伟, 陈圣宾, 毕孟杰, 陈文德, 周可新.中国蚂蚁丰富度地理分布格局及其与环境因子的关系.生态学报,2016,36(23):7732- 7739.
Shen M W, Chen S B, Bi M J, Chen W D, Zhou K X.Relationships between geographic patterns of ant species richness and environmental factors in China.Acta Ecologica Sinica,2016,36(23):7732- 7739.

