两个茄子品种高效再生体系的建立
张玲,王延秀,陈佰鸿,王淑华,石晓昀,党兆霞
(甘肃农业大学园艺学院,甘肃 兰州 730070)
两个茄子品种高效再生体系的建立
张玲,王延秀,陈佰鸿,王淑华,石晓昀,党兆霞
(甘肃农业大学园艺学院,甘肃 兰州730070)
摘要:【目的】 建立茄子高效再生体系,为遗传转化、种质创新研究奠定基础.【方法】 以‘兰杂一号’和‘兰杂二号’两个茄子品种为试材,通过对不同质量浓度外源激素组合的筛选,研究基因型、外植体类型、苗龄、外源生长调节剂组合对不定芽分化与伸长的影响.【结果】 ‘兰杂二号’的不定芽分化率显著高于‘兰杂一号’;子叶的不定芽分化能力强于下胚轴和茎段;11~13 d苗龄的外植体不定芽分化频率较高;‘兰杂一号’和‘兰杂二号’分别在6-BA/IBA为10∶1和30∶1的配比下,分化率达最高,分别为89.58%、94.97%;在6-BA/IBA为1∶2配比下有利于两个品种不定芽伸长,伸长率分别高达91.67%、96.88%.【结论】 适宜‘兰杂一号’和‘兰杂二号’不定芽分化的培养基分别为MS+2.0 mg/L 6-BA+0.2 mg/L IAA和MS+3.0 mg/L 6-BA+0.1 mg/L IAA;适宜不定芽伸长的培养基为MS+0.1 mg/L 6-BA+0.2 mg/L IAA;最佳生根培养基为1/2 MS培养基.
关键词:茄子;离体再生体系;子叶;下胚轴;不定芽
茄子(SolanummelongenaL.)为茄科茄属一年生草本植物,其产量高,适应性强,耐运输和储藏,是世界各地广泛栽培的重要蔬菜作物[1].中国是世界上最大的茄子生产国,栽培面积达73.88万hm2,占世界总面积(161.14万hm2)的45.85% (FAO,2009).兰州地区自主培育的茄子品种‘兰杂一号’(SolanummelongenaL.cv Lanza)与‘兰杂二号’(SolanummelongenaL.cv Lanza)均为高秧长茄类型,极丰产,适应性广,在西北地区广泛种植.‘兰杂一号’果形长条形、略弯曲,是极早熟品种;‘兰杂二号’果实长棒形,直而较粗,早熟品种.
自1997年Aroaia等[2]成功地将改造了的Bt基因转入茄子一来,茄子转基因技术经过了将近二十年的历史,目前严重制约茄子转基因技术发展的因素是茄子离体再生频率较低.国内外茄子离体再生研究已取得部分进展:如花药(粉)培养[3-4],建立小孢子培养体系[5-6],器官分化培养[7-8],原生质体培养[9-10],体细胞融合获得再生植株[11],以及胚状体诱导[10]等.但由于基因型的不同,导致茄子品种间的再生频率差异很大,缺少通用的再生体系[12].
影响植物离体再生成功与否的最主要因素还在于适宜的外源激素种类和浓度配比[13].同科、属中不同品种(基因型)植物内源激素水平不同,其对外源激素的种类和浓度要求也不同.通过调整培养基的中外源激素,协调不同外植体材料内源激素间的不平衡性来提高植物再生频率是一条非常有效的途径[14],以MS培养基为基本培养基添加6-BA,再配合其他激素,通常在茄子离体培养中可以取得较好效果[15-16].本研究充分参考前人研究结果,选用两个西北主栽品种,对其再生体系进行研究,以便建立高效的离体再生体系为遗传转化、种质创新研究奠定良好基础,也为快速繁殖脱毒试管苗和优良品种保存提供可靠途径.
1材料与方法
1.1试验材料
供试茄子品种:‘兰杂一号’(SolanummelongenaL.cv Lanza)、‘兰杂二号’(SolanummelongenaL.cv Lanza),购于甘肃省农科院.
1.2试验方法
1.2.1无菌苗的制备选取饱满的种子,温汤浸种后在超净台内依次用70%酒精快速浸泡30 s,0.1%HgCl2浸泡6 min进行消毒,然后用无菌水冲洗3-4次.消毒后的种子播种于MS培养基上,置于培养温度为(25±1)℃,每日光照16 h,光强度2 000~3 000 lx的光照培养箱里培养,促使其发芽.
1.2.2不同外源激素配比诱导再分化筛选方法待茄子子叶展开后,剪取无菌苗的子叶接种于以MS固体培养基(MS+琼脂6 g/L,蔗糖20 g/L,pH5.8~6.2)为基本培养基,添加不同质量浓度的6-BA和IAA(如表1)的不同诱导培养基上,诱导其分化.接种时子叶剪成0.5 cm×0.5 cm的小块,正面向上.每处理设4个重复,每重复处理为4个培养皿,每个培养皿接种6片,培养4周,培养条件与无菌苗制备条件相同.连续观察统计不定芽分化情况,筛选出有利于不定芽诱导分化最佳外源激素组合[17].

分化率
1.2.3外植体的筛选方法剪取生长状态一致的子叶,下胚轴,茎段接种于适宜的分化培养基上.下胚轴剪取离子叶基部(远离子叶基部的腋芽区)1 cm左右的小段,茎段选取茎端幼嫩的部分,下胚轴、茎段横向放置.不同外植体接种数量、培养时间和培养条件同前.
1.2.4苗龄的筛选方法子叶展开3 d后开始,隔天剪取无菌苗的子叶和下胚轴分别接种于适宜的分化培养基上培养,直至子叶开始黄化脱落试验无法进行.不同苗龄外植体接种数量、培养时间和培养条件同前.
1.2.5不同外源激素配比促进不定芽伸长的筛选方法将诱导产生的健壮芽苗转接到添加不同外源激素组合的芽伸长培养基上诱导培养,外植体接种数量、培养时间和培养条件同前(表2)[18].

表2诱导茄子不定芽伸长的激素组合
Tab.2The different hormone combinations for
induction of the elongation of adventitious
buds of eggplant
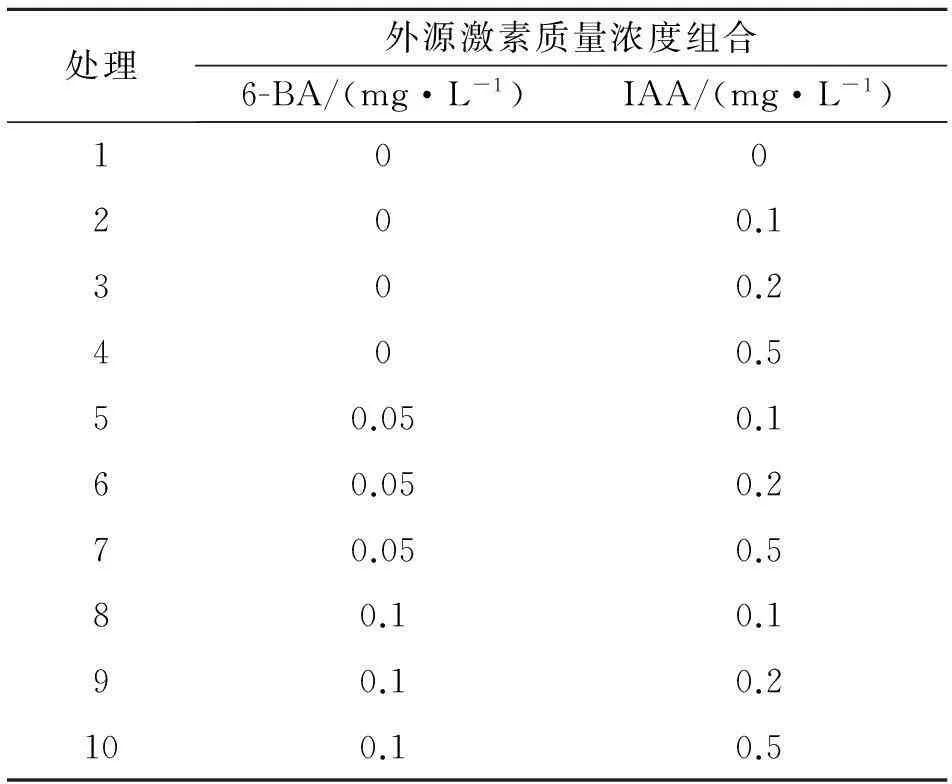
处理外源激素质量浓度组合6-BA/(mg·L-1)IAA/(mg·L-1)100200.1300.2400.550.050.160.050.270.050.580.10.190.10.2100.10.5
1.3生根培养基的筛选方法
选择不定芽伸长至2 cm、伸出2片真叶以上的植株,将其自基部切下转接至不同生根培养基上,促使其发根.每个处理设4个重复,每重复为10个三角瓶,每个三角瓶中接4棵芽,生根培养基为附加不同质量浓度NAA的1/2 MS培养基,Ⅰ:1/2 MS+0.0 mg/L NAA;Ⅱ:1/2 MS+0.1 mg/L NAA;Ⅲ:1/2 MS+0.2 mg/L NAA;Ⅳ:1/2 MS+0.3 mg/L NAA.
1.4数据分析
试验数据采用SPSS软件进行方差分析(ANOVA),用Duncan法进行差异显著性检测.
2结果与分析
2.1不同外源激素组合对不定芽分化的影响
由图1可以看出,‘兰杂一号’的不定芽分化率为2.08%~89.58%,‘兰杂一号’在F组合培养上不定芽分化率最高达89.58%,显著高于其他任何处理;其次为处理E组合,显著高于处理A、B、C、D和G组合,其中处理G与C、C与B、B与D组合差异不显著但都与处理A组合差异达显著水平.‘兰杂二号’的不定芽分化率为21.88%~94.79%.不同组合下的不定芽分化率差异显著,其中,D组合上的不定芽分化率最高达94.79%,显著高于任一激素组合;其次为处理G组合,显著高于处理A、C、E、F组合,其中除处理A、B组合间无显著性外,其他处理间差异达到显著水平.

A-G表不同的激素处理组合;柱图上的误差线表示标准偏差,n=4;不同字母表示差异显著(P<0.05).图1 不同激素组合对茄子不定芽分化的影响Fig.1 Effect of different hormone combinations on the differentiation of adventitious buds of eggplant
从激素组合来看,‘兰杂一号’不定芽分化率在同一生长素质量浓度下随着细胞分裂素质量浓度的升高而先升高后下降,如处理B、C、D上的不定芽分化率分别为41.67%、50.00%和31.25%;在相同细胞分裂素质量浓度下随生长素质量浓度升高而升高,如处理C、F上的不定芽分化率分别为50.00%、89.58%,且‘兰杂一号’在6-BA/IAA质量浓度配比为10∶1的培养基处理F(2.0 mg/L 6-BA+0.2 mg/L IAA)上不定芽分化率最高,且形成的愈伤组织比较致密.试验表明,低质量浓度生长素促进‘兰杂一号’分化,高质量浓度生长素抑制‘兰杂一号’;一定质量浓度范围内,提高细胞分裂素质量浓度促进‘兰杂一号’分化,即低的6-BA/IAA质量浓度比有利于促进‘兰杂一号’形成愈伤组织和分化不定芽.与‘兰杂一号’不同的是,在一定质量浓度范围内高质量浓度生长素促进‘兰杂二号’不定芽分化,高质量浓度细胞分裂素抑制‘兰杂二号’分化,即较高的6-BA/IAA质量浓度比有利于‘兰杂二号’不定芽分化.说明,不同基因型茄子内源激素水平不同,其离体培养对外源激素质量浓度要求也不同.
2.2不同外植体对不定芽分化的影响
从图2可以看出,两个茄子品种子叶平均不定芽分化率都最高,分别为89.58%和94.79%,茎段不定芽分化率最低平均只有31.25%和56.25%,下胚轴不定芽分化率居中.方差分析结果表明,子叶、下胚轴、茎段三者不定芽分化率差异达显著水平.说明,‘兰杂一号’和‘兰杂二号’两茄子品种均子叶分化能力最强,是再生体系中较好的外植体材料.

不同字母表示差异显著(P<0.05).图2 外植体对不定芽分化的影响Fig.2 Effect of different explant types on the differentiation of adventitious buds of eggplant
2.3不同苗龄对不定芽诱导分化的影响
从图3可以看出,‘兰杂一号’以9~13 d苗龄的外植体不定芽分化率最高为84.38%~88.54%,3~9 d苗龄的外植体随着苗龄的增长,不定芽分化率呈上升趋势,13 d苗龄以后的外植体不定芽分化率开始下降,25 d以后植株的子叶开始枯黄脱落无法再进行试验;‘兰杂二号’5~11 d苗龄的外植体随着苗龄的增加,芽分化率持续升高,以11~15 d苗龄的外植体不定芽分化率最高为85.42%~89.58%,以后随苗龄的增加不定芽分化率降低,23 d以后无子叶试验终止.说明,外植体苗龄是影响植株再生的关键因素,苗龄较小时外植体幼嫩,形成的愈伤组织易玻璃化;苗龄较老外植体难以形成愈伤组织,不定芽分化率迅速下降.因此,11~13 d苗龄的外植体的不定芽诱导分化能力最强.
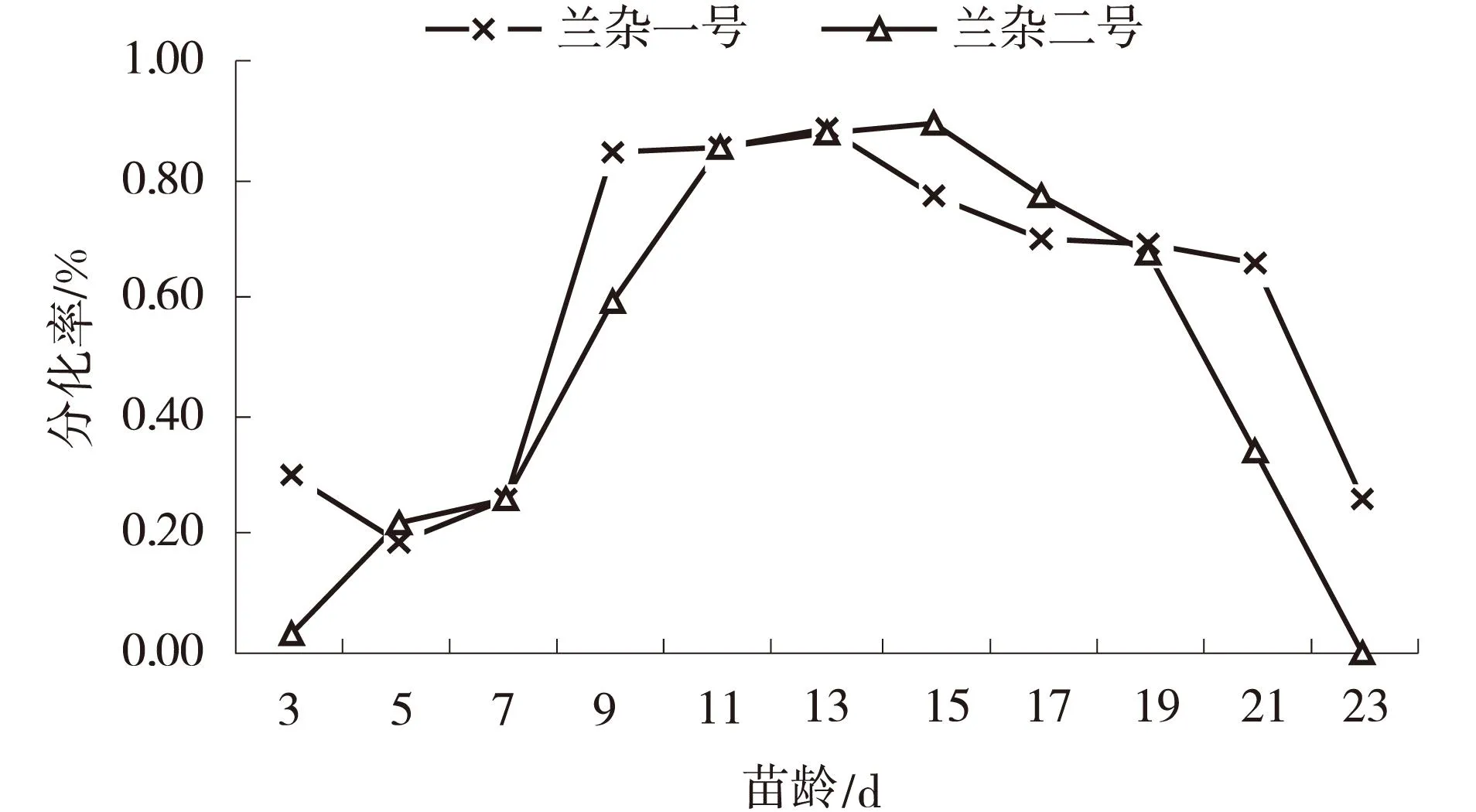
图3 苗龄对不定芽分化的影响Fig.3 Effect of different seedling age on the differentiation of adventitious buds of eggplant
2.4不同基因型的不定芽分化
从图1可以看出,无任何激素的处理A(MS培养基)上,‘兰杂一号’的平均不定芽分化率为2.08%,与‘兰杂二号’的不定芽分化率差异极显著.‘兰杂一号’接种后绝大部分子叶除逐渐枯黄萎蔫外再无其他变化(即无不定芽产生也无愈伤组织产生),极少数子叶切口处分化出淡黄色疏松的愈伤组织,颜色逐渐转绿最终分化出翠绿色嫩芽;‘兰杂二号’接种后部分子叶迅速分化出大块的、结构紧凑的浅绿色愈伤组织,继续培养,愈伤组织颜色加深,部分愈伤组织周围分化出墨绿色的不定芽.除处理G(3.0 mg/L 6-BA+0.2 mg/L IAA)外,添加其他不同激素组合的处理下,两个品种的不定芽分化率差异显著.来自不同基因型的相同外植体,其不定芽分化率也存在明显差异如(图2),来自不同基因型相同苗龄的外植体,其不定芽分化率也存在差异如(图3).因此说明,不同基因型的茄子不定芽分化能力存在明显差异.
2.5不同外源激素组合对不定芽伸长的影响
从图4可以看出,在各种外源激素组合处理下均有芽的伸长,‘兰杂一号’不定芽伸长率为36.46%~91.67%,‘兰杂二号’的芽伸长率为38.54%~96.88%.在生长素质量浓度一定时随着细胞分裂素质量浓度的升高不定芽伸长率下降,如‘兰杂一号’在2、3、4处理下的不定芽分化率为61.46%、57.29%和44.79%;在一定细胞分裂素质量浓度下随着生长素质量浓度升高不定芽伸长率先升高后下降,如‘兰杂二号’在处理8、9、10的作用下其不定芽伸长率分别为81.25%、96.88%和90.63%.方差分析结果表明,在6-BA/IAA配比为1∶5的9号培养基(6-BA 0.1 mg/L+IAA 0.2 mg/L)上,两个品种的不定芽伸长率最高,分别高达91.67%和96.88%显著高于其他激素组合,其次为10号培养基,两个品种不定芽伸长率分别为84.38%和90.63%.试验表明,低质量浓度的细胞分裂素促进‘兰杂一号’和‘兰杂二号’不定芽伸长,升高细胞分裂素质量浓度抑制其不定芽伸长;一定质量浓度范围内生长素促进其不定芽伸长.说明,植物离体培养在不同阶段对外源激素质量浓度要求不同,‘兰杂一号’和‘兰杂二号’不定芽经高质量浓度外源激素诱导分化后在低质量浓度外源激素配比培养基上有利于不定芽伸长.

1-10表示不同的激素组合.图4 激素组合对不定芽伸长的影响Fig.4 Effect of different hormone combinations on the elongation of adventitious buds of eggplant
2.6生根培养
选择生长健壮的再生苗接种至生根培养基上进行生根培养,生根培养两周后再生苗基部发生白色须根,培养3周后1/2 MS+NAA 0.1 mg/L培养基上的再生苗生根率最高可达96.25%(表2).在不添加任何生长调节剂的1/2MS培养基上,茄子再生苗的不定根发根数最多,根系健壮,根长3~4 cm,生根效果最佳,适宜移栽.随培养基中NAA质量浓度的升高发根条数减少,不定根逐渐变短,根系纤细,且在根基部出现白色愈伤组织,影响移栽成活率.本试验研究表明,适宜生根的培养基为1/2 MS培养基.
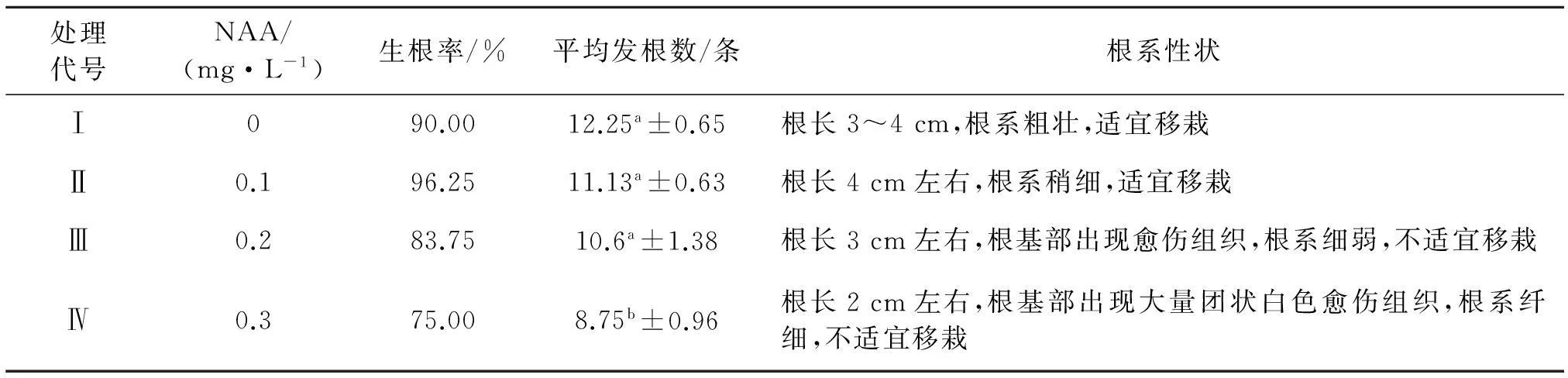
表3 不同生根处理对根系生长的影响
3讨论
3.1基因型对茄子再生体系的影响
在组织培养过程中,茄子不同品种不定芽的诱导分化和芽伸长存在显著差异,‘兰杂二号’平均不定芽分化率和不定芽伸长率都显著高于‘兰杂一号’的.说明,不定芽诱导分化、不定芽伸长特性有不同的生理生化代谢机制,受基因调控与品种的遗传特性密切相关[15].植物对于植物外源激素的反应由于物种、品种、器官而不同,特定品种的年龄、环境和生理发育状态、营养状态均影响其对激素的响应[19].植物组织培养中,针对组培苗不同时期的生长特点,只有配合恰当的激素,才能诱导细胞分裂的启动、愈伤组织的形成和增殖、不定芽与不定根分化等变化.外植体对激素的需求取决于它本身的激素水平对激素的敏感性,也因植物种类不同而各异[20].
3.2外源激素组合对茄子再生体系的影响
前人研究表明茄科植物外植体中不具有足够的内源激素,因此,在组织培养中要添加不同浓度的外源激素才能促进外植体不定芽分化和芽伸长[21].6-BA是组织培养中广泛应用的生长调节物质,尤其是在茄科植物中应用都有良好的效果[22-23],对于芽的诱导作用突出[24].IAA则能促进子叶和下胚轴不定芽的诱导和分化,也能促进细胞的伸长,不定根的发生[19].细胞分裂素和生长素组合应用对植物组织培养起关键作用,本试验结果显示,一定质量浓度范围内,细胞分裂素质量浓度与生长素质量浓度比值较大时促进细胞分化形成不定芽;细胞分裂素质量浓度与生长素质量浓度比值较小时有利于细胞分裂不定芽伸长,与Foley[25]、欧阳达等[26]的研究一致.因此对于植物特定的生理发育过程来说,植物激素的平衡至关重要.
在不定芽分化培养基上分化出的芽生长极其缓慢或很难伸长,说明植物在不同阶段所需植物激素不同,有利于芽分化的激素组合不一定有利于芽的伸长.许多植物组织培养的一部分细胞在长期的继代培养中逐步获得了独立合成细胞分裂素、而不再依赖外援细胞分裂素的能力[27].在增殖后期若不适当降低BA的质量浓度,而是持续使用初期的相同质量浓度的BA,会出现试管苗增殖过快、玻璃化严重、难以生根[23]等现象.本研究中发现适合诱导不定芽分化的高质量浓度6-BA培养基并不适合不定芽的伸长,分化的不定芽若不及时转移至新的培养基上,则大部分会畸形矮化,甚至黄化萎蔫直至死亡,说明茄子不定芽经高质量浓度外源激素诱导分化后再转接至低质量浓度的外源激素配比培养基上有利于不定芽迅速生长、伸长.试验中将畸形黄化的不定芽转接至成倍降低6-BA质量浓度或不添加任何外源激素的MS培养基上,培养10~15 d不定芽形态明显改善,再将不定芽转接至不定芽伸长培养基,不定芽正常生长.
3.3苗龄对茄子不定芽萌发的影响
前人研究表明,一般生理上幼嫩材料比老龄材料易于诱导不定芽分化[16-17],本试验表明,对于茄子离体再生培养并非外植体越幼嫩越有利于不定芽分化.11~13 d苗龄的子叶和下胚轴分化不定芽率达到最高点,表明在此苗龄段外植体不定芽分化能力最强,在此之前随着苗龄的减小外植体伤口周围形成的愈伤组织越疏松,颜色越浅,不定芽分化率越小,在此之后随着苗龄增加,外植体不定芽分化率呈下降趋势,与前人的研究结果一致[28-29].
3.4外植体种类对不定芽萌发的影响
影响不定芽形成的另一个因素是外植体种类.据报道茄子用于再生体系的外植体有子叶、叶片、下胚轴、子叶柄、类Flamingo-bill外植体等[30],但曹必好等[31]研究表明茄子子叶再生能力最强.本试验研究比较了茄子子叶、下胚轴和茎段的再生能力,结果也证明子叶的再生能力高于下胚轴和茎段,是茄子再生体系建立的良好外植体材料.试验中发现子叶机械伤口周围迅速产生大量浅绿色疏松愈伤,随着培养时间增加愈伤颜色加深,质地紧密,透出嫩绿的芽点,最后分化成不定芽;下胚轴的形态学上端较其下端容易形成愈伤,且分化出不定芽的概率也较其下端大;茎段在分化培养基上缓慢脱分化形成白色愈伤组织,随着时间增长,茎段形态学上端的愈伤组织颜色逐渐加深,分化出绿色不定芽,茎段形态学下端的愈伤组织不断褐化、萎蔫不再生长,最终死亡.
4结论
本试验研究表明,‘兰杂二号’平均不定芽分化率和不定芽伸长率均显著高于‘兰杂一号’;子叶平均不定芽分化率显著高于下胚轴;外植体苗龄在11~13 d时分化能力最强;诱导‘兰杂一号’不定芽分化的最适激素组合为处理F(2.0 mg/L 6-BA+0.2 mg/L IAA),其不定芽分化率达89.58%,诱导‘兰杂二号’不定芽分化的最适激素组合为处理D(3.0 mg/L 6-BA+0.1 mg/L IAA),其不定芽分化率为(94.79)%;不定芽伸长培养基处理9(0.1 mg/L 6-BA+0.2 mg/L IAA)为两个品种的最宜的不定芽伸长培养基,且不定芽伸长率分别高达91.67%、96.88%;在生根培养基1/2MS培养基作用下植株根系健壮,根长3~4 cm适宜移栽.
参考文献
[1]卢育华.蔬菜栽培学各论[M].北京:中国农业出版社,2000
[2]Arpaia S,Mennella G,Onofaro V.Production of transgenic eggplant(SolanummelongenaL.)resistant to Colorado potato beetle (LeptinotarsadecemlineataSay) [J].Theor Appl Gene,1997,95:329-334
[3]刘独臣,房超,李跃建,等.茄子花药培养诱导胚状体成苗[J].西南农业学报,2008,21(6):1643-1646
[4]程继鸿,赵福宽,高遐虹,等.弱光条件下茄子花药培养再生体系的建立[J].北京农学院学报,2001,16(2):22-26
[5]连勇,刘富中,陈钰辉,等.茄子体细胞杂种游离小孢子培养获得再生植株[J].园艺学报,2004,31(2):233-235
[6]Kazumitsu M.Callus induction and plantlet formation through culture of isolated microspores of eggplant (SolanummelongenaL.)[J].Plant Cell Reports,1996,15:391-395
[7]方岩岩,王益奎,王红,等.红茄子叶的不定芽诱导及植株再生[J].南方农业学报,2013,44(5):751-754
[8]Matsuoka H,Hinata K.NAA-induced organogenesis and embryo genesis in hypocotyl callus ofSolariummelongenaL.[J].Journal of Experimental botany,1979,30:363-370
[9]许勇,王福钧,周长久.粘毛茄子叶原生质体的培养及植株再生[J].植物生理学通讯,1990(4):27-30
[10]Jia J F,Ingo Potrykus.MesophyII protoplasts from Solanum melongena var.depressum Bailey regenerate to fertile plants[J].Plant Cell Rep,1981(1):71-72
[11]Levi A,Ridley B L,Sink K C.Biased organelle transmission in somatic hybrids ofLycopersiconesculentumandSolanumlycopersicoides[J].Current Genetic,1988,14(2):177-182
[12]洪晓华,王瑛华,陈刚,等.茄子的组织培养和植株再生体系的研究[J].北方园艺,2009(6):63-65
[13]于亚军,代汉萍,李宝江.植物激素和生长调节剂在果树组织培养中的应用[J].北方园艺,2002(6):68-70
[14]王霞霞,马晖玲,曹冬梅.大花萱草‘香宝’再生体系的建立[J].甘肃农业大学学报,2014,49(4):136-142
[15]张明华,陈钰辉,刘富中,等.茄子遗传转化植株再生体系的优化[J].长江蔬菜,2014(14):15-20
[16]余波澜,张利明,孙勇如.茄子子叶和下胚轴的组织培养和植株再生[J].植物生理学通讯,2003,39(4):317-320
[17]李俊明.植物组织培养教程[M].北京:北京农业大学出版社,1992:78-88
[18]杨增海.园艺组织培养[M].北京:农业出版社,1987:46-48
[19]Mok M,Mok D,Tumer J,Mujer C.Biological and biochemical effects of cytokinin active phenylurea derivatives in tissue culture systems[J].Hort Science,1987,22(6):1194-1196
[20]张瑞姿.植物生长调节剂在观赏植物组织培养中的应用[J].山西林业,2012(5):39-40
[21]Sripichitt P,Nawata E,Shigenaga S.Invitroshoot forming capacity of copyledon explants in red pepper (CapsicumannuumL.cv Yatsufusa)[J].Japanese Journal of Breeding,1987,37:133-142
[22]黎定军,张宝玺,赵开军,等.辣椒子叶高效植株再生体系的建立[J].园艺学报,2002,29(1):25-29
[23]齐恩方,张金文,王一航.马铃薯茎段再生的植物激素配比优化[J].甘肃农业大学学报,2006,41(6):14-17
[24]Henselova M,Lux A,Masarovicova E.Effect of growth regulators on rooting cuttings of Karwinskia species under in vivo conditions [J].Rostlinna Vyroba,2002,48(10):471-476
[25]Foley J T.Chemical promotion of axillary shoot development of geranium stock plants [J].Journal of Environmental Horticulture,1992,10(2):90-94
[26]欧阳达,张淑贞,付腾腾,等.植物生长调节剂在魔芋愈伤组织培养中的应用研究[J].长江大学学报:自然科学版,2011,8(4):236-239
[27]张玲,岳生梅,王淑华,等.外源激素对‘章姬’草莓茎芽萌法和增殖的影响[J].上海农业学报,2013,29(5):63-66
[28]龙凤,张金文.辣椒子叶和下胚轴的离体培养及高效再生体系的建立[J].甘肃农业大学学报,2005,40(1):31-37
[29]张金文,范兴中,王莹,等.辣椒离体培养及再生体系的研究[J].西北植物学报,2006,26(9):1893-1899
[30]龚静,褚云霞,许爽,等.茄子子叶下胚轴离体再生体系建立[J].北方园艺,2011(15):151-154
[31]曹必好,雷建军,王勇.茄子离体培养高效再生体系的建立[J].中国蔬菜,2008(增刊):12-15
(责任编辑赵晓倩)
Establishment of high-efficient regeneration system of two cultivars ofSolanummelongena
ZHANG Ling,WANG Yan-xiu,CHEN Bai-hong,WANG Shu-hua,SHI Xiao-yun,DANG Zhao-xia
(College of Horticulture,Gansu Agricultural University,Lanzhou 730070,China)
Abstract:【Objective】 The research was order to establish the high-efficient regeneration system of Solanum melongena laying foundation of genetic transformation and germplasm innovation.【Method】 Two cultivars of Solanum melongena 'Lanza I' and 'lanza II'were used to research the effects of genotypes,explant types,seedling age and plant exogenous growth regulators combinations on adventitious bud differentiation and elongation of Solanum melongena explants.【Result】 Adventitious buds differentiation rate 'lanza II' was higher than that of 'Lanza I'.The cotyledons of Solanum melongena had stronger regenerative capacity than hypocotyls and stem cutting.Seedlings aged 11-13 d had higher differentiation rate.The 6-BA/IAA ratio maximized the differentiation and regeneration of 'lanza I' at 10∶1 with 89.58% and 'lanza II'at 30∶1 with 94.79%.The 6-BA/IAA ratio at 1∶2 was beneficial to bud elongation of the two cultivars with 91.67% and 96.88%,respectively.【Conclusion】 The optimal differentiation medium were MS+2.0 mg/L 6-BA+0.2 mg/L IAA for 'Lanza I' and MS+3.0 mg/L 6-BA+0.1 mg/L IAA for ‘lanza II’.The suitable medium for bud elongation was MS+0.1 mg/L 6-BA+0.5 mg/L IAA.The optimal rooting medium was 1/2 MS.
Key words:Solanum melongena;regeneration system;cotyledon;hypocotyls;adventitious bud
通信作者:王延秀,女,副教授,博士,研究方向为果树栽培生理及技术.E-mail:wangxy@gsu.edu.cn
基金项目:教育部春晖计划项目(z2005-2-62012).
收稿日期:2015-03-11;修回日期:2015-04-21
中图分类号:S 641.1
文献标志码:A
文章编号:1003-4315(2016)01-0062-07
第一作者:张玲(1987-),女,硕士研究生,研究方向为果树生物技术.E-mail:zhanggsau@126.com

