翻白草对CCl4所致慢性肝损伤大鼠肝组织中SOD、MDA、GSH水平的影响①
蔡 纲,黄 平,李绍民
(1.佳木斯大学附属第一医院,黑龙江 佳木斯 154003;2.都昌县新型农村医疗合作局,江西 都昌 332600)
翻白草对CCl4所致慢性肝损伤大鼠肝组织中SOD、MDA、GSH水平的影响①
蔡纲1,黄平2,李绍民1
(1.佳木斯大学附属第一医院,黑龙江 佳木斯 154003;2.都昌县新型农村医疗合作局,江西 都昌 332600)
摘要:目的:观察翻白草对CCl4慢性肝损伤大鼠肝组织SOD、MDA和GSH 的影响, 验证其对CCl4慢性肝损伤抗氧化保护作用。方法:分别设空白对照组、模型对照组、低剂量组、高剂量组。检测各组大鼠肝组织中SOD、MDA和GSH含量。结果:翻白草可降低模型大鼠肝组织MDA 作用,阻止GSH、SOD 的消耗, 提高GSH、SOD 活性。结论:翻白草能够对抗大鼠肝组织内CCl4引起过氧化反应, 提高模型大鼠肝脏抗氧化能力,对肝脏细胞和功能有一定的保护作用。
关键词:翻白草;慢性肝损伤;四氯化碳
翻白草是多年生草本植物,隶属蔷薇科,其根部肥大、单数羽状复叶,全草皆可入药,适合生长于低丘山坡和疏林下草地,在我国有比较广泛的分布黑龙江、辽宁、江西、广东、陕西等省份均可生长。翻白草,作为一种常用药材,其历史悠久,最早可追朔于《救荒本草》。《本草纲目》亦有记载,称其鸡腿儿,治吐血,下血,崩中,疟疾,痈疮。临床上翻白草煎剂常用来治疗痢疾、出血性疾病等[1]。近代,随着中医药学及其研究方法的发展,发现翻白草安全性好,毒性极低[2],含有多种活性成分及作用。有研究发现翻白草可改善2型糖尿病患者的胰岛素抵抗,能很好促进肝细胞糖类物质的代谢,有显著的降低血糖作用[3,4];张远荣等的研究结果表明翻白草中的鞣质成分具有较好的体外抗氧化作用[5];李永明等的研究提示翻白草可以提高高血脂大鼠血清中的抗氧化物质活性[6];李忠秀等研究表明翻白草油可有效抑制肝癌HepG2细胞的异常增殖[7]。综上,笔者抛砖引玉,通过实验评价翻白草煎剂对CCl4所致慢性肝损伤大鼠肝组织中SOD、MDA、GSH水平的影响,探讨翻白草煎剂对肝脏的氧化保护作用,为翻白草用于治疗肝脏疾病提供理论依据。
1材料和方法
1.1实验动物分组、造模和处理
1.1.1实验动物
Wistar大鼠,由佳木斯大学动物实验中心提供,6~7周龄,标准体重,80只。
1.1.2实验动物分组
适应性喂养5d后,对实验动物进行分组。取随机数字将其分成空白对照组、模型对照组,低剂量组、高剂量组共四组,每组20只。
1.1.3造模和处理
对上述四组分别做如下处理:模型对照组、低剂量组和高剂量组:给予给予新鲜配制的40%四氯化碳玉米油溶液1.5mL·kg-1bw腹腔注射;给予空白对照组动物注射同等剂量的玉米油;各组均每三天注射一次。处理组每日分别给予0.6mL/100g体重翻白草水煎剂灌胃,其中低剂量组使用1.0g/mL浓度溶液(相当于生药量6g/kg体重)、高剂量组使用2.0g/mL浓度溶液(相当于生药量12g/kg体重)。正常对照组、模型对照组灌胃相同体积的生理盐水。持续8周。
1.2药材和煎剂的制备
翻白草购于佳木斯大学附属第一医院门诊中药局。称取翻白草干草1kg水洗、浸泡,文火煎煮, 过滤、浓缩制成生药含量分别为1.0g/mL、2.0g/mL的溶液备用。
1.3取材和试剂
1.3.1取材
于处理8周后,停止所有处理因素48h,禁食不禁水12h后处死大鼠,取大鼠肝脏0.4g, 经冰生理盐水漂洗后,用滤纸拭干, 称重,在冰浴的平皿上剪碎, 用手动匀浆器将其在冰生理盐水中制成含肝组织10%匀浆,低温离心,取上清液测定。
1.3.2主要试剂
四氯化碳和市售玉米油配制的30%四氯化碳玉米油溶液。SOD活性,GSH、MDA含量测定试剂盒购于南京建成生物工程研究所,上述测定按试剂盒说明书操作进行。
1.4统计学方法
2结果
2.1实验动物情况
至实验结束,实验大鼠共死亡18只,存活62只,分别为空白对照组死亡2只、模型对照组死亡6只、低剂量组和高剂量组各5只。对存活大鼠按上述方法采集数据,进行统计学处理。
2.2翻白草对大鼠肝组织SOD活性的影响
与空白对照组比较,其余三组肝组织内SOD活性均有不同程度下降(P<0.05)。和模型对照组比较,翻白草低剂量组和高剂量组SOD活性明显升高(P<0.05)。翻白草煎剂的低剂量组、高剂量组处理可以提高本模型中大鼠肝组织中SOD含量。
2.3翻白草对大鼠肝组织MDA含量的影响
与空白对照组比较,其余三组肝组织内MDA含量均有不同程度增加(P<0.05)。和模型对照组比较,翻白草低剂量组和高剂量组MDA含量明显减少(P<0.05)。翻白草煎剂的低剂量组、高剂量组处理可以减少本模型中大鼠肝组织中MDA含量。
2.4翻白草对大鼠肝组织GSH含量的影响
与空白对照组比较,其余三组肝组织内GSH含量均有不同程度减少(P<0.05)。和模型对照组比较,不能认为翻白草低剂量组和模型对照组肝组织中GSH含量有差别(P>0.05),可以认为翻白草高剂量组GSH含量增加(P<0.05)。翻白草煎剂的高剂量组处理可以增加本模型中大鼠肝组织中GSH含量。
4组大鼠肝组织中SOD、MDA、GSH含量有差别(P<0.05)。为明确空白对照组、模型对照组和处理组间的差别用LSD检验对其进行两两比较,见表1~2。
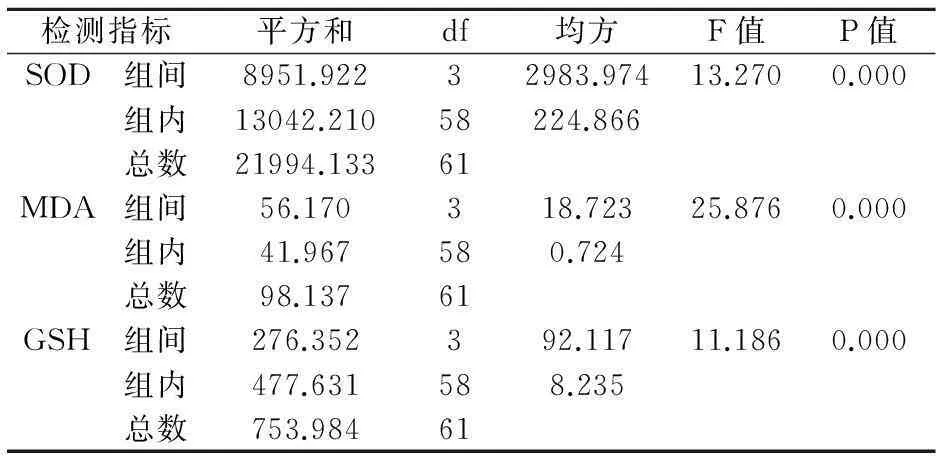
表1 翻白草对CCl4 慢性肝损伤大鼠肝脏SOD、

表2 翻白草对CCl4 慢性肝损伤大鼠肝脏SOD、MDA、GSH 的影响
*P<0.05和空白对照组比较;△P<0.05和模型对照组比较。
3讨论
肝损伤的发生形式多样,发生机制复杂。CCl4常用于诱导化学性肝损伤, 40%CCl4植物油溶液,1.5mL·kg-1bw剂量腹腔注射,可诱导大鼠较为稳定的慢性肝损伤[8]。四氯化碳进入体内后被肝脏微粒体色素P450激活,形成活泼的三氯甲基和氯自由基,与肝细胞溶酶体、微粒体、内质网的脂蛋白结合,产生脂质过氧化作用,从而导致肝脏损伤[9]。伴随着脂质过氧化过程的发生,相应的脂质过氧化产物(如活性氧自由基、MDA等)也会增加,MDA含量测定常用于评价脂质过氧化程度,也可作为间接评价细胞氧化损伤的指标[10]。SOD活力维持在正常水平,是保护肝脏机能所必须的,对预防、修复氧化应激引起肝损伤中具有重要的作用,SOD活力可间接反应机体清除活性氧自由基(ROS)的能力[11]。GSH是生物体内一种很重要的抗氧化剂和自由基清除剂,对维持细胞膜的结构和功能具有重大意义。张丽等的研究示,GSH有抗肝纤维化作用,且一定的剂量依赖关系,随着GSH浓度的增加,抑制作用更明显[12]。MDA、SOD和GSH三指标的测定常相互配合,用于评价机体氧化应激和抗氧化应激系统平衡,或这种平衡失衡造成的氧化损伤状态。
本次实验研究结果表明,翻白草可以提高CCl4致肝损伤大鼠肝脏匀浆中GSH和SOD活性,减少MDA的生成,从而提高本模型中大鼠肝脏抗氧化能力,其作用机制可以认为翻白草对肝脏细胞和功能有一定的保护作用。其抗氧化能力是否存在药物剂量依赖关系,是否能对抗慢性肝损害所导致的肝纤维化、肝硬化病情进展,还需要进一步的研究去证实。
肝脏作为糖类代谢的主要器官,近年来,很多研究都表明肝脏损伤导致的肝硬化、肝纤维化和糖尿病之间有明显联系。翻白草还有促进肝脏糖类物质代谢,调节血糖和胰岛素抵抗等作用,那么它的这些作用与保护肝脏之间有没有联系?很明显,组织器官机体功能的改善也能提高抗氧化能力。翻白草中含多种活性成分,其作用机制和途径亦是多样。本模型中大鼠肝内抗氧化物质的提高,可能既是护肝机制,也是肝脏机体功能改善的结果,这需要更多的研究去发现、挖掘。
参考文献:
[1]邹俊利. 翻白草的研究进展[J].黑龙江医药科学,2006,29(4):104
[2]苏建华,周明瑶,李颖,等.翻白草对大鼠的长期毒性实验[J].中医药学报,2010,38(3):41-43
[3]孙海峰,常虹,郭雪莹,等.胰岛细胞损伤体外模型的建立及在药物筛选中的应用[J].中医药学报,2012,40(3):53-56
[4]张红芝. 翻白草降糖作用及对肝细胞糖代谢影响的研究[D]. 北京: 中国农业大学食品科学与营养工程学院,2005
[5]张远荣,王锋. 翻白草鞣质的体外抗氧化作用研究[J]. 中国药房,2011,11(22):983-985
[6]李永明,许丽,郑海洪.翻白草对大鼠高血脂模型的降血脂及抗氧化作用[J].实验研究,2012,26:723-24
[7]李忠秀,王淑秋, 刘蕾, 等. 翻白草油对肝癌HepG2细胞CDK4蛋白的影响[ J] .黑龙江医药科学, 2011, 34(2):24-25
[8]张海燕,温韬,卢静,等. 四氯化碳诱导大鼠慢性肝损伤模型方法的探讨[J]. 实用肝脏病杂志,2009,(3):68
[9]方厚华. 医学实验模型动物[M].北京:军事医学科学出版社,2002:118
[10]范强,阿地力江·伊明. 小茴香对肝纤维化大鼠脂质过氧化水平的影响[J].现代生物医学进展,2011,(21):4043-4046
[11]王君明,崔瑛,王峥涛,等. 超氧化物歧化酶参与肝损伤的研究进展[J]. 中国实验方剂学杂志,2011,17(7):265-269
[12]张丽,赵龙凤. 还原型谷胱甘肽对大鼠肝星状细胞增殖及活化的影响[J]. 中国医疗前沿, 2011, 6(22):3-5
(收稿日期:2015-05-14)
中图分类号:R285.1
文献标识码:A
文章编号:1008-0104(2016)01-0033-02
作者简介:蔡纲(1982~)男,江西都昌人,在读硕士研究生。通讯作者:李绍民(1966~)男,黑龙江佳木斯人,主任医师,教授,硕士研究生导师。E-mail:1255013304@qq.com。
基金项目:佳木斯大学研究生创新基金项目,编号:LM2015-036。

