小鼠原发性肝癌建模方法的优化
顾洪伟,陈琦,张炜,李玉桑,唐和斌
(中南民族大学药学院药理学研究室,武汉 430074)
研究报告
小鼠原发性肝癌建模方法的优化
顾洪伟,陈琦,张炜,李玉桑*,唐和斌
(中南民族大学药学院药理学研究室,武汉430074)
【摘要】目的建立良好、快捷、稳定的小鼠原发性肝癌模型。方法将128只雄性KM小鼠随机均分为8组:正常组给予自由饮食;二乙基亚硝胺(DEN)水溶液组每天给予含DEN(16.5 mg/kg)的水溶液;高剂量DEN麻油组(7次/周、3次/周、1次/周),经口给予含DEN(16.5 mg/kg)的麻油溶液;而低剂量DEN麻油组、nano-DEN组、纳米载体组则分别每周经口给予含DEN(8.25 mg/kg)的麻油溶液和nano-DEN或同量的纳米载体。20周后,处死小鼠,取肝脏标本,固定后行HE染色。结果(1)含DEN的各组小鼠均出现不同程度毛色枯燥、无光泽、行动迟缓、体重增长缓慢;(2)20周时,同DEN水溶液组,高剂量DEN麻油组小鼠均出现肿瘤,且其1次/周的小鼠死亡率较低;(3)Nano-DEN组小鼠无死亡,且其肝脏损伤的HE评分较低剂量DEN麻油组严重。结论DEN溶于麻油的经口给药增加了小鼠服药的顺应性,长期低频率给药能大大降低造模过程中的死亡率。而DEN的纳米微乳制剂,能增强对肝脏的损伤程度。
【关键词】二乙基亚硝胺;原发性肝癌;纳米二乙基亚硝胺
原发性肝癌是最常见的消化系统恶性肿瘤之一,在我国其发病率和死亡率均为世界首位,是严重危害健康的重大疾病[1]。遗憾的是其发生机制尚未完全阐明。因此,深入研究肝癌的发病机制,通过明确其发病机理来寻找防治肝癌的有效手段,是改善人类健康的重大科学问题之一[2]。
要研究肝癌的发生机制,首先要建立与人类肝癌自然发生过程相似的动物模型。常见的肝癌动物模型有:自发性肝癌模型、移植型肝癌模型、转基因肝癌模型、化学诱发性肝癌模型。自发性肝癌由于发生情况不均,很难在短时间内获得大量类似的肿瘤学材料,且观察时间长,实验耗费较大,故在实际科研工作中较少使用。移植性肝癌模型操作繁杂,成功率依赖于技术的成熟性,因此较难获得;转基因动物肝癌模型制作技术要求极高,价格昂贵,国内开展的研究尚较少;化学诱发性肝癌模型操作简便,稳定性强,成本低,且能较好的模拟人类肝癌的自然病理过程,制作方法简单,是最常用的建模方法之一[3]。化学诱发型肝癌模型最经典方法的是将二乙基亚硝胺(DEN)溶于水中,给予小鼠自由饮用[4]。本实验改变了给药方式,即将DEN溶于麻油中经口给药,并探讨了不同给药频率对小鼠死亡率的影响。
随着纳米技术的快速发展,纳米材料因其具有靶向定位、缓释控释药物、载药量高、提高药物吸收率等优点而在药物传输、癌症治疗、基因治疗等领域得到广泛应用[5-8]。但是利用其负面生物效应,在造模领域的应用却未见报道,本实验期望通过DEN纳米化,以达到缓释及增强对肝脏损伤的作用,从而在短时间内建立原发性肝癌的动物模型。
1材料与方法
1.1实验动物
SPF级雄性KM小鼠,6~8周龄,体重18~22 g,购自湖北省实验动物研究中心[SCXK(鄂)2008-0005],动物实验内容及操作均获中南民族大学动物实验伦理委员会审批许可后[2012-SCUEC-AEC-002],在中南民族大学药学院SPF级屏障实验设施中进行[SYXK(鄂)2014-0078]。实验前适应性喂养1周,并按实验动物使用的3R原则给予人道的关怀。对小鼠的处理符合2006年中国科学技术部发布的《关于善待实验动物的指导性意见》[9]。
1.2试剂与仪器
二乙基亚硝胺(DEN,淡黄色液体,密度为0.94 g/mL)购自“梯希爱”上海化成工业发展有限公司;麻油购自武汉福达食用油调料有限公司;苏木精购自南京建成科技有限公司;伊红购自美国Amresco公司;多聚甲醛、无水乙醇、二甲苯购自国药集团化学试剂有限公司。TP1020脱水机(德国Leica公司);EG0050H石蜡包埋机(德国Leica公司);RM2265切片机(德国Leica公司);ALC-210.3型电子分析天平(德国Acculab公司);Nikon 50i显微成像系统(日本Nikon公司)。
1.3实验方法
1.3.1诱癌剂配制
取347.5 μL(即330 mg)的DEN原液,加至5000 mL无菌蒸馏水中,即66 μg/mL的DEN水溶液为DEN水溶组小鼠的饮用水;取0.5 mL(即470 mg)的DEN原液加至10.9 mL麻油中,即41.25 mg/mL的DEN麻油溶液做高剂量DEN麻油组小鼠的诱癌剂;取0.25 mL(即235 mg)的DEN原液加至11.1 mL麻油中,即20.625 mg/mL的DEN麻油溶液做低剂量DEN麻油组小鼠的诱癌剂;Nano-DEN及纳米载体由华中科技大学纳米中心赵小静博士制备(将4%的DEN溶于15.6%的麻油中,再加入1.2%蛋黄卵磷脂,溶解混匀,制成油相;将1% Tween 80和2.25%甘油加入75.55%的水中,制成水相;60℃条件下,油相滴入水相中,搅拌15 min;然后10 000 r/min高剪切2 min;最后100 Mpa高压均质5次即得到nano-DEN。纳米载体油相为1.2%蛋黄卵磷脂溶于20%的麻油中,其余步骤与nano-DEN的制备相同),nano-DEN终浓度为含20.625 mg/mL DEN。
1.3.2分组与DEN及nano-DEN诱导肝癌
将128只KM小鼠预饲养适应环境一周后分笼饲养,随机取16只作为正常组,常规自由饮水。其余小鼠随机均分为7组,每组16只小鼠:二乙基亚硝胺(DEN)水溶组每天按体重给予16.5 mg/kg(即2.5 mL/10 g)的DEN水溶液,且每天以普通过滤水补充不足;经口高剂量组(7次/周、3次/周、1次/周)每周按体重经口给予16.5 mg/kg(即4 μL/10g)的DEN麻油溶液;而经口低剂量组(1次/周)、纳米载体组(1次/周)、nano-DEN组(1次/周)则分别每周按体重经口给予8.25 mg/kg(即4 μL/10g)的DEN麻油溶液、纳米载体、nano-DEN。连续造模20周后,各组剩余小鼠腹腔注射戊巴比妥钠,深度麻醉后快速脱臼处死,打开腹腔,取肝脏、肺和肾脏,取部分肝脏组织保存于-80℃冰箱中用于后续检测。
1.3.3小鼠行为学及肝脏大体观
每天观察小鼠精神状态,饮食状况,被毛变化,并每周称重,记录每组小鼠死亡数;造模20周后,观察各组剩余小鼠肝脏的形态、颜色、质地和肉眼可见的肝表面癌结节数;计算小鼠存活率,存活率=每组存活的小鼠数/各组小鼠总数 × 100%。
1.3.4病理观察
切取所有实验组小鼠(包括前期死亡)的肝脏右叶,4%多聚甲醛溶液固定24 h,常规石蜡包埋,切片机制成4 μm连续石蜡切片;同步烤片,然后脱蜡,梯度酒精水化,苏木精-伊红染色(hematoxylin and eosin,HE)染色。梯度酒精脱水,二甲苯透明,树脂封片;光镜下胞质染为红色,细胞核染为蓝色。
1.4统计学处理
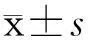
2结果
2.1各组小鼠行为学及体重变化
正常组及纳米载体组小鼠活泼好动、反应灵活、皮毛光泽,其余各组小鼠均出现不同程度毛色枯燥、发黄、无光泽、行动迟缓。且随着给药频率和给药剂量的增加,小鼠症状加重。与正常组相比,纳米载体组、低剂量DEN麻油组、nano-DEN组小鼠体重无明显差异,而DEN水溶组及高剂量DEN麻油组小鼠体重均明显低于正常组小鼠。各组体重变化,见图1 A, B。
2.2各组小鼠存活率
造模过程中,正常组、纳米载体组、低剂量DEN麻油组、nano-DEN组均未出现小鼠死亡,未发现原发性肝癌的发生。20周时,DEN水溶组小鼠的死亡率为75%(图1 C),存活4只小鼠均有肉眼可见肿瘤结节;高剂量DEN麻油(7次/周)组小鼠死亡率为75%,存活4只小鼠均有肉眼可见肿瘤结节;高剂量DEN麻油(3次/周)组小鼠的死亡率为37.5%,存活10只小鼠中有5只肉眼可见肿瘤结节,有1只小鼠虽未见肉眼肿瘤结节,但镜下可见肿瘤结节;高剂量DEN麻油(1次/周)组小鼠的死亡率为25%,存活12只小鼠中有5只肉眼可见肿瘤结节。
注: A.正常组(NG);B. DEN水溶组(DWG);C. 高剂量DEN麻油每周7次组(HDO7G);D. 高剂量DEN麻油每周3次组(HDO3G);E. 高剂量DEN麻油每周1次组(HDO1G);F. 低剂量DEN麻油每周1次组(LDO1G);G. 纳米载体组(NVG);H.纳米DEN每周1次组(NDG)。与正常组比较,***P<0.001。图1 诱癌过程中各组小鼠的体重变化及死亡率Note. NG: Normal group; NVG: Nano-vehicle group; HDO7G: High-dose DEN-oil (7 times per week) group; HDO3G: High-dose DEN-oil (3 times per week) group; HDO1G: High-dose DEN-oil (once per week) group; LDO1G: Low-dose DEN-oil (once per week) group; NG1G: Nano-DEN (once per week) group. ***P<0.001, compared with the normal group.Fig. 1 The changes of body weight (A, B) and survival rates (C) of mice in various groups during the liver carcinogenesis.
2.3小鼠肝脏肉眼和病理观察
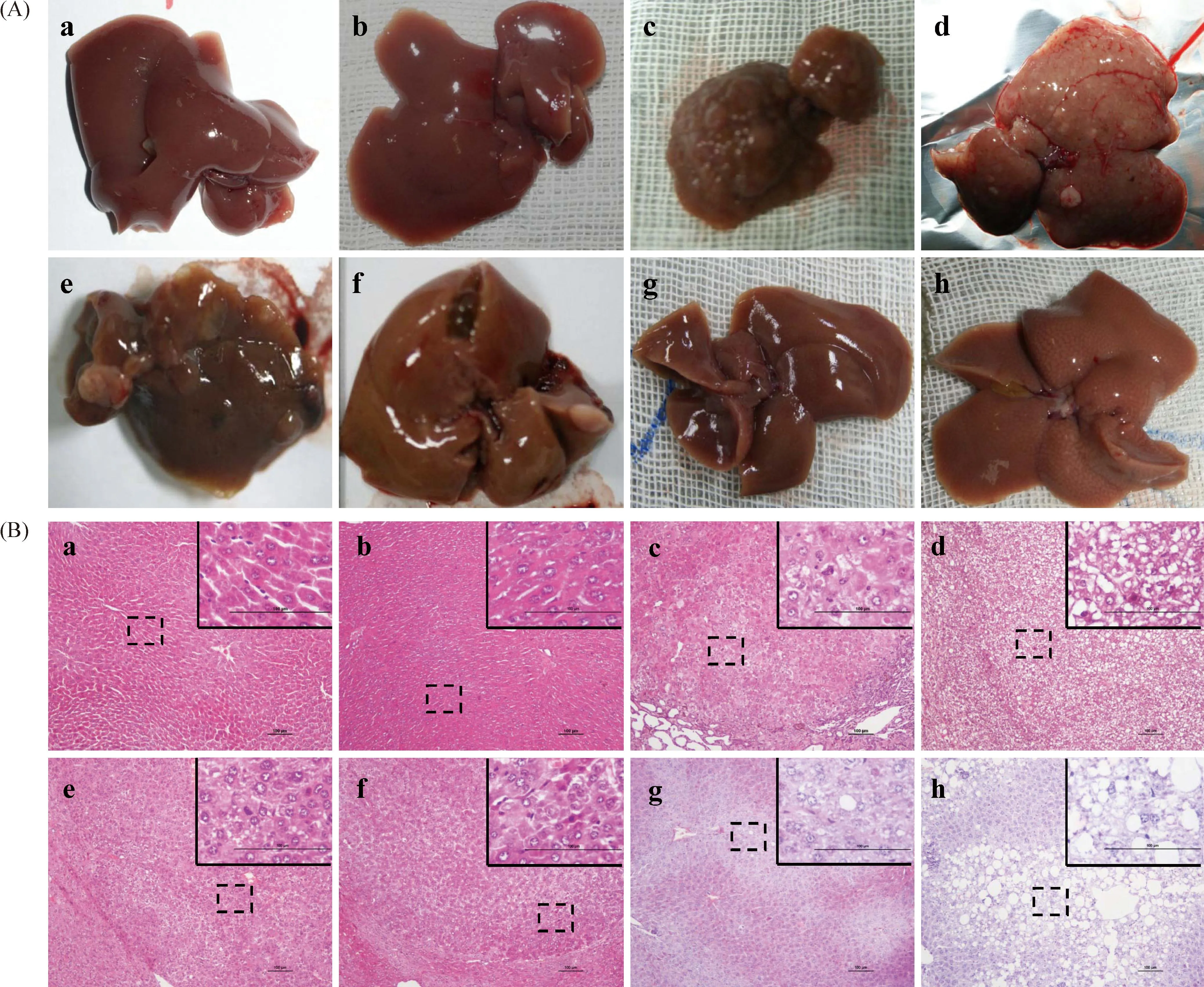
注:(A)和(B)中,a.正常组;b.纳米载体组;c.DEN水溶组;d.高剂量DEN麻油每周7次组;e.高剂量DEN麻油每周3次组;f.高剂量DEN麻油每周1次组;g.低剂量DEN麻油每周1次组;h.纳米DEN每周1次组。(B)中标尺为100 μm,右上角为黑框中所示局部图(×100)的放大图(×400)。图2 20周时,各组小鼠肝脏肉眼观及肝脏组织病理学观Note. (A, B) a: Normal group; b: Nano-vehicle group; c: High-dose DEN-oil (7 times per week) group; d: High-dose DEN-oil (3 times per week) group; f: High-dose DEN-oil (once per week) group; g: Low-dose DEN-oil (once per week) group; h: Nano-DEN (once per week) group. (B) Part of the arbor (stippled outline, ×100) is shown enlarged in the inset (×400) in the top right-hand corner, Scale bar=100 μm.Fig. 2 Representative pictures of the gross liver appearance (A) and their histological images (B)(HE staining) from various groups at the 20th week.
肝脏组织标本的肉眼观察,正常组及纳米载体组小鼠肝脏色泽鲜红,表面光滑,质地柔软,未见任何病变,见图2 A(a, b)。而前期死亡小鼠大体检查则见其肝脏肿大、颜色偏黄,部分可见边缘发黑。水溶DEN及高剂量DEN麻油组肉眼均可见的肿瘤结节。小鼠肝脏表面较多结节,表面粗糙,色彩暗淡,可见多个大小不一的灰白色圆形结节,见图2A(c, d, e, f)。另有小鼠肉眼未见肝脏肿瘤结节,但肝脏表面粗糙,颜色暗淡。Nano-DEN组小鼠肝脏体积增大,肉眼可见白色颗粒,见图2A(h)。其余脏器肉眼观未见其他肿瘤结节发生。
光镜下观察,正常及纳米载体组小鼠肝细胞排列整齐,核大小一致,且分布均匀,肝细胞索围绕中央静脉,呈放射状分布,肝窦清晰,见图2B(a, b)。而前期死亡小鼠肝组织镜检则可见急性大面积肝细胞肿胀、坏死,尚未见肿瘤形成。DEN水溶及高剂量DEN麻油组小鼠,明显可见具有被膜形成的结节灶,细胞排列结构紊乱,大小、形态各异,染色质明显增粗,胞质丰富,可见病理性核分裂像,分化较差的肝细胞内可见巨核,表明细胞异型性明显,见图2B(c, d, e, f)。低剂量DEN麻油组及nano-DEN组出现肝细胞变性坏死,炎细胞浸润,大量空泡脂肪变性,且nano-DEN组较经口低剂量组严重,见图2B (g, h)。
3讨论
化学诱导型肝癌模型是研究肝癌最好的模型之一,DEN是迄今应用最广泛的一种化学诱导型肝癌模型制剂[10]。并且亚硝胺类化合物普遍存在于谷物、牛奶、干酪、烟酒、熏肉、烤肉、海鱼、罐装食品以及饮水中[11]。传统造模方法将DEN溶于水中,给予小鼠自由饮用,但是往往实验周期比较长,个体差异大,且死亡率高[12]。实验过程中,由于多种条件的限制,尤其是实践方面,死亡率方面的制约,要求我们必须建立更好、更快的造模方法。本实验的研究思路围绕该目的所展开。
本实验发现,传统造模方法即将DEN溶于水中给予小鼠自由饮用,小鼠顺应性差,个体差异大,且死亡率高。通过将DEN溶于麻油经口给药增加了小鼠服药的顺应性,克服了DEN水溶造模小鼠之间的个体差异。二十周时,DEN水溶组及经口高剂量组小鼠肉眼均可见肿瘤结节,但1次/周经口给药组小鼠死亡率最低,即长期低频给药能大大降低造模过程中的死亡率。
为了更好地模拟人们可能因长期接触环境中有毒、有害化学物质,以及长期服用肝毒性药物造成肝脏损伤甚至肝癌的情况,本实验设立了低剂量DEN麻油组及nano-DEN组。二十周时,低剂量DEN麻油组及nano-DEN组小鼠肝脏均见细胞坏死,炎细胞浸润及脂肪化,且nano-DEN组较低剂量DEN麻油组严重。表明DEN经纳米化后对肝脏产生更为严重的损伤。Nano-DEN有望作为建立原发性肝癌更好的诱导剂。
理想的肝癌动物模型应与人类大多数肝癌病理组织类型相一致,具有合适的肿瘤体积、生长速度和存活时间,肿瘤的组织类型、生物学特点应相对稳定,操作简便,复制迅速,成功率高,重复性好[13]。本实验采用实验室广泛使用的KM小鼠,以DEN为诱癌剂,通过经口给药,20周时成功建立了小鼠原发性肝癌模型,并克服了DEN水溶造模的缺陷。由于诱导肝癌是通过小剂量长时间的刺激肝脏癌变,一般实验时间需要18~24周,而将DEN纳米化后,能增强DEN对肝脏的损伤作用,因此nano-DEN有望能在更短时间内建立原发性肝癌动物模型。
参考文献
[1]Song P, Tang W, Tamura S, et al. The management of hepatocellular carcinoma in Asia: A guideline combining quantitative and qualitative evaluation [J]. Biosci Trends, 2010, 6: 283-287.
[2]Tang ZY, Ye SL, Liu YK, et al. A decade’s studies on metastasis of hepatocellular carcinoma [J]. J Cancer Res Clin Oncol, 2004, 130: 187-196.
[3]刘煌, 刘静. 肝癌动物模型的研究进展 [J]. 世界华人消化杂志, 2011, 19(12): 1275-1278.
[4]Shen T, Khor SC, Zhou F, et al. Chemoprevention by lipid-soluble tea polyphenols in diethylnitrosamine/phenobarbital-induced hepatic pre-cancer lesions [J]. Anticancer Res, 2014, 34(2): 683-693.
[5]Qu L, Cao WB, Xing GG, et al. Study of rare earth encapsulated carbon nanomolecules for biomedical uses [J]. J Alloy Compound, 2006, 408-412.
[6]Tang N, Du G, Wang N, et al. Improving penetration in tumors with nanoassemblies of phospholipids and doxorubicin[J]. J Natl Cancer Inst, 2007, 99(13): 1004-1015.
[7]Zhao XJ, Chen Q, Tang HB, et al. Codelivery of doxorubicin and curcumin with lipid nanoparticles results in improved efficacy of chemotherapy in liver cancer [J]. Int J Nanomed, 2015, 10: 257-270.
[8]Li Z, Zhu S, Gan K, et al. Poly-L-lysine-modified silica nanoparticles: a potential oral gene delivery system [J]. J Nanosic Nanotechnol, 2005, 5(8): 1199-1203.
[9]中华人民共和国科学技术部.关于善待实验动物的指导性意见[S]. 2006-09-30.
[10]Ogawa. Molecular pathology of early stage chemically induced hepatocarcinogenesis [J]. Pathol Int, 2009, 59(9): 605-622.
[11]曾瑶池, 胡敏予. 食物中N-亚硝基化合物与肿瘤关系的研究进展 [J]. 中华肿瘤防治杂志, 2008, 15(2): 151-155.
[12]张立洁, 杨春. 化学性药物诱发肝癌模型的研究进展 [J]. 医学研究杂志, 2009, 38(6): 12-14.
[13]王楚盈, 李超英,张大方. 肝靶向动物模型研究与展望 [J]. 中国比较医学杂志, 2008, 18(2): 63-67.
Optimization of the establishment method of mouse model of hepatocellular carcinoma
GU HONG-wei, CHEN QI, ZHANG WEI, LI Yu-sang*, TANG He-bin
(Department of Pharmacology, College of Pharmacy, South-Central University for Nationalities, Wuhan 430074, China)
【Abstract】ObjectiveTo develop an efficient, fast and stable establishment method of mouse model of hepatocellular carcinoma. Methods 128 healthy Kunming male mice were equally divided into eight groups: normal group supplied with routine drinking water and food; diethylnitrosamine (DEN)-water group received 16.5 mg/kg DEN in drinking water every day; high-dose DEN-oil groups received orally 16.5 mg/kg of DEN oil solution once, 3 times and 7 times per week, respectively; low-dose DEN-oil group and nano-DEN group received orally 8.25 mg/kg DEN in oil or in nano-vehicle every week, while nano-vehicle group received only an equal amount of nano-vehicle. After twenty weeks, all mice were sacrificed. The paraffin-embedded mouse liver specimens were examined by pathology using HE staining. Results (1) The mice treated with DEN solution showed dry and dull hair, slow movement and slow weight-gain to a varying degree. (2) At the twentieth week, both the DEN-water group and high-dose DEN-oil group showed tumors, and the mortality of high-dose DEN-oil group (once per week) was low. (3) There was no death of mice in the nano-DEN group, and the pathological examination revealed more serious liver injury in the nano-DEN group than in the low-dose DEN-oil group (once per week). Conclusions Oral administration of DEN-oil improved the dietary compliance of mice, and the mortality can be reduced significantly by long-term low frequency DEN administration. Microemulsion preparation of DEN dissolved in oil may enhance the DEN-induced liver damage.
【Key words】Diethylnitrosamine; Hepatocellular carcinoma; Nano-diethylnitrosamine
[收稿日期]2015-09-01
Corresponding author:LI Yu-sang, E-mail: liys2006@mail.scuec.edu.cn
Doi:10.3969/j.issn.1005-4847.2016.01.004
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016) 01-0020-05
[作者简介]顾洪伟(1990-),男,硕士研究生,专业:中药药理。E-mail: ghw901025@126.com[通讯作者]李玉桑(1972-),女,教授,研究方向:原发性肝癌的形成机制与药物干预。E-mail: liys2006@mail.scuec.edu.cn
[基金项目]国家自然科学基金资助项目(No. 81101538; No. 81573887);中南民族大学中央高校科研基金(No.CZZ15007);湖北省自然科学基金项目(No. 2015CFB496)。

