高寒草甸种间性状差异和物种均匀度对物种多样性与功能多样性关系的影响
陈 超, 朱志红, 李英年, 姚天华, 潘石玉, 卫欣华, 孔彬彬, 杜家丽
1 陕西师范大学生命科学学院, 西安 710062
2 中国科学院西北高原生物研究所, 西宁 810008
高寒草甸种间性状差异和物种均匀度对物种多样性与功能多样性关系的影响
陈超1, 朱志红1,*, 李英年2, 姚天华1, 潘石玉1, 卫欣华1, 孔彬彬1, 杜家丽1
1 陕西师范大学生命科学学院, 西安710062
2 中国科学院西北高原生物研究所, 西宁810008
摘要:物种多样性(SD)与功能多样性(FD)之间存在多种关系,但由于生态系统功能主要由物种的功能属性决定,因而功能多样性对生态系统功能的影响大于物种多样性的影响。但在种间性状差异和物种均匀度这两个构成功能多样性的基本成分中,何者对功能多样性影响更大,并进而决定SD-FD关系尚不明确。通过在高寒矮嵩草(Kobresia humilis)草甸为期6a的刈割(留茬1 cm、3 cm及不刈割)和施肥(尿素7.5 g m-2a-1+磷酸二胺1.8 g m-2a-1、不施肥)控制实验,研究了种间性状差异(33个物种13个性状)和物种均匀度(所有物种)对物种多样性(所有物种)与功能多样性(33个物种13个性状)之间关系的影响。研究结果显示:(1)物种多样性与功能多样性正相关,它们与多性状种间差异负相关,而与物种均匀度正相关。物种均匀度是导致功能多样性变化的主要因素,也是导致SD-FD正相关的原因,这是因为随着物种多样性增加,物种均匀度的增加程度大于多性状种间差异的减少程度,因而功能多样性增加,SD-FD正相关;(2)功能多样性指数(FDRao和FDis)随物种多样性指数(H′)减速递增,表明群落存在一定的功能冗余,且功能冗余随物种多样性的增大而增大,但尚未达到产生SD-FD无相关性的极限H′值;(3)功能多样性对高寒草甸生态系统地上净初级生产力(ANPP)的影响大于物种多样性的影响,二元线性回归显示在同时考虑二者对ANPP的影响时,可排除物种多样性的作用。但由于物种多样性下降或物种丧失引起的物种功能性状丢失或性状空间维度减小将导致功能多样性降低,表明它们之间存在一定互补性,在研究生物多样性与生态系统功能关系时,同时考虑物种多样性和功能多样性的影响仍十分必要。
关键词:物种多样性; 功能多样性; 种间性状差异; 物种均匀度; 高寒草甸
物种多样性(SD)与功能多样性(FD)的关系(SD-FD关系)对研究生物多样性的生态系统功能效应至关重要[1- 2],SD-FD关系也是反映群落物种共存机制[3]和识别生物多样性影响生态系统功能机制的重要因素[4- 5]。
功能多样性是指影响植物有机体功能的形态、生理或物候性状的组成与变化[6],它包含种间功能性状差异(functional trait dissimilarity among species)、物种组成及其相对多度等成分[4, 7],种间性状差异和物种均匀度是构成功能多样性的两个基本成分。显然,功能多样性与物种多样性具有内在联系。目前的研究表明SD-FD关系可能表现为正相关[8- 9, 1]、负相关[2]、无相关[10- 11]或S形曲线[9],认识并不一致。
很多研究认为SD-FD关系取决于物种功能冗余的程度[9, 12]。如果群落中每个物种的功能属性具有相对唯一性,则SD-FD为正线性相关,功能冗余很低,种间的性状分化可以通过资源利用性竞争的物种共存理论来解释[2],一个物种占据一个生态位,物种丧失将引起功能性状丢失或性状空间维度减小[12- 13]。如果物种的功能属性具有相似性,性状功能在种间有重叠,且重叠度随物种多样性增加而增大,功能多样性将最终趋近于一个临界值,SD-FD为减速递增关系,表明存在一定的功能冗余。例如,在具有强烈扰动或环境胁迫的群落中,物种的功能属性表现出趋同性,物种性状组成将被限制在适应该扰动或环境选择压力的范围内[4, 9],因而物种丰富度继续增加只会引起生态位空间的进一步分化,导致种间性状差异减小,功能多样性不再增加,功能冗余增大,生态系统功能相对于物种多样性的变化则是稳健的[14],也就不能通过物种多样性解释调控生态系统过程的种间功能差异[2]。Sasaki等[9]在蒙古放牧草原的研究还观察到2个阶段的功能冗余关系,即S形SD-FD关系。这种关系说明在物种多样性达到一定水平时,功能多样性是相对稳定的,即出现冗余,而低于该水平,功能性状会骤然丢失,群落将转变成仅由少量抗牧性状的功能群所组成,功能冗余也较高[9]。
上述研究仅表明种间性状的差异性对SD-FD关系具有重要影响。但常用的计测群落物种功能多样性的Rao系数[7]是以群落内所有成对物种的种间性状差异与物种相对多度的乘积和来度量,即功能多样性的大小实际上受种间性状差异及物种均匀度的共同影响,这与物种多样性由物种丰富度和物种均匀度共同决定的情形相类似。de Bello等[2]分析认为,功能多样性对物种多样性的依赖程度与物种性状库的幅度及物种在可用生态位空间的分布有关[15],物种多样性的降低往往会释放出更加多样化的生态位空间,存留物种也会产生更广的适应性,从而增加物种性状的多样性[15- 16],即物种多样性低的群落种间性状差异将更大,但功能多样性是否必然增大还取决于物种均匀度的变化。对群落结构的研究显示,由于竞争释放(如草地维持放牧、刈割管理)或养分限制作用,物种多样性往往增加,种间性状差异减小,而均匀度则会提高[17]。在此情形下,功能多样性将如何变化取决于种间性状差异减小以及物种均匀度增加的相对程度,也就是说,SD-FD关系实际上取决于种间性状差异和物种均匀度变化对功能多样性的影响程度。根据Rao系数,对SD-FD关系做如下推测:(1)随着物种多样性增加,若种间性状差异和物种均匀度两者中任何一个成分的增加程度超过另一成分的减小程度,功能多样性增加,SD-FD正相关,反之,为负相关;(2)当一个成分的增加完全补偿了另一成分的减小时,功能多样性在一定范围内将不再随物种多样性而变化,SD-FD变成无相关性,存在功能冗余;(3)不论SD-FD具有何种关系,种间性状差异和物种均匀度中何者将对功能多样性产生更大影响取决于它们在特定环境条件下的变化速度,变化速度越快者,对功能多样性的影响越大。
本研究通过在高寒矮嵩草(Kobresiahumilis)草甸为期6a(2007—2012年)的刈割、施肥和浇水控制实验,研究了种间性状差异、物种均匀度、物种多样性和功能多样性在实验处理间的差异性,揭示SD-FD关系、种间性状差异和物种均匀度间的关系、以及种间性状差异和物种均匀度对SD-FD关系的影响,以检验上述推测。
1材料与方法
1.1研究区概况
本研究在青海省海北藏族自治州门源回族自治县境内的中国科学院海北高寒草甸生态系统定位站矮嵩草草甸内进行。该站位于青藏高原东北隅的祁连山谷(37°29′—37°45′ N, 101°12′—101°23′ E),海拔3200 m,年均温-1.6 ℃,最冷月(1月)平均气温-14.8 ℃,最热月(7月)平均气温9.8 ℃,年均降水量562 mm,其中80%集中于5月到9月。研究区地势平缓,为当地冬春牧场,每年11月至次年5月底放牧。该草甸牧草生长低矮,群落结构简单,初级生产力低。群落主要由嵩草类、薹草类、禾草类以及双子叶杂类草等植物种组成。该生态系统长期受家畜放牧的强烈影响,加之地处高寒,虽然土壤有机质丰富,但其分解缓慢、矿化率低,可利用养分缺乏,不能满足植物生长的需要[18]。过度放牧和土壤养分缺乏是影响该草地生态系统生产力的两个重要外部因子。
1.2研究方法1.2.1实验设计
针对研究地区普遍存在过度放牧和土壤养分缺乏的状况,于2007年4月底建立实验样地,面积为0.6 hm2(100 m×60 m)。该样地为3个刈割水平、2个施肥水平,2个水分添加水平、3个区组,每个区组3个4 m×4 m大样方的3因子裂区嵌套试验设计。主区为刈割处理,刈割留茬高度分别为1、3 cm和不刈割,刈割量占当年地上总生物量的60%—70%、45%—50%和0,刈割处理收获的生物量略高于该草地类型家畜放牧强度实验中重度和中度放牧条件下的牧草利用率(60%和45%)[19- 20]。副区为施肥和浇水处理,嵌套于主区中,即用4块长2 m、宽0.25 m铁皮十字形纵切嵌入草地0.25 m深,将每个主区大样方隔成4个2 m×2 m的副区样方,设置4个副区处理(图1),即①NFNW:不施肥,不浇水;②F:仅施肥;③W:仅浇水;④FW:既施肥又浇水。刈割、施肥处理在副区样方中央1.5 m×1.5 m范围内进行。每个副区样方内再设4个0.5 m×0.5 m小样方,其中1个为长期观察物种组成变化的永久样方,剩余3个用于植物性状测定。
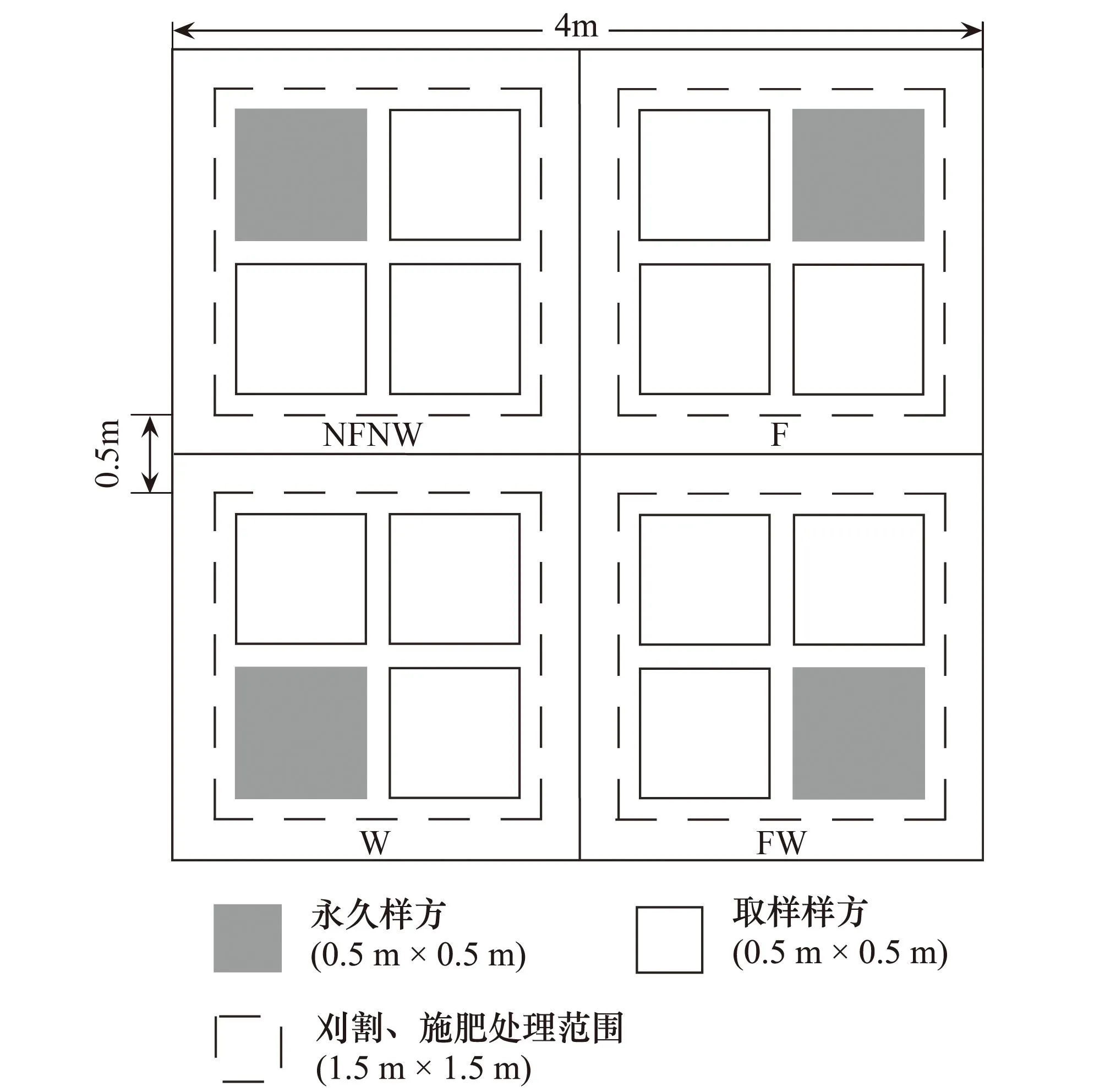
图1 副区处理样方设置图Fig.1 Quadrats design layout of subplot NFNW: 不施肥不浇水; F: 仅施肥; W: 仅浇水; FW: 既施肥又浇水
每年生长季开始至植物高度达到10 cm左右时(6月中旬)实施刈割处理,并将中度和重度永久样方中的刈割部分置于烘箱中60 ℃下烘干72 h,并称重(记为W1)。施肥每年3次,分别于5—7月中旬进行,每次撒施尿素2.5 g/m2(含N 20.4%),磷酸二胺0.6 g/m2(含N 5.9%, P 28.0%),每年N、P的添加总量分别为1.64和0.50 g/m2。施肥后用喷壶浇水4.5 kg/m2,浇水总量为年平均降水量的2.4%。对2007年和2008年的数据分析显示浇水的作用不显著,故2008年后每次浇水量增至6.7 kg/m2,为年降水量的3.6%。但从2011年的分析结果看,浇水的作用仍不显著。故本文在数据分析中仅考虑了刈割与施肥处理效应。
1.2.2数据采集
每年8月初进行群落调查,计测永久样方的物种数、每物种的株高(随机测20株)和盖度。根据2011年的测定结果及各物种重要值的累计值,从群落调查记录的74个物种中选择了33个共有物种进行性状测定。由于这些物种的重要值累计达重要值总和的80%以上,能够反映重要的生态过程[21]。
2012年8月初,在每个副区处理的3个植物性状测定样方中随机选取5株被测物种的健康植株,计测株高和总叶片数;用手持式激光叶面积仪(CI-203, CID公司中国分公司, 北京)测定总叶面积,计算单株平均叶面积。将其齐地面剪下,60 ℃烘72 h,称取茎、叶干重,计算平均单株地上重、平均单株叶面积和比叶面积;性状测定结束后,将永久样方内的植物齐地面刈割,60 ℃烘72 h,称重(记为W2)。以W1和W2之和作为群落当年地上净初级生产力(ANPP)的估计。
上述测定得到以下4个定量性状,即单株地上质量、单株叶面积、比叶面积和株高。在野外观察与查阅文献的基础上,还确定了9个定性性状,包括生长型、繁殖方式、生活周期、固氮性、植株倾斜度、经济类群、叶表面特征、叶缘和叶形。上述13个植物功能性状与植物种在放牧扰动和土壤资源梯度上所表现的耐牧或避牧能力、资源利用与竞争能力、种群更新与扩散能力等响应对策密切相关[22- 25, 2]。计算种间性状差异值的功能性状及其分类状态见表1。依据文献报道[26- 27, 9],对每个物种定性性状的状态变化进行分类,并进行标准化赋值,使赋值之和等于1。其中,对于具有单一定性性状的物种,以0、1进行赋值。如垂穗披碱草(Elymusnutans)属于禾草,在经济类群的禾草这一列中赋1,在其他列中赋0。对于具有多重性状的物种,则使用模糊编码进行赋值。例如,棉毛茛(Ranunculusmembranaceus)叶片线状披针形或线形,就在叶形的线形这一列赋0.5,在披针形这一列赋0.5,其他列则赋0。对于定量性状,则根据实测值进行标准化使其数据统一映射到[0,1]区间上用于运算。
1.3数据计算与统计分析1.3.1功能多样性FD
功能多样性FD采用Rao指数[7]和基于多性状的功能分散指数FDis[28]计算:
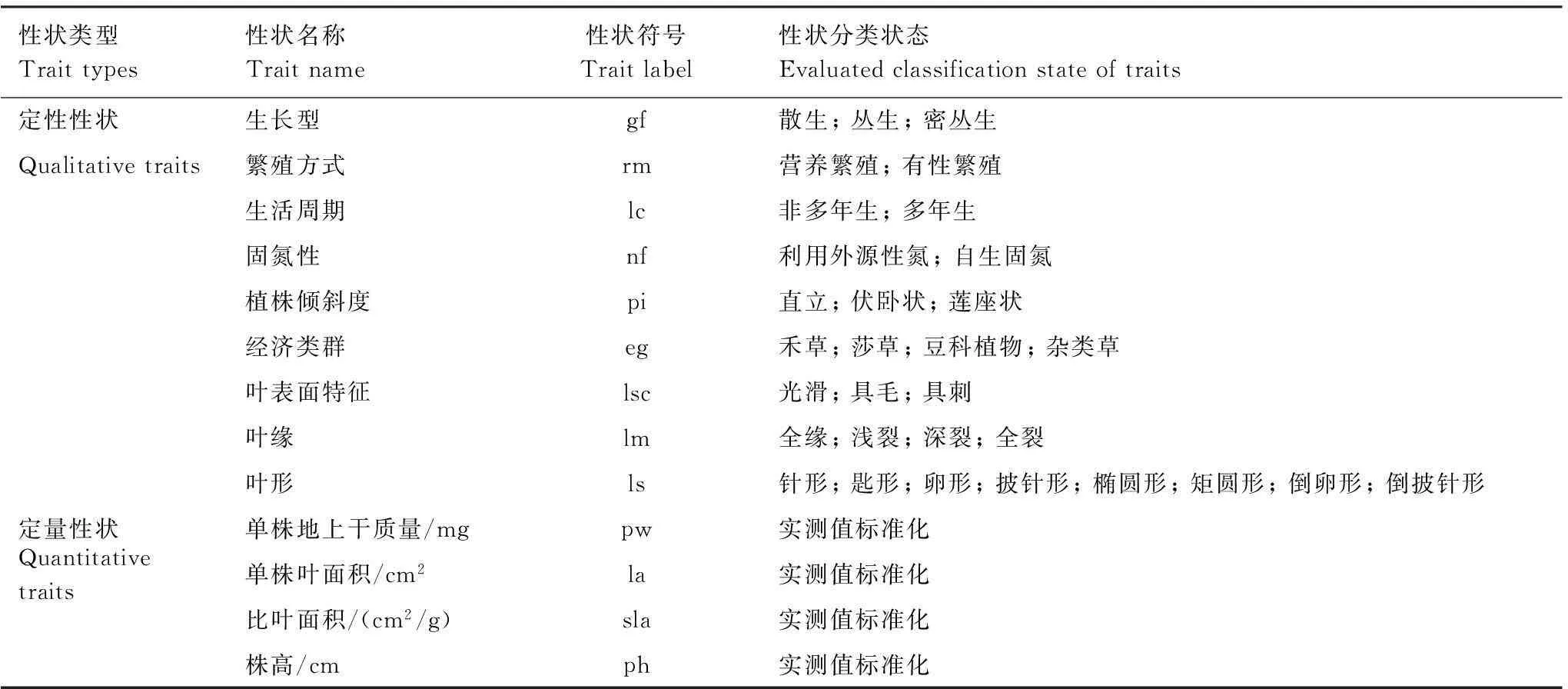
表1 计算种间性状差异值的功能性状及其分类状态
(1)
(2)
式中,S为永久样方内的物种数;Pi、Pj分别为第i、j个物种的相对密度;dij为欧氏距离,表示物种i、j间性状的相异性,即种间差异;Zi为物种i到用相对密度Pi加权的质心c的距离。
(3)
(4)
式中,n为性状数量;xki、xkj是物种i、j的第k个性状值;ck为用相对密度Pi加权的第k个性状的质心。dij变化于0(物种具有完全相同的特征)与1(两物种具备完全不同的特征)之间。本文分别计算了单一性状的种间差异(分别以dgf、drm、dlc、dnf、dpi、deg、dlsc、dlm、dls、dpw、dla、dsla、dph表示, 下标符号含义同表1)和13个性状的多性状种间差异(以dij表示)。
1.3.2物种多样性SD
物种多样性SD以Shannon-Wiener指数H′表征[29]:
(5)
式中,S为永久样方内的物种数;Pi为样方中第i个物种的相对密度。
1.3.3物种均匀度
物种均匀度采用Pielou均匀度指数J计算[29]:
(6)
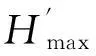
1.3.4数据分析
采用SPSS 21.0-GLM中Univariate-ANOVA进行裂区嵌套设计的方差分析,确定种间性状差异、物种均匀度、物种多样性和功能多样性在实验处理间的差异性,处理间平均值的多重比较采用Duncan氏检验法。统计分析前对数据进行正态性和方差齐性检验,并对生物量数据进行对数转换。统计检验的显著水平设为P< 0.05,文中微弱作用指P< 0.1。
采用CANOCO 4.5软件进行冗余分析(RDA),以确定种间性状差异(多性状、单一性状)和物种均匀度对SD-FD关系的影响(采用去趋势典范对应分析进行的预分析表明, 排序轴长度小于3, 故采用RDA)。进行2次RDA分析,分别以多性状种间差异值与物种均匀度值,以及单个性状种间差异值与物种均匀度值为解释变量,以H′和FD值为响应变量,进行前向选择和Monte Carlo检验,确定具有显著效应的解释变量,并进行RDA排序,确定解释变量对响应变量的影响。
采用曲线拟合回归方法分析SD-FD关系以及种间性状差异和物种均匀度间的关系,以F检验显著(P< 0.05)且决定系数R2值最大的模型作为回归关系形式的最优模型。采用多元线性回归方法分析物种多样性和功能多样性对地上初级生产力的贡献大小。
2结果
2.1种间性状差异值
多性状的种间差异(dij)在不刈割和中度刈割处理间无差异,但均显著高于重度刈割(F(2,8)=25.781,P<0.001)(图2),说明刈割达到高强度时会在总体上降低种间性状的平均差异,引起物种性状的趋同响应。但不同性状的种间差异对刈割的响应模式各异。例如,生长型(dgf)、比叶面积(dsla)的种间差异在中度和重度刈割之间无差异,且显著低于不刈割(dgf∶F(2, 8)=12.434,P=0.004;dsla∶F(2, 8)=7.397,P=0.015)(仅以dgf在刈割处理间的变化图示结果, 图2);叶形(dls)的种间差异在中度刈割最大(dls∶F(2, 8)=6.823,P=0.019)(图2);单株地上干质量(dpw)、单株叶面积(dla)和株高(dph)的种间差异随刈割增强而显著降低(dpw∶F(2, 8)=66.265,P< 0.001;dla∶F(2, 8)=109.464,P< 0.001;dph∶F(2, 8)=277.436,P< 0.001)(仅以dph在刈割处理间的变化图示结果, 图2);繁殖方式(drm)、生活周期(dlc)、植株倾斜度(dpi)、经济类群(deg)和叶缘(dlm)的种间差异不随刈割强度而变化(P> 0.05)。
施肥引起多性状的种间平均差异(dij)微弱增加(F(1, 2)=13.248,P=0.068),但不同性状在种间的差异对施肥的响应模式不尽相同。例如,施肥后单株地上干质量(dpw)、单株叶面积(dla)、比叶面积(dsla)和株高(dph)的种间差异显著增大(dpw∶F(1, 2)=99.324,P=0.010;dla∶F(1, 2)=84.130,P=0.012;dsla∶F(1, 2)=36.486,P=0.026;dph∶F(1, 2)=396.344,P=0.003)(仅以dph在施肥处理间的变化图示结果, 图2);叶形(dls)、经济类群(deg)的种间差异显著减小(dls∶F(1, 2)=58.386,P=0.017;deg∶F(1, 2)=43.238,P=0.022)(仅以dls在施肥处理间的变化图示结果, 图2);其它性状的种间差异未受施肥处理的影响(P> 0.05)。
施肥与刈割的交互作用仅引起植物固氮性(dnf)和叶表面特征(dlsc)的种间差异发生变化(dnf∶F(2, 8)=5.489,P=0.032;dlsc∶F(2, 8)=7.375,P=0.015)。不施肥时,dnf和dlsc在刈割处理间无显著差异;施肥后,dnf仍不随刈割强度而变化,但在不刈割处理中显著小于不施肥,而施肥后dlsc则随刈割强度增加而减小,并在重度刈割显著小于不施肥(图2)。
2.2物种均匀度、物种多样性以及功能多样性
刈割显著提高了物种均匀度,均匀度指数J在中度与重度刈割处理间无差异,且均显著高于不刈割(J∶F(2, 8)=11.919,P=0.004)(图3),但施肥后J微弱降低(J∶F(1, 2)=14.177,P=0.064)。说明刈割群落的物种分布更趋均匀,而施肥具有与此相反的作用,引起物种分布的不均匀变化。
刈割和施肥对物种多样性具有相反的影响,Shannon-Wiener指数H′在中度与重度刈割处理间无差异,且均显著高于不刈割(H′∶F(2, 8)=24.118,P< 0.001)(图3),而施肥后H′显著降低(H′∶F(1, 2)=24.780,P=0.038)(图3)。这种效应也同样出现在功能多样性的变化上,功能多样性指数FDRao和FDis在两个刈割处理间无差异,但均高于不刈割(FDRao∶F(2, 8)=13.790,P=0.003;FDis∶F(2, 8)=11.178,P=0.005)(图3),而施肥后显著降低(FDRao∶F(1, 2)=19.803,P=0.047;FDis∶F(1, 2)=26.758,P=0.035)(图3)。
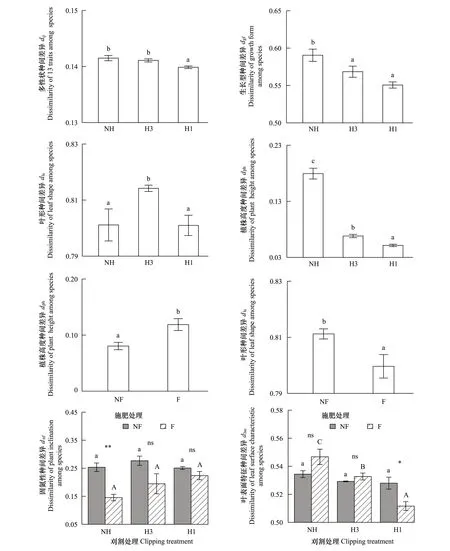
图2 刈割和施肥对种间性状差异值的影响Fig.2 Effects of clipping and fertilizing on the trait dissimilarity among speciesNH: 不刈割; H1: 重度刈割; H3: 中度刈割; F: 施肥; NF: 不施肥; 相同字母分别表示处理间无显著差异(P > 0.05), 不同字母表示处理间差异显著(P < 0.05);ns、* 和 ** 分别表示交互作用的显著P > 0.05, 0.01 < P < 0.05, P < 0.01; 数据表示的是平均值±标准误(n=18)
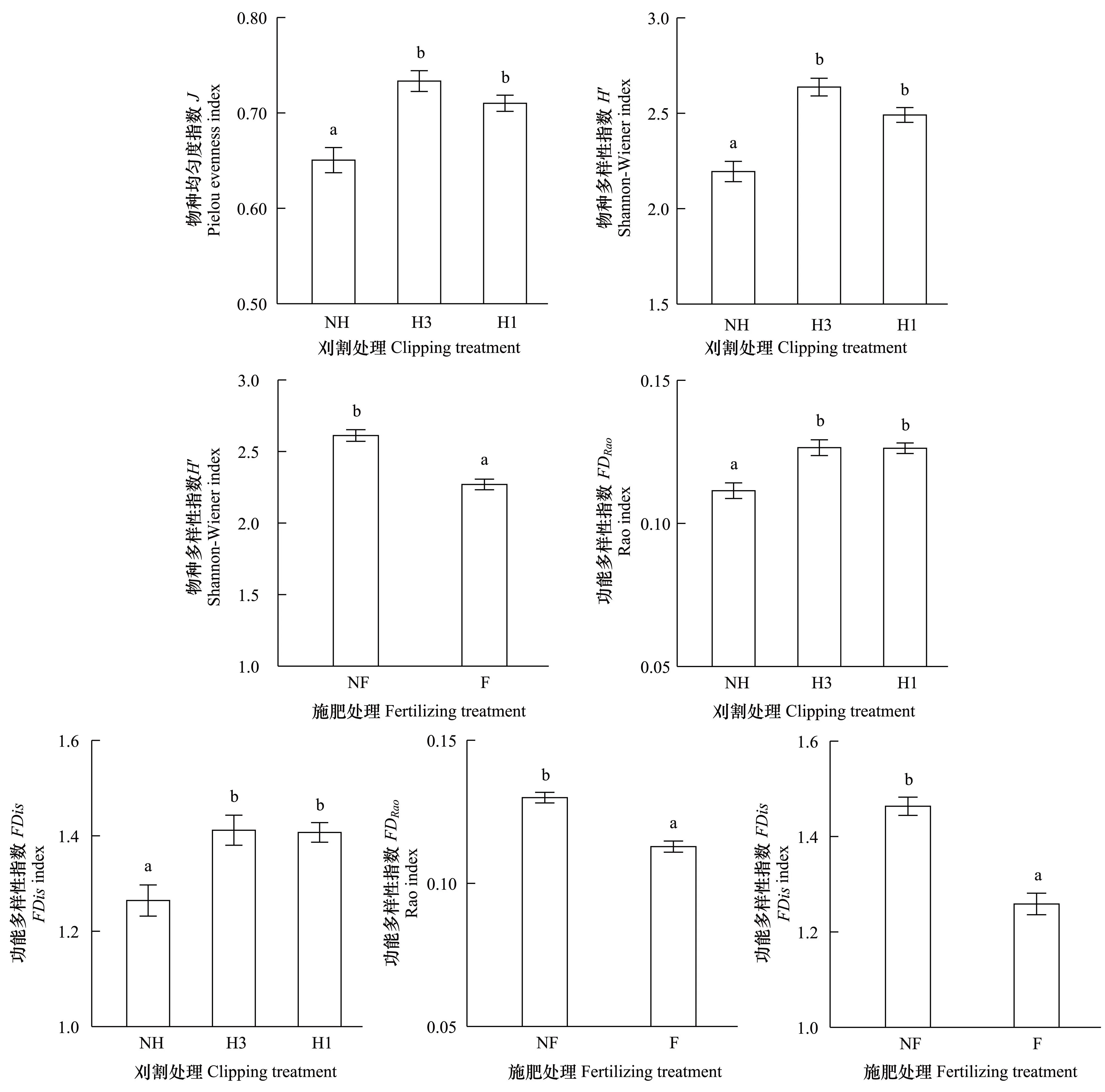
图3 刈割和施肥对物种均匀度、物种多样性和功能多样性的影响Fig.3 Effects of clipping and fertilizing on the species evenness, species diversity and functional diversity
2.3种间性状差异和物种均匀度对SD-FD关系的影响
以多性状种间差异值(dij)进行的RDA显示,以FDRao和SD(H′)为响应变量时,dij和J对FDRao和H′均有显著影响(dij∶F=5.630,P=0.016;J∶F=528.529,P=0.002),并分别解释了FDRao和SD(H′)变化的5.0%和83.3%;以J为协变量时,Monte Carlo检验结果显示dij单独起作用的效应是微弱的(dij∶F=6.348,P=0.07),对FDRao和SD(H′)变化的解释能力降低(0.4%)。以FDis和SD(H′)为响应变量时,dij和J对FDis和SD(H′)均有显著影响(dij∶F=6.414,P=0.01;J∶F=405.969,P=0.002),并分别解释了FDis和SD(H′)变化的5.7%和79.3%;以J为协变量时,dij单独起作用的效应是显著的(dij∶F=3.544,P=0.036),对FDis和SD(H′)变化的解释能力降低(0.7%)。RDA排序结果显示,第一排序轴和第二排序轴共解释了FDRao和SD(H′)、FDis和SD(H′)变化的83.7%、80%,FDRao和SD(H′)、FDis和SD(H′)之间正相关,它们与J之间正相关,与dij之间负相关(图4)。
以单个性状种间差异值进行的RDA显示,分别以FDRao和SD(H′)、FDis和SD(H′)为响应变量时,J的解释能力仍然最高((83.3%, 79.3%),以J为协变量,得到的其它有效解释变量均分别为性状gf、nf、pi、pw、la、sla和ph的种间差异性(P< 0.05)。由于其它性状的种间差异性与这些性状存在共线性而被剔除。RDA排序结果显示,第一排序轴和第二排序轴共解释了FDRao和SD(H′)、FDis和SD(H′)变化的86.3%、82.2%,FDRao和SD(H′)、FDis和SD(H′)之间仍然正相关,它们与J之间也仍为正相关,它们与性状nf、pi的种间差异性正相关,而与性状gf、pw、la、sla、ph的种间差异性负相关(图4)。
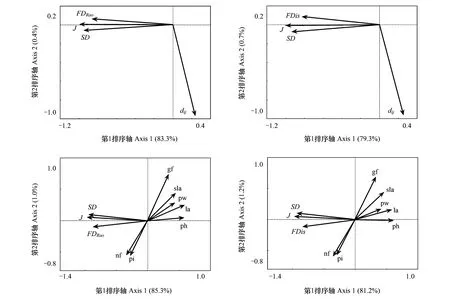
图4 种间性状差异和物种均匀度对物种多样性与功能多样性关系的影响Fig.4 Effects of trait dissimilarity among species and species evenness on the relationship between species and functional diversitySD: 物种多样性 (Shannon-Wiener指数); FDRao, 功能多样性Rao指数; J, 物种均匀度Pielou指数; dij, 多性状种间差异; FDis, 功能多样性功能分散指数;gf、nf、pi、eg、la、sla、ph分别表示各性状的种间差异值, 性状名同表1
以上结果说明,物种均匀度对功能多样性的影响大于种间性状差异的影响,SD-FD之间为正相关,这主要是由于物种均匀度增加对FD的正效应大于种间差异减小对FD的负效应所致,这与本文的第一点推测吻合。就总体而言,物种多样性和功能多样性高的群落种间性状差异越小(图4),但不同性状的种间差异随多样性增加的表现不一致,其中固氮性(nf)和植株倾斜度(pi)2个性状表现出趋异响应,而生长型(gf)、单株地上质量(pw)、单株叶面积(la)、比叶面积(sla)和株高(ph)5个性状则表现出趋同响应(图4)。此外,繁殖方式(rm)、经济类群(eg)、生活周期(lc)、叶表面特征(lsc)、叶缘(lm)和叶形(ls)既无趋同也无趋异变化。
2.4SD-FD关系以及多性状种间差异(dij)与物种均匀度间的关系
回归分析显示,SD-FD关系符合二次函数y=-0.044+0.096x-0.011x2(y为FDRao)或y=-0.537+1.129x-0.141x2(y为FDis),FD(y)随SD(x)减速递增(图5)。对上述函数求一阶导数可知,当H′分别为4.28和3.99时,FDRao和FDis将不再继续增加,产生功能冗余,即此时物种丰富度和物种均匀度增加对FD的正效应将完全补偿种间差异减小对FD的负效应。根据图5显示的H′值实测范围,本研究中物种多样性并未达到产生功能冗余的临界H′值,即物种丰富度和物种均匀度的增加将进一步提高群落物种的功能多样性。
多性状种间差异(dij)与物种均匀度J关系符合逆函数y=0.136+0.003/x,dij(y)随J(x)的增加而减速递减(图5)。这主要是由于种间性状差异(dij)与物种均匀度J在刈割和施肥处理复合梯度上具有相反的变化趋势(图2, 图3)所致。该函数关系说明种间性状差异的变化慢于物种均匀度的变化,物种均匀度是导致功能多样性变化的主要因素,也是导致SD-FD正相关的原因。此结果与RDA(图4)一致。
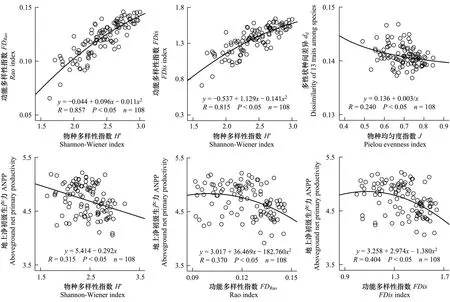
图5 物种多样性、功能多样性和地上净初级生产力(对数尺度)的关系以及种间性状差异与物种均匀度的关系Fig.5 Relationships between species diversity, functional diversity and aboveground net primary productivity (logarithmic scale) and relationship between species evenness and trait dissimilarity of 13 traits among species
2.5物种多样性、功能多样性与地上净初级生产力的关系
在刈割和施肥处理复合梯度上,物种多样性与地上净初级生产力关系符合线性函数y=5.414-0.292x,ANPP(y)随SD(x)线性递减(图5),决定系数R2=0.099;功能多样性与地上净初级生产力关系符合二次函数y=3.017+36.469x-182.760x2(x为FDRao)或y=3.258+2.974x-1.380x2(x为FDis),ANPP(y)也随FD(x)递减(图5),决定系数R2分别为0.137和0.163。决定系数的大小说明功能多样性对群落地上净初级生产力的影响大于物种多样性。由于ANPP与FD之间为非线性关系,对它们的函数关系进行变换得到y=4.836-182.760(x-0.0998)2(x为FDRao)或y=4.860-1.380(x-1.0772)2(x为FDis),以(FDRao-0.0998)2或(FDis-1.0772)2为自变量时,它们之间是线性的,故以ANPP(y)为因变量,以H′(x1)和(FDRao-0.0998)2(x2)或H′(x1)和(FDis-1.0772)2(x2)为自变量进行二元线性回归,得到以下关系:y=4.981-0.068x1-155.072x2(R2=0.139,n=108,P< 0.05,x2为(FDRao-0.0998)2)或y=4.908-0.023x1-1.317x2(R2=0.163,n=108,P< 0.05,x2为(FDis-1.0772)2)。但检验结果显示H′(x1)的偏回归系数均不显著(P值分别为0.609和0.857),表明同时考虑物种多样性和功能多样性对地上净初级生产力的贡献时,可排除物种多样性的影响。
3讨论和结论3.1不同处理对种间性状差异值的影响
本研究显示尽管不同性状在种间的差异性对刈割或施肥处理具有多种响应模式,但刈割处理还是引起种间性状的平均差异减小,性状在总体上表现出趋同响应的模式(图2),而施肥则在一定程度上引起种间性状的平均差异增大,性状在总体上表现出趋异响应的模式。刈割引起生长型、比叶面积、单株地上干质量、单株叶面积和株高的种间趋同(图2, 图2),这与臧岳铭等[10]在该地区自然放牧条件下的研究结果相似。这种现象可以解释为刈割或放牧引起的竞争释放效应,即刈割削弱了禾本科等高大植物的竞争抑制作用,群落逐渐向以低矮植物为优势种的方向转变[30],符合长期放牧导致草地群落矮化以提高自身耐牧性的现象[4],是物种对放牧长期响应的结果。叶形的种间差异在中度刈割最大(图2),说明中等程度的刈割扰动有利于维持叶形性状的高多样性,可能与植物叶片对光资源的最大化利用有关[2, 31]。
施肥使比叶面积、单株地上干质量、单株叶面积和株高在种间趋异(图2),这与藏岳铭等[10]的研究结果一致,也与通常所认为的种间竞争导致性状趋异的观点相符[32]。这是因为施肥能促进植物生长,提高群落地上生物量,增加种间竞争,从而导致性状的种间差异增大,产生性状趋异[32]。施肥也同时引起有些性状发生趋同,如施肥群落植物的叶形和经济类群更加相似(图2),可能是因为施肥解除了土壤养分的限制作用,具有线形和披针形叶形的禾草类植物生长迅速,其竞争优势作用得到加强,并引起物种均匀度和物种多样性下降(图3)。而物种多样性下降或物种丧失将引起有些功能性状丢失或性状空间维度减小[12- 13],导致功能多样性降低(图3)。因此,施肥后剧烈的种间竞争作用一方面引起有些性状发生趋异,另一方面又将引起有些性状发生趋同。
植物本身就是沿着趋异和趋同两种途径逐渐演化的,环境筛引起物种性状趋同[33],竞争导致性状分离而产生性状趋异[32]。但并不是所有性状均是如此,如刈割和施肥对繁殖方式、生活周期、植株倾斜度和叶缘的种间差异均无影响,从而验证了Weiher等[34]及Pakeman和Lennon[35]的观点,即群落物种的一些特定性状既不表现出趋同也不表现出趋异的格局,这些性状对群落的构建过程可能并不重要。笔者认为,群落的构建过程或模式是群落物种及其功能性状对种间竞争、扰动和土壤资源等因子的作用发生综合响应的结果,表现为有些性状趋同和/或趋异响应,而有些性状无响应的嵌套格局,区分作用因子影响的相对强弱以及性状的主要构建模式,对于揭示群落构建机制意义重大。
3.2种间性状差异(dij)和物种均匀度对物种多样性和功能多样性关系的影响
刈割扰动和养分富集对物种均匀度、物种多样性和功能多样性具有完全相反的影响,前者表现为增加效应(图3),后者则为降低效应(图3)。刈割或放牧的增加效应与李晓刚等[8]、王海东等[36]的结果相似。由于物种多样性由物种丰富度和物种分布的均匀度共同决定,而刈割或放牧引起的竞争释放使大量伴生种和稀有种得以生存,物种丰富度增加,同时高大禾本科植物竞争优势作用的减弱又引起物种均匀度增加[17],因而物种多样性必然增加。施肥的降低效应在李晓刚等[8]、王海东等[36]及Tilman[37]的研究中也得到证实。该效应主要是因为施肥后高大禾本科植物的光竞争优势对其它植物的抑制作用导致物种丰富度和物种均匀度降低所致[38]。
由计测功能多样性的Rao指数[7]可知,功能多样性与种间性状差异及物种均匀度正相关。本研究显示,在刈割或施肥梯度上,功能多样性与种间性状差异的变化趋势并不相同,但与物种均匀度的变化趋势一致(图4)。这是因为物种均匀度与功能多样性正相关,且对功能多样性的影响大于种间性状差异的影响(图4),而且物种均匀度的变化速度快于种间性状差异的变化速度(图5)。尽管植物种间固氮性、植株倾斜度差异性的增加能提高功能多样性,但其作用仍小于物种均匀度的作用(图4)。因此,SD-FD之间的正相关性主要是由于物种均匀度增加对FD的正效应大于种间差异减小对FD的负效应所致。此结果与本文的第一点推测吻合。
本研究中的SD-FD关系符合二次函数(图5),表明群落存在一定的功能冗余,且功能冗余随物种多样性的增大而增大,但尚未达到产生SD-FD无相关性的极限H′值。尽管多性状种间差异以及生长型、单株地上干质量、单株叶面积、比叶面积和株高的种间差异与功能多样性负相关(图4),但尚不足以抵消物种均匀度增加引起的功能多样性增加程度,物种丰富度和物种均匀度的增加将进一步提高群落物种的功能多样性。这与de Bello等[2]、李晓刚等[8]的研究结果相似。但本研究结果也表明功能多样性将在物种多样性H′ =4.28或3.99时不再增加,此时因生态位的分化引起的种间差异进一步减小才能平衡物种均匀度对功能多样性的增加效应。有研究认为H′值一般在1.5至3.5之间,很少超过4.5[39],而Sasaki等[9]则是在很宽的环境梯度上才观察到S形SD-FD关系。我们期望随着本研究实验处理年限的进一步延长,处理间物种多样性和功能多样性的差异进一步增大,能够观察到具有明显减速递增的SD-FD关系,进而准确验证本文提出的第二点推测。
物种均匀度与多性状种间差异间的负相关关系(图4)与很多研究结果[40- 41, 17]相一致。曲线拟合回归显示物种均匀度与多性状种间差异表现为减速递减的关系(图5),这进一步说明当种间性状差异减小时,由于物种均匀度增加较快,功能多样性实际上是增加的,也就是说,物种均匀度是导致功能多样性变化的主要因素,也是决定SD-FD关系的主要因素。这也从一个侧面说明高寒草甸的过度放牧引起的群落结构变化,即群落逐渐向以低矮植物为优势种的方向转变[30],以劣质杂类草逐渐取代优质禾草和莎草为退化特征,尽管在此阶段物种多样性和功能多样性都在增加,但草地质量和饲用价值已大大下降。
3.3物种多样性和功能多样性对地上净初级生产力的影响
物种多样性和功能多样性与地上净初级生产力之间均为负相关关系(图5),这与前期研究结果(李晓刚等[8];王海东等[36])相似。在本研究中,尽管物种多样性H′是以样方中的全部物种计算,而功能多样性是以33个共有物种计算的,但结果显示功能多样性对地上净初级生产力的影响大于物种多样性的影响,而且在同时考虑物种多样性和功能多样性对地上净初级生产力的贡献时,可排除物种多样性的影响。这进一步证实生态系统的生产力功能主要受物种属性而不是物种丰富度影响的结论[42- 43]。
综上所述,刈割和施肥处理分别导致植物性状总体上发生趋同和趋异响应,并且对物种均匀度、物种多样性和功能多样性具有完全相反的影响,即刈割后竞争释放的增加效应以及施肥后竞争排斥的降低效应。由于物种均匀度与功能多样性正相关,且对功能多样性的影响大于种间性状差异的影响,而且物种均匀度的变化速度快于种间性状差异的变化速度,因此,高寒草甸放牧生态系统物种多样性和功能多样性间的关系主要受物种均匀度变化的影响。作为生物多样性的组成成分,物种多样性与功能多样性之间存在互补性,物种多样性下降或物种丧失引起的功能性状丢失或性状空间维度减小将导致功能多样性降低,而功能多样性对生态系统生产力的影响又大于物种多样性的影响。因此,在研究生物多样性与生态系统功能关系时,同时考虑物种多样性和功能多样性的影响仍十分必要。
致谢:中国科学院海北高寒草甸生态系统定位站对野外试验给予支持,吕美强和李艳帮助野外数据采集,李晓刚和张璐璐给予帮助,特此致谢。
参考文献(References):
[1]Petchey O L, Gaston K J. Functional diversity (FD), species richness and community composition. Ecology Letters, 2002, 5(3): 402- 411.
[2]De Bello F, Lepš J, Sebastià M T. Variations in species and functional plant diversity along climatic and grazing gradients. Ecography, 2006, 29(6): 801- 810.
[3]张全国, 张大勇. 生物多样性与生态系统功能: 最新的进展与动向. 生物多样性, 2003, 11(5): 351- 363.
[4]Díaz S, Cabido M. Vive la difference: Plant functional diversity matters to ecosystem processes. Trends in Ecology and Evolution, 2001, 16(11): 646- 655.
[5]Mason N W H, Mouillot D, Lee W G, Wilson J B. Functional richness, functional evenness and functional divergence: the primary components of functional diversity. OIKOS, 2005, 111(1): 112- 118.
[6]Hillebrand H, Matthiessen B. Biodiversity in a complex world: consolidation and progress in functional biodiversity research. Ecology Letters, 2009, 12(12): 1405- 1419.
[7]Lepš J, de Bello F, Lavorel S, Berman S. Quantifying and interpreting functional diversity of natural communities: practical considerations matter. Preslia, 2006, 78(4): 481- 501.
[8]李晓刚, 朱志红, 周晓松, 袁芙蓉, 樊瑞俭, 许曼丽. 刈割、施肥和浇水对高寒草甸物种多样性、功能多样性与初级生产力关系的影响. 植物生态学报, 2011, 35(11): 1136- 1147.
[9]Sasaki T, Okubo S, Okayasu T, Jamsran U, Ohkuro T, Takeuchi K. Two-phase functional redundancy in plant communities along a grazing gradient in Mongolian rangelands. Ecology, 2009, 90(9): 2598- 2608.
[10]臧岳铭, 朱志红, 李英年, 王文娟, 席博. 高寒矮嵩草草甸物种多样性与功能多样性对初级生产力的影响. 生态学杂志, 2009, 28(6): 999- 1005.
[11]Reich P B, Tilman D, Naeem S, Ellsworth D S, Knops J, Craine J, Wedin D, Trost J. Species and functional group diversity independently influence biomass accumulation and its response to CO2and N. Proceedings of the National Academy of the Sciences of the United States of America, 2004, 101(27): 10101- 10106.
[12]Micheli F, Halpern B S. Low functional redundancy in coastal marine assemblages. Ecology Letters, 2005, 8(4): 391-400.
[13]Petchey O L, Evans K L, Fishburn I S, Gaston K J. Low functional diversity and no redundancy in British avian assemblages. Journal of Animal Ecology, 2007, 76(5): 977- 985.
[14]Mayfield M M, Boni M F, Daily G C, Ackerly D. Species and functional diversity of native and human-dominated plant communities. Ecology, 2005, 86(9): 2365- 2372.
[15]Chesson P, Gebauer R L E, Schwinning S, Huntly N, Wiegand K, Ernest M S K, Sher A, Novoplansky A, Weltzin J F. Resource pulses, species interactions, and diversity maintenance in arid and semi-arid environments. Oecologia, 2004, 141(2): 236- 253.
[16]Stubbs W J, Bastow Wilson J. Evidence for limiting similarity in a sand dune community. Journal of Ecology, 2004, 92(4): 557- 567.
[17]Bakker E S, Olff H. Impact of different-sized herbivores on recruitment opportunities for subordinate herbs in grasslands. Journal of Vegetation Science, 2003, 14(4): 465- 474.
[18]赵新全. 高寒草甸生态系统与全球变化. 北京: 科学出版社, 2009: 78- 78.
[19]朱志红, 王刚, 赵松岭. 不同放牧强度下高寒草甸矮嵩草(Kobresiahumilis)无性系分株种群的地上生物量动态. 中国草地, 1994, (3): 10- 14.
[20]Zhu Z H, Wang X A, Li Y N, Wang G, Guo H. Predicting plant traits and functional types response to grazing in an alpine shrub meadow on the Qinghai-Tibet Plateau. Science China Earth Sciences, 2012, 55(5): 837- 851.
[21]Garnier E, Cortez J, Billès G, Navas M L, Roumet C, Debussche M, Laurent G, Blanchard A, Aubry D, Bellmann A, Neill C, Toussaint J P. Plant functional markers capture ecosystem properties during secondary succession. Ecology, 2004, 85(9): 2630- 2637.
[22]Walker B, Kinzig A, Langridge J. Original articles: plant attribute diversity, resilience, and ecosystem function: the nature and significance of dominant and minor species. Ecosystems, 1999, 2(2): 95- 113.
[23]Cornelissen J H C, Lavorel S, Garnier E, Diaz S, Buchmann N, Gurvich D E, Reich P B, Ter Steege H, Morgan H D, Van der Heijden M G A, Pansas J G, Poorter H. A handbook of protocols for standardised and easy measurement of plant functional traits worldwide. Australian Journal of Botany, 2003, 51(4): 335- 380.
[24]Pausas J G, Lavorel S. A hierarchical deductive approach for functional types in disturbed ecosystems. Journal of Vegetation Science, 2003, 14(3): 409- 416.
[25]Canadell J G, Pataki D E, Pitelka L F. Terrestrial Ecosystems in a Changing World. Berlin: Springer-Verlag, 2007.
[26]Pakeman R J. Consistency of plant species and trait responses to grazing along a productivity gradient: a multi-site analysis. Journal of Ecology, 2004, 92(5): 893- 905.
[27]De Bello F, Lepš J, Sebastià M T. Predictive value of plant traits to grazing along a climatic gradient in the Mediterranean. Journal of Applied Ecology, 2005, 42(5): 824- 833.
[28]Laliberté E, Legendre P. A distance-based framework for measuring functional diversity from multiple traits. Ecology, 2010, 91(1): 299- 305.
[29]马克平, 刘玉明. 生物群落多样性的测度方法: Ⅰ. α多样性的测度方法(下). 生物多样性, 1994, 2(4): 231- 239.
[30]周晓松, 朱志红, 李英年, 袁芙蓉, 樊瑞俭. 刈割、施肥和浇水处理下高寒矮嵩草草甸补偿机制. 兰州大学学报: 自然科学版, 2011, 47(3): 50- 57.
[31]Hooper D U. The role of complementarity and competition in ecosystem responses to variation in plant diversity. Ecology, 1998, 79(2): 704- 719.
[32]Pillar V D, Duarte L D S, Sosinski E E, Joner F. Discriminating trait-convergence and trait-divergence assembly patterns in ecological community gradients. Journal of Vegetation Science, 2009, 20(2): 334- 348.
[33]Grime J P. Trait convergence and trait divergence in herbaceous plant communities: mechanisms and consequences. Journal of Vegetation Science, 2006, 17(2): 255- 260.
[34]Weiher E, Clarke G D P, Keddy P A. Community assembly rules, morphological dispersion, and the coexistence of plant species. OIKOS, 1998, 81(2): 309- 322.
[35]Pakeman R J, Lennon J J, Brooker R W. Trait assembly in plant assemblages and its modulation by productivity and disturbance. Oecologia, 2011, 167(1): 209- 218.
[36]王海东, 张璐璐, 朱志红. 刈割、施肥对高寒草甸物种多样性与生态系统功能关系的影响及群落稳定性机制. 植物生态学报, 2013, 37(4): 279- 295.
[37]Tilman D. Secondary succession and the pattern of plant dominance along experimental nitrogen gradients. Ecological Monographs, 1987, 57(3): 189- 214.
[38]Tilman D. Resource Competition and Community Structure. Princeton: Princeton University Press, 1982.
[39]Magurran A E. Ecological Diversity and Its Measurement. Princeton: Princeton University Press, 1988.
[40]Collins S L, Knapp A K, Briggs J M, Blair J M, Steinauer E M. Modulation of diversity by grazing and mowing in native tallgrass prairie. Science, 1998, 280(5364): 745- 747.
[41]Sasaki T, Okubo S, Okayasu T, Jamsran U, Ohkuro T, Takeuchi K. Management applicability of the intermediate disturbance hypothesis across Mongolian rangeland ecosystems. Ecological Applications, 2009, 19(2): 423- 432.
[42]Lawton J H. What do species do in ecosystems? OIKOS, 1994, 71: 367- 374.
[43]Lawton J H, Brown V K. Redundancy in Ecosystems. Berlin Heidelberg: Springer, 1994.
Effects of interspecific trait dissimilarity and species evenness on the relationship between species diversity and functional diversity in an alpine meadow
CHEN Chao1, ZHU Zhihong1,*, LI Yingnian2, YAO Tianhua1, PAN Shiyu1, WEI Xinhua1, KONG Binbin1, DU Jiali1
1CollegeoflifeSciences,ShaanxiNormaluniversity,Xi′an710062,China2NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences,Xining810008,China
Abstract:Species diversity (SD) and functional diversity (FD) have previously been reported to be associated in a variety of ways, and identifying the relationship between these two parameters is important for our understanding the relationship between biodiversity and ecosystem functioning. Since ecosystem functioning is mainly influenced by plant functional attributes, it is widely held that functional diversity exerts a greater influence upon ecosystem functioning than does species diversity. However, it remains unclear which basic component of functional diversity (i.e., species evenness or trait dissimilarity among species) contributes more to functional diversity and thus determines or alters the SD-FD relationship. In this study, a field manipulation experiment was conducted in an alpine Kobresia humilis meadow at the Haibei Research Station of the Chinese Academy of Sciences from 2007 to 2012. The experiment employed a split-plot design, in which vegetation was clipped to one of two lengths (above ground stubble =1 cm or 3 cm) or left unclipped. Subplots were treated with fertilizer (urea 7.5 g m-2a-1+ ammonium phosphate 1.8 g m-2a-1) or remained unfertilized. Data analysis methods, e.g. general linear model univariate ANOVA, multivariate analysis, binary linear regression and curve fitting, were employed to analyze the effects of these treatments on trait dissimilarity among species (dspan, 13 traits of 33 species), community species evenness (Pielou evenness index, J) and community species diversity (Shannon-Wiener index, H′), and functional diversity (Rao index, FDRao; Functional dispersion, FDis) (13 traits of 33 species), as well as potential relationships among these measures. 1) SD (H′) was significantly positively correlated with FD (FDRao, FDis), and J was positively correlated with SD (H′) and FD (FDRao, FDis), whereas dspan(dissimilarity of 13 traits among 33 species) was negatively correlated with SD (H′) and FD (FDRao, FDis). J was more strongly correlated with SD (H′) than dspan, and was also correlated with FD (FDRao, FDis). Thus, it can be concluded that species evenness is a major driving factor of both variation in FD and the positive correlation between SD and FD. 2) Curve fitting revealed that the increase in FD (FDRao, FDis) leveled off as SD (H′) increased, indicating that a certain degree of functional redundancy occurred in the community and that this increased with species diversity. As a result, species diversity (H′) failed to reach the limit that would result in a non-significant correlation between species diversity and functional diversity. 3) The effect of FD (FDRao, FDis) on aboveground net primary productivity (ANPP) of the alpine meadow ecosystem was greater than that of SD (H′). Binary linear regression showed that the effect of SD (H′) on ANPP was negligible compared with that of FD (FDRao,FDis).It should be noted that the loss of functional traits or a reduction in the number of trait space dimensions, such as results from the decline or loss of species diversity, would inevitably reduce the functional diversity of community, indicating a complementary relationship between species diversity and functional diversity. Thus, future studies on the relationship between biodiversity and ecosystem functioning should focus simultaneously on the effects of both species diversity and functional diversity on ecosystem functioning.
Key Words:species diversity (SD); functional diversity (FD); trait dissimilarity among species; species evenness; alpine meadow
DOI:10.5846/stxb201405070903
*通讯作者
Corresponding author.E-mail: zhuzhihong@snnu.edu.cn
收稿日期:2014- 05- 07; 网络出版日期:2015- 06- 11
基金项目:国家自然科学基金项目(31070382)
陈超, 朱志红, 李英年, 姚天华, 潘石玉, 卫欣华, 孔彬彬, 杜家丽.高寒草甸种间性状差异和物种均匀度对物种多样性与功能多样性关系的影响.生态学报,2016,36(3):661- 674.
Chen C, Zhu Z H, Li Y N, Yao T H, Pan S Y, Wei X H, Kong B B, Du J L.Effects of interspecific trait dissimilarity and species evenness on the relationship between species diversity and functional diversity in an alpine meadow.Acta Ecologica Sinica,2016,36(3):661- 674.

