新疆革蜱源性绵羊无浆体病原DNA检测
张玉婷, 孟 元,郭庆勇,王振宝,吴 敏,张 杨,巴音查汗
(1.新疆农业大学动医学院,乌鲁木齐 830052;2.浙江大学生科院,杭州 310058)
新疆革蜱源性绵羊无浆体病原DNA检测
张玉婷1, 孟 元2,郭庆勇1,王振宝1,吴 敏2,张 杨1,巴音查汗1
(1.新疆农业大学动医学院,乌鲁木齐 830052;2.浙江大学生科院,杭州 310058)
【目的】探究新疆部分地区羊体表寄生的优势革蜱携带病原状况。【方法】采用形态学(借助显微镜)和分子生物学(革蜱种属特异性ITS-2F、ITS-2R引物进行扩增)方法,对采集于阿勒泰、巴音郭楞州等地州羊体表寄生的蜱虫(N=267)进行种属鉴定,对其携带的绵羊无浆体病原(MSP4基因为靶标) DNA 进行PCR检测。【结果】当地羊体表寄生的优势种革蜱为草原革蜱(D.nuttalli)、森林革蜱(D.slivarum)和边缘革蜱(D.marginatus),均能携带病原MSP4基因,且这三种革蜱种特异基因扩增产物序列(820 bp)与已登录记载的同种革蜱的核苷酸同源性为99%。被革蜱叮咬的126份羊全血样品中 34份为绵羊无浆体阳性,均能扩增出850 bp目的基因条带。【结论】新疆阿勒泰地区、巴音郭楞州等地州羊群感染了绵羊无浆体病,其阳性率为27%(34/126)。为进一步研究新疆革蜱的公害州及羊无浆体病的综合防治提供科学依据。
革蜱;鉴定;绵羊无浆体;病原DNA;检测
0 引言
【研究意义】蜱隶属于节肢动物门,蛛形纲,蜱螨目,蜱亚目,是一类以吸取宿主血液为生的体表寄生虫[1,2]。我国已记载的蜱种110种,分为硬蜱和软蜱两大类[3]。【前人研究进展】硬蜱直接叮咬或携带病原体对宿主造成伤害,直接危害表现为被叮咬动物骚动不安和伤口感染而致生产性能下降,大量寄生时,分泌的毒素引起动物麻痹, 造成蜱瘫[4-5];更重要的是它是许多病原体的传播媒介和保虫宿主[6]。其中以革蜱作为传播媒介的疾病主要有:森林脑炎(Forest-spring Encephalitis)、莱姆病(lyme disease)、土拉菌病( Tularaemia)、北亚蜱媒斑点热(Rickettsiosis sibirica)、Q热(Q fever)及人畜共患无浆体病等,给人类健康和畜禽业造成严重危害[2],已成为全球医学界和兽医学界倍加关注的公共卫生问题[7-8]。【本研究切入点】新疆幅员辽阔,羊养殖业发达,如阿勒泰和巴音郭楞州等地州的大部分羊群均自然放牧为主,容易被硬蜱侵袭导致蜱媒疾病。【拟解决的关键问题】研究从自然放牧羊群中随机采样,了解当地羊身上吸血蜱的优势种媒介蜱的同时,检测其携带病原状况,即革蜱源性绵羊无浆体病原的感染情况等,为新疆绵羊无浆体病及其媒介蜱的有效防控提供科学依据。
1 材料与方法
1.1 材 料
1.1.1 试验动物、蜱、全血
阿勒泰和巴音郭楞州自然放牧羊群随机采样,其中采集于羊体表吸血的蜱虫为267只,羊全血为126份。
蜱:采集于新疆阿勒泰地区绵羊无浆体流行区的羊体上未吸血活蜱、半饱血活蜱和饱血活蜱约1 654只(雌雄均有),从中随机抽取119只雄蜱,148只雌蜱作为检测样品(除去饱血和半饱血蜱虫),且保证从各地区最少抽到雌蜱和雄蜱各25只。全血:采集被革蜱叮咬的126份羊全血样品,保存于-20°C,备用。
1.1.2 试剂及仪器
10% 的NaOH、乙醇(30%、50%、70%、80%、90%、95%、100%)、1:1的无水乙醇丙二醇、100%丙二醇、中性树胶、甲醇、蒸馏水;琼脂糖、溴化乙锭;PCR permix;DNA Mark(康为);基因组提取试剂盒(赛百盛),质粒提取试剂盒(OMEGA),胶回收试剂盒(OMEGA)。
显微镜(Motic BA400),组织解剖镜(Motic SMZ-168),培养箱,温度和湿度表,氧化锌胶袋,挑虫针,玻璃管,HWS12型电热恒温水浴锅;移液器,PCR仪(美国Bio-Rad公司),Gel Doc2 000紫外凝胶成像系统,DYCP-31DN型水平电泳槽,扫描电镜(日立序520型)。
1.2 方 法
1.2.1 形态学鉴定
2.4.3 浸出物检测 采用热浸法测定,直接粉碎得到的枸杞子粉末与经上述3种预处理方法得到的枸杞子粉末,其浸出物量分别为75.4%、75.6%、72.6%、72.5%,均未少于55.0%。
1.2.1.1 蜱的玻片标本制作与观察对蜱虫样品进行清洗处理,从外观特征上初步分类,镜下对其做进一步鉴定。蜱在制片之前,需先用10%的NaOH或KOH水溶液煮沸数分钟,直至虫体内部的肌肉和内脏被溶解排出,虫体软化透明为止。然后经清洗-脱水(依次经过30%、50%、70%、80%、90%、95%、100%乙醇)-透明(乙醇和1:1的无水乙醇丁香油、纯丁香油各0.5~1 h)-封片(用光学树脂胶或加拿大树胶封片)后镜检。
1.2.1.2 光学显微镜观察革蜱,形态学鉴定要点借助体视镜观察革蜱的盾板、假头、假头基形状、口下板、生殖孔、肛沟、气门板及足基节等形态特征,根据新疆蜱类志分类检索表进行形态学分类鉴定[9]。
1.2.2 革蜱分子生物学鉴定
1.2.2.1 引物的设计与合成根据实验室已建立的革蜱类鉴定的PCR检测方法进行检测,目的片段大小为820 bp。上游引物:ITS-2F:5'-TCGTCTGTCTGAGGGTCGGA-3',下游引物:ITS-2R:5'-TCGTCTGTCTGAGGGTCGGA-3',主要扩增革蜱种属特异性核酸。
参考de la Fuente等[10]合成检测山羊无浆体MSP4基因的引物,预计扩增片段长度为850 bp,上游引物SF:5'-CCGGATCCTTAGCTGAACAGGAATCTTGC-3';下游引物:5'-GGGAGCTCCTATGAATTACAGAGAATTGTTTAC-3'。所有引物均由英潍捷基(上海)贸易有限公司合成。
1.2.2.2 革蜱DNA及羊全血DNA的提取将单个蜱虫样品置于大平皿中用蒸馏水刷洗干净后,在研钵中研磨充分后,加入200 μL PBS(1×)缓冲液,20 μL Proteinase K消化液,混匀,与56℃恒温水浴锅消化30 min后,用DNA提取试剂盒进行革蜱基因组DNA的提取;取绵羊血液300 μL用DNA提取试剂盒提取,DNA分装后-20℃保存备用。
1.2.2.3 革蜱DNA的PCR鉴定革蜱源性DNA扩增PCR反应体系(20 μL):2×TaqMaster Mix 10 μL,ITS-2F(10 μM)2 μL,ITS-2R(10 μM)2 μL,模板DNA 2 μL,ddH2O 4 μL。PCR反应程序:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,35个循环;72℃延伸7 min,4℃保存。
1.2.3 革蜱源性无浆体MSP4的PCR检测羊无浆体反应体系(20 μL):2×TaqMaster Mix 10 μL,SF(10 μM)2μL,SR(10 μM)2 μL,模板DNA 2 μL(1.2.2.2中的绵羊全血DNA),ddH2O 4 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸7 min,4℃保存。
2 结果与分析
2.1 革蜱形态学鉴定
借助显微镜下形态,如盾板珐琅斑、气门板、假头基、足基节、缘朵、眼等形态结合革蜱相关检索表进行革蜱种属鉴定。研究表明,此次采集点羊体表寄生的优势种革蜱为草原革蜱(D.nuttalli)、森林革蜱(D.slivarum)和边缘革蜱(D.marginatus)。
2.1.1 草原革蜱(Dermacentornuttalli)
盾板亚圆形,宽阔,其上珐琅彩明显。足转节Ⅰ背距短,末端圆钝。足基节Ⅳ外距不超过该节后侧缘。气门板背突较直而短,不达盾板边缘,其背缘无几丁质增厚部。成蜱主要寄生在羊、牛、马等大型家畜体表,有时也侵袭人。可传播巴贝斯虫和无浆体等。
2.1.2 森林革蜱(Dermacentorsilvarum)
盾板珐琅彩明显,足转节I背距末端尖细。足基节Ⅳ外距明显,末端超出该节后缘,气门板逗点形,背突末端伸达盾板边缘,背缘无几丁质增厚部。成虫寄生在各种家畜和大型野生动物体表,也侵袭人,可传播巴贝斯虫和无浆体等。
2.1.3 边缘革蜱(Dermacentormarginatus)
盾板珐琅彩较淡,足较粗壮。基节I外距明显短于内距。基节II、III外距短小,呈齿状, 气门板大,长逗点形,背突微弯,伸至盾板边缘,末端宽窄有变异。成虫寄生在羊、牛、马等大型家畜体表,可传播巴贝斯虫和无浆体等。
2.2 革蜱分子生物学鉴定
2.2.1 革蜱ITS-2序列PCR扩增
以所提取的蜱虫基因组DNA为模板,经ITS-2F、ITS-2R引物进行PCR扩增,PCR产物经1%琼脂糖凝胶电泳后,扩增出大小为820 bp的电泳条带,与目的片段相符。图 1
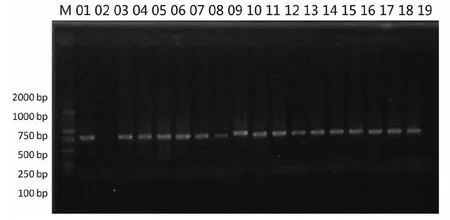
M:DNA分子质量标准;1~18:部分样品的PCR产物;19:阴性对照
2.2.2 革蜱源性羊无浆体病原DNA检测结果
以所提取的革蜱及羊血液基因组DNA为模板,经SF、SR引物进行PCR扩增,PCR产物经1%琼脂糖凝胶电泳后,扩增出大小为850 bp的电泳条带,与目的片段相符。图 2
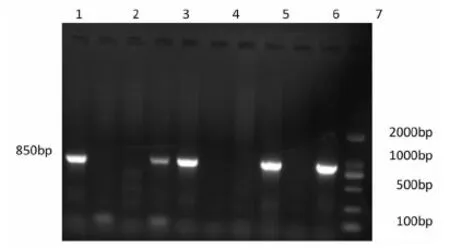
M:DNA分子质量标准,1~10:1~10号样品的PCR产物
2.2.3 革蜱及其携带羊无浆体病原基因克隆测序
2.2.3.1 革蜱种属特异性基因克隆的测序
选取图1前10个样品中,PCR产物强阳性的条带,扩大PCR反应体系至50 μL,做胶回收,将胶回收产物连接至T载体,经转化培养,将提取的质粒进行PCR鉴定,得到预期大小的片段。测序结果表明,采集蜱虫的ITS序列与NCBI中登录的庆阳株(JQ737109.1)和平凉株(JQ737108.1)同源性均为99%,判定出该蜱虫为边缘革蜱、草原革蜱及森林革蜱。
2.2.3.2 羊无浆体病原基因克隆的测序
同源性比对发现,所获得的绵羊无浆体MSP4序列与绵羊无浆体甘肃株(HQ456347)同源性最高,达到100%,与其他绵羊无浆体同源性为99%,与边缘无浆体的同源性为94%。由此可知,新疆阿勒泰地区部分羊感染的是绵羊无浆体,其感染率。表1
表1 所采集革蜱携带无浆体情况
Table.1 Faunal distribution of mediaDermacentorin Xinjiang
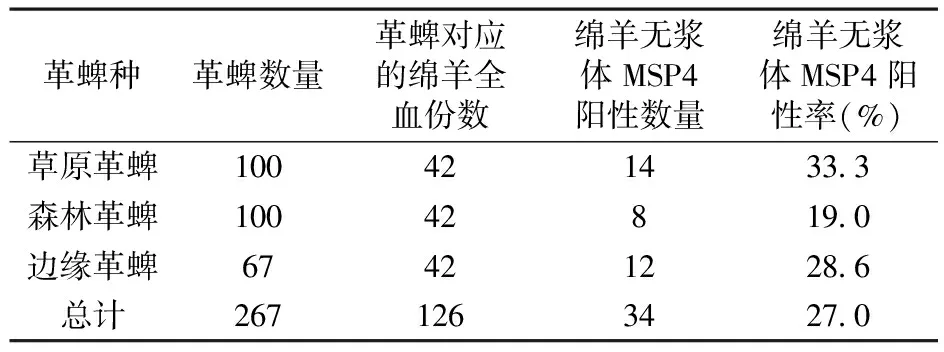
革蜱种革蜱数量革蜱对应的绵羊全血份数绵羊无浆体MSP4阳性数量绵羊无浆体MSP4阳性率(%)草原革蜱100421433 3森林革蜱10042819 0边缘革蜱67421228 6总计2671263427 0
3 讨 论
试验将形态学与分子生物学结合鉴定羊体表吸血的革蜱类,发现羊体表寄生的革蜱优势种为草原革蜱、森林革蜱、边缘革蜱。依据三种新疆革蜱类优势分布种的生物学特征[10-12]及其携带病原状况,可建议在革蜱活动季节新疆阿勒泰、巴州等地放牧区域羊群加强对革蜱侵袭羊群吸血而导致无浆体病。与孙明等[13]报道的甘肃景泰县的羊无浆体的感染(30.6%)相比,新疆阿勒泰、巴州的部分羊感染有绵羊无浆体感染率(27%)相近,这说明新疆阿勒泰、巴州地区的部分羊感染了绵羊无浆体,需要加强对革蜱的生物防控。另外,被媒介革蜱叮咬的羊群全血内存在绵羊无浆体,该情况与殷宏等[14]报道的一致。
4 结 论
研究为羊体表吸血革蜱种及其携带病原等的检查提供了一种简便、准确的分子生物学方法,同时为蜱媒疾病控制及蜱媒种群分析等研究工作提供了基础。
References)
[1] Nava, S., Guglielmone, A. A., & Mangold, A. J. (2009). An overview of systematics and evolution of ticks. front biosci.FrontiersinBioscience,14:2,857-2,877.
[2] 汪明.兽医寄生虫学[M].北京:中国农业大学出版社,2003:16-17.
WANG Ming. (2003).VeterinaryParasitology[M].Beijing: China Agricultural University press:16-17. (in Chinese)
[3] Barker, S. C., & Murrell, A. (2004). Systematics and evolution of ticks with a list of valid genus and species names.Parasitology, 129(1):S15-S36.
[4] 王玉霞.蜱功能基因研究进展[J].动物医学进展,2005,26(7):231-235.
WANG Yu-xia. (2005). Progress on Functional Genes from Ticks [J].AnimalMedicalProgress, 26(7):231-235.
[5] Klompen, J. S. H., W C Black, IV,, J E Keirans, and, & J H Oliver, Jr. (1996). Evolution of ticks..AnnualReviewofEntomology, 41(1):141-161.
[6] 孔繁瑶.家畜寄生虫学[M].中国农业大学出版社,2010.
KONG Fan-yao. (2010).VeterinaryParasitology[M]. Beijing: China Agricultural University press. (in Chinese)
[7] 高金亮,殷宏,罗建勋.蜱的免疫学防制研究现状[J].中国兽医科技,2004,34(10): 392-441.
GAO Jin-liang, YIN Hong, LUO Jian-xun. (2004). Research status of immunological control of ticks [J].ChineseJournalofVeterinaryScienceandTechnology, 34(10): 392-441. (in Chinese)
[8] Socolovschi, C., Doudier, B., Pages, F., & Parola, P. (2008). Ticks and human tick-borne diseases in Africa.MédecineTropicaleRevueDuCorpsDeSantéColonial, 68(2):119-213.
[9] 于心,叶瑞玉,垄正达.新疆蜱类志[M].乌鲁木齐:新疆科技卫生出版社,1997:1-22.
YU Xin,YE Rui-yu, LONG Zheng-da. (1997).ThetickofXinjiang[M].Urumqi: Xinjiang Science and Technology and Health Press:1-22. (in Chinese)
[10] Fuente, J. D. L., Atkinson, M. W., Naranjo, V., Mera, I. G. F. D., Mangold, A. J., & Keating, K. A., et al. (2007). Sequence analysis of the msp4 gene of anaplasma ovis strains.VeterinaryMicrobiology, 119(2-4):375-381.
[11] 吕继洲,王振宝,袁向芬,等.草原革蜱和边缘革蜱的分子生物学鉴定[J].中国畜牧兽医,2013,40(9):8-14.
LV Ji-zhou, WANG Zhen-bao,YUAN Xiang-fen, et al. (2013). Molecular Biological Identification of Dermacentor nuttalliand Dermacentor marginatus [J].ChineseAnimalHusbandryandVeterinaryMedicine, 40(9):8-14.
[12] 邓国藩,姜在阶.中国经济昆虫志-蜱螨目蜱总科[M].北京科学出版社,1991:62-326.
DENG Guo-fan, JIANG Zai-jie. (1991).EconomicinsectfaunaofChinese-Acarinatick[M].Beijing: Science and Technology Press:62-326. (in Chinese)
[13] 孙明,刘志杰,马米玲,等.甘肃省景泰县羊无浆体病的诊断[J].动物医学进展,2012,33(4):114-117.
SUN Ming, LIU Zhi-jie, MA Mi-ling, et al. (2012). A Diagnosis of Ovine Anaplasmosis in Jintai County, Gansu Province [J].ProgressinVeterinaryMedicine, 33(4):114-117. (in Chinese)
[14] 殷宏,吕文顺,张其才,等.甘肃省部分牛羊血液原虫传播媒介的实验研究[J].中国兽医寄生虫病,2000,(1):18-19.
YIN Hon, LV Wen-shun, ZHANG Qi-cai, et al. (2000) Experimental Transmission of some bovine and ovine tick borne haemoprotozoans in Gansu Province[J].ChineseJournalofVeterinaryParasitology, (1):18-19. (in Chinese)
Fund project:Supported by Supporting Xinjiang by Science and Technology Program (2013911061)
The DNA Detection of Dermacentor-borneAnaplasmaovisin Xinjiang
ZHANG Yu-ting1, MENG Yuan2, GUO Qing-yong1, WANG Zhen-bao1,WU Min2, ZHANG Yang1, Bayinchahan1
(1.CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi830052,China; 2.CollegeofLifeSciences,ZhejiangUniversity,Hangzhou310058)
【Objective】 To explore the situation of pathogen of Dermacentor on the surface of sheep from parts of Xinjiang. 【Method】 The dermacentor species of grazing flocks surface parasitic ticks acquisited from Altay, Korla and other places in Xinjiang were identified by using morphology (through microscopy) and molecular biology method (amplification of Dermacentor species-specific ITS -2F, ITS-2R primers). In addition, pathogen ofAnaplasmaovis(MSP4 gene as targets) was detected by PCR. 【Result】 The results showed that the advantages ofDermacentorfrom local sheep wereD.nuttalli,D.slivarumandD.marginatusand they all carriedAnaplasmaovis. The amplification product of specific gene primers from these Dermacentor was about 820 bp. Homology analysis indicated that the nucleotide of tested samples had 99% homology with that of the same species ofDermacentornucleotidelogged GenBank. Its nucleotide homology with that from GenBank was up to 99%. There are 34 positive samples which were amplificated by target gene primers (about 850 bp) in 126 whole blood samples, which suggested that sheep from Altay and Korla were infected with Amplasam ovis and the rate of infection was 27%.【Conclusion】 The test has provided scientific basis for further study of the disadvantages ofDermacentorin Xinjiang and for the prevention and control ofAmplasamovis.
Dermacentor; identification;Amplasamovis; DNA of pathogen; detection
10.6048/j.issn.1001-4330.2016.01.025
2015-05-06
自治区科技支疆项目(2013911061)
张玉婷(1989-),女,云南大理人,硕士研究生,研究方向为寄生虫分子免疫学,(E-mail)529652225@qq.com
巴音查汗(1964-),女,新疆人,教授,博士生导师,研究方向为预防兽医学,(E-mail)bynch@hotmail.com
S852.74+6
A
1001-4330(2016)01-0185-05

