Nrf2及其信号通路相关因子在噪声性聋大鼠耳蜗的表达△
蔡蔚然 郑贵亮# 葛萨萨,2 张国平 周义德
·实验研究·
Nrf2及其信号通路相关因子在噪声性聋大鼠耳蜗的表达△
蔡蔚然1郑贵亮1#葛萨萨1,2张国平1周义德1
【摘要】目的研究Nrf2/Keapl-ARE信号通路相关因子核因子2(nuclear factor E2 related factor 2,Nrf2)、超氧化物歧化酶1(superoxide dismutas 1,SOD1)、血红素加氧酶1 (heme oxygenase- 1,HO-1)在噪声致聋大鼠耳蜗的表达变化。方法SD大鼠30只,随机分为噪声组15只和正常对照组15只。正常对照组不给予噪声暴露,噪声组动物给予连续12小时115 dB SPL的稳态白噪声暴露,分别于噪声暴露后1、3、7天对两组动物进行ABR和DPOAE检测,并于噪声暴露7天后取耳蜗组织运用RT-PCR技术及Peggy Sue微量蛋白检测技术检测Nrf2、SOD1、HO-1的表达。结果噪声暴露后1、3、7天,噪声组大鼠ABR反应阈均高于正常对照组(P<0.05),噪声组DPOAE幅值较正常组明显下降(P<0.05);噪声暴露后7天,噪声组大鼠耳蜗Nrf2、SOD1、HO-1的mRNA表达(1.11±0.05、1.45±0.12、1.15±0.03)上调,高于正常对照组(1.00±0.02、1.10±0.12、0.92±0.08),差异均有统计学意义(P<0.05)。Peggy Sue微量检测系统检测结果显示噪声组Nrf2及SOD1、HO-1蛋白含量均高于正常组(P<0.05)。结论强噪声暴露后,SD大鼠耳蜗Nrf2基因表达和蛋白含量升高,Nrf2/Keapl-ARE信号通路下游抗氧化酶SOD1、HO-1基因表达和蛋白含量也随即上调,此改变可能对噪声引起的耳蜗内氧化应激损伤有一定的保护作用。
【关键词】噪声性聋;Nrf2;超氧化物歧化酶1;血红素加氧酶1
噪声引起耳蜗内的氧化应激可产生大量活性氧(reactive oxygen species,ROS),过量的ROS具有细胞毒性,其不仅可以破坏生物膜磷脂、DNA,还可以引起细胞内的钙超载、兴奋性毒性[1],激活细胞凋亡通路,导致毛细胞凋亡[2]。Nrf2/Keapl-ARE信号通路相关因子核因子2(nuclear factor E2 related factor 2,Nrf2)是调节氧化应激的关键转录因子,广泛存在于体内组织中,其通过与抗氧化反应元件(antioxidant response element,ARE)相互作用,调节下游多种抗氧化酶类基因的转录。Nrf2/Keapl-ARE信号通路在氧化应激防御机制中起着非常重要的作用[2],研究表明,Nrf2/Keapl-ARE信号通路在老年性聋、药物性聋[3]以及噪声性听力损失中均有一定的保护作用。然而,目前关于Nrf2/Keapl-ARE信号通路在噪声性听力损失的抗氧化应激中的具体机制尚未完全清楚。本研究利用RT-PCR、Peggy Sue超微量蛋白检测系统等分子生物学技术,研究噪声损伤后大鼠耳蜗内Nrf2/Keapl-ARE信号通路及下游抗氧化因子的表达,探讨其在噪声引起的内耳损伤中可能发挥的作用和机制。
1材料与方法
1.1实验动物及分组 选用SPF级健康SD大鼠30只(海军医学研究所动物中心提供),耳廓反射正常,体重200~300 g,雌雄不拘。随机分为噪声组(15只)和正常对照组(15只)。
1.2主要仪器 信号发生器1027型 ( B&K,丹麦),实时频谱分析仪RTA840型(Norsonic,挪威),功率放大器FJD360型(FEILO飞乐,上海),听性脑干反应测听仪(Ihsprog/SmartEP测听系统,美国),畸变产物耳声发射仪(Ihsprog/SmartOAE测听系统,美国),Real-time PCR检测仪(Roche Light Cycler 480II,德国),Peggy Sue微量蛋白定量分析系统(Protein Simple公司,美国),低温冷冻离心机CT15RE型(HITACHI,日本)。
1.3噪声暴露方法 将噪声组动物放置在环境噪声小于25 dB A的隔声室内,每个笼子放1只。噪声采用声场给声方式,通过实时频谱分析仪(型号RTA840)和麦克风校准前置放大器(型号1201)连续监测噪声信号,时间和空间上声强误差均不超过±1 dB;给予的宽频稳态白噪声平均强度为115 dB SPL,连续暴露12小时。正常对照组不给噪声暴露。
1.4ABR检测对照组及噪声组大鼠噪声暴露前、暴露后1、3、7天进行双耳ABR 测试。记录电极置于测试耳耳廓下软组织,参考电极置于对侧耳廓下软组织,地极插入脚跖软组织内,刺激声为0.10 ms交替短声,强度从90 dB SPL开始,先以10 dB递减,然后以5 dB递减,以能分辨出波Ⅲ的最低刺激强度为ABR阈值,并重复检测2次。
1.5DPOAE检测对照组及噪声组大鼠噪声暴露前、暴露后1、3、7天分别进行DPOAE检测。方法:麻醉后的大鼠置于隔声室,刺激声强度L1=65 dB SPL,L2=55 dB SPL,f1/f2=1.22,数据分析以f2频率为准,取783、1 105、1 560、2 211、3 125、4 416、6 250和8 837 Hz共8个频率点进行测试,每耳系统自动重复测2次,叠加32次,记录各频率左、右耳的平均DPOAE反应幅值。
1.6耳蜗组织取材噪声暴露后7天完成ABR及DPOAE测试后,动物麻醉下断头,取出双侧听泡,放入4 ℃预冷PBS,在解剖显微镜下由蜗尖至蜗底分离耳蜗外侧壁,直至暴露全耳蜗基底膜,剪除螺旋韧带,取下基底膜,置于冻存管内,迅速放入液氮中保存备用。
1.7RT-PCR检测 用Trizol试剂盒提取总RNA,用TaKaRa逆转录试剂盒合成cDNA,37 ℃孵育15分钟;85 ℃,5 s,灭活逆转录酶。使用Roche Light Cycler 480II Real-time PCR检测仪,按照TaKaRa 的SYBRGreen PCR试剂盒将稀释5倍的cDNA进行Real-time PCR检测,引物及探针设计见表1,反应条件为以三磷酸甘油醛脱氢酶(GAPDH)为内参,数据采用仪器自带软件分析,用2-ΔΔCT法进行定量,检测对照组及噪声暴露后7天噪声组大鼠耳蜗核因子2(nuclear factor E2 related factor 2,Nrf2)、超氧化物歧化酶1(superoxide dismutas 1,SOD1)、血红素加氧酶1 (heme oxygenase- 1,HO-1)的表达。

表1 HO-1、Nrf2、SOD-1引物序列
1.8Peggy Sue微量蛋白定量分析将Peggy Sue标准装中的Ladder、5×Fluor Master、DTT按比例混合到0.6 ml的EP管中。按照样品与混合物4:1的比例加入5×Fluor Master使样品最终浓度为0.2 mg/ml。将混合好的样品和Biotinylated Ladder进行95 ℃、5 min变性,置于冰上。将100 μl Luminol-S与100 μl Peroxide混合后置于冰上,按照说明书将所有试剂加入到384孔板中,上机检测对照组及噪声暴露后7天噪声组大鼠耳蜗Nrf2及下游HO-1、SOD1与β-actin蛋白灰度值的比值,结果使用Compass软件分析。
1.9统计学方法运用SPSS 17.0软件对数据进行统计分析,组间两两比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2结果
2.1各组ABR反应阈比较噪声暴露前噪声组与对照组ABR反应阈差异无统计学意义(P>0.05),噪声暴露后第1、3、7天噪声组的ABR反应阈显著增高,与正常组比较差异有统计学意义(P<0.05)(表2)。

表2 噪声组与对照组各时间点ABR阈值
注:*与对照组比较,P<0.05
2.2各组DPOAE检测结果噪声暴露前两组DPOAE幅值无明显差异(P>0.05);噪声组噪声暴露后1天1 105、1 560、2 211、3 125、4 416、6 250、8 837 Hz DPOAE幅值显著下降(P<0.01),噪声暴露后7天这些频率幅值虽有上升,但与正常组比较差异依然显著(P<0.05或P<0.01)(表3)。

(n=15只)
注:与对照组比较,*P<0.05,**P<0.01
2.3RT-PCR结果 噪声暴露后7天噪声组耳蜗Nrf2、SOD1、HO-1 mRNA表达显著升高,与正常组比较均有显著差异(P<0.05)(表4)。

表4 对照组与噪声组暴露后7天大鼠耳蜗Nrf2、
2.4Peggy Sue微量蛋白定量分析结果 耳蜗组织Peggy Sue微量蛋白定量分析的代表性结果见图1,为便于分析,将所有结果进行量化处理,结果表明,与对照组比较,噪声暴露后7天大鼠耳蜗Nrf2、HO-1、SOD1蛋白表达明显增高(P<0.05)(表5)。
表5对照组及噪声组暴露后7天大鼠耳蜗Nrf2、HO-1、
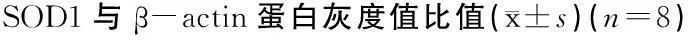

组别Nrf2(×10-4)HO-1(×10-2)SOD1对照组0.40±0.080.20±0.060.43±0.08噪声组暴露后7天2.42±0.13*1.42±0.12*1.89±0.15*
注:*与对照组比较,P<0.05

图1 Nrf2及其下游HO-1、SOD1的Peggy Sue
3讨论
耳蜗内的ROS过量表达是造成噪声暴露后耳蜗损伤的最重要原因[4]。噪声暴露过程中, 由于内耳听毛细胞的过度驱动及耳蜗血流量减少,细胞内无氧酵解增加,ROS产生过多并在细胞内堆积。强氧化性的ROS可以直接引起脂质过氧化反应和DNA过氧化反应,对细胞持续造成损害[5],严重的可导致毛细胞凋亡并引起感音神经性听力损失[6]。
Nrf2是细胞抗氧化的关键调节者,正常情况下,胞浆蛋白Keapl将Nrf2以二聚体形式锚定于胞浆中,抑制Nrf2激活。当组织和细胞受到外界刺激,产生过量ROS等物质可氧化Keapl上的巯基或磷酸化Nrf2分子中的丝氨酸和苏氨酸残基,从而改变Keapl或Nrf2空间构象,导致Nrf2与Keap1分离,向细胞核内转移;在核内,Nrf2与小分子Maf蛋白结合形成二聚体,然后再与抗氧化反应元件ARE的GCTGAGTCA位结合,启动下游抗氧化酶基因(SOD等)及Ⅱ相解毒酶基因(HO-1等)转录,从而调节细胞氧化还原状态,抵抗氧化应激,实现其抗氧化作用[7~9]。2011年 Tomofumi等[3]学者通过对基因敲除小鼠与正常小鼠实验发现,Nrf2/Keapl-ARE信号通路在庆大霉素药物性聋、老年性聋等动物模型中起到积极的保护作用。 Fetoni等[10]学者发现一种草本提取物迷迭香酸可以通过增强内源性的抗氧化防御系统,激活Nrf2/Keapl-ARE通路,减轻噪声性听力损伤,减小听力阈移。
Nrf2调控的 SOD及HO-1均为公认的重要的抗氧化酶,在体内抗氧化应激反应中发挥关键作用。SOD具有清除强细胞毒性的超氧化物自由基的作用,SOD1也称为铜锌超氧化物歧化酶(Cu/Zn superoxide dismutase,Cu/Zn SOD),耳蜗中74%的SOD为SOD1[11]。SOD可转换超氧阴离子自由基生成H2O2,而H2O2可以通过体内谷胱甘肽过氧化物酶(GSH-Px)或过氧化氢酶(CAT)解毒成无害的H2O[12]。HO-1是血红素代谢的关键酶,在一定条件下可将血红素分解为 CO、胆绿素、Fe2+,而这三种产物均具有抗氧化性,可以中和强氧化性的ROS,在氧化还原失衡的情况下保护细胞[13]。Peggy Sue是一种以毛细管装置为基础的全自动蛋白检测方法,不受样本基质、样本浓度、检测抗体的影响,较传统Western blot方法更加准确可靠。Peggy Sue可以检测极微量的蛋白,可以在微克的细胞裂解液中进行匹克级的蛋白检测[14],极适合蛋白含量极少的耳蜗组织蛋白检测。因此,本实验先通过ABR及DPOAE检测,确定强噪声暴露可导致大鼠听力下降,在噪声暴露7天后其ABR反应阈及DPOAE幅值虽然仍低于对照组但较噪声暴露后1天有所改善,同时, 耳蜗Nrf2基因的mRNA表达上调,蛋白含量增多,引起了Nrf2/Keapl-ARE信号通路下游抗氧化蛋白基因SOD1、HO-1mRNA表达增多,SOD1及HO-1蛋白含量增高。提示这种变化有利于减少耳蜗内的ROS,维持噪声暴露后耳蜗内氧化还原状态的平衡,推测是强噪声暴露后耳蜗内发生的一种自我防御机制。
综上所述,强噪声暴露后大鼠听力显著降低的同时,耳蜗Nrf2基因表达和蛋白含量升高,Nrf2/Keapl-ARE信号通路下游抗氧化酶SOD1、HO-1基因表达和蛋白含量也随即上调,可能对噪声引起的耳蜗内氧化应激损伤具有一定的保护作用。本实验为今后研究噪声性聋的干预方法提供了新的思路。
4参考文献
1Henderson D, Bielefeld EC, Harris KC , et al . The role of oxidative stressin noise-induced hearing loss[J]. Ear Hear, 2006,27:1.
2Lee JM, Johnson JA. An important role of Nrt2-ARE pathway in the cellular defense mechanism[J]. J Biochem Mol Biol, 2004, 37:139.
3Tomofumi H , Keiji T , Bungo N,et al.Protective role of Nrf2 in age-related hearing loss and gentamicin ototoxicity[J]. Biochem Biophys Res Commun,2011,415:94.
4Liwei C, Ning Y, Yan L,et al.Hydrogen-saturated saline protects intensive narrow band noise-induced hearing loss in guinea pigs through an antioxidant effect[J]. PLoS One,2014, 9:e100774.
5Rewerska A,Pawelczyk M,Rajkowska E,et al.Evaluating D-methionine dose to attenuate oxidative stress-mediated hearing loss following over exposure to noise[J]. Eur Arch Otorhinolaryngol ,2013, 270:1513.
6Teru K, Chisato F, Tatsuya Y. Reactive oxygen species, apoptosis, and mitochondrial dysfunction in hearing loss[J]. Bio Med Res Int,2015, 617207.
7Kaspar JW,Niture SK,Jaiswal AK.Nrf2:Nrf2 (Keap1) signaling in oxidative stress[J].Free Radic Biol Med,2009,47:1304.
8Klaassen CD,Reisman SA.Nrf2 the rescue:efects of the antioxidative/electrophilic response on the liver[J].Toxicol Appl Pharmacol,2010,244:57.
9Brown SL,Sekhar KR,Rachakonda G,et al.Activating transcription factor 3 is a novel repressor of the nuclear factor erythroid-derived 2-related factor2(Nrf2) regulated stress pathway[J].Cancer Res,2008,68:364.
10Fetoni AR,Paciello F,Rolesi R,et al. Rosmarinic acid up-regulates the noise-activated Nrf2/HO-1 pathway and protects against noise-induced injury in rat cochlea[J]. Free Radical Bio Med,2015, 85:269.
11Jose CJ,Mari M,Mark EB,et al.Superoxide dismutase 1 (SOD1)is essential for H202-mediated oxidation and inactivation of phosphatases in growth factor signaling[J]. Proc Natl Acad Sci USA,2008,105:7147.
12Turrens JF.Mitochondrial formation of reactive oxygen species [J]. The Journal of Physiology,2003,552:335.
13Gozzelino R,Jeney V,Soares MP.Mechanisms of cell protection by heme oxygenase-1[J]. Annu Rev Pharmacol Toxicol, 2010,50:323.
14Chen JQ , Madeleine RH , Michelle A,et al. Absolute quantitation of endogenous proteins with precision and accuracy using a capillary Western system[J]. Anal Biochem,2013,442:97.
(2015-07-10收稿)
(本文编辑雷培香)
Expression of Nrf2 and Its Related Factors in the Cochlea of Rats with Noise Induced Hearing Loss
Cai Weiran*, Zheng Guiliang, Ge Sasa, Zhang Guoping, Zhou Yide
(*Department of Otolaryngology-Head and Neck Surgery, Changhai Hospital,Second Military Medical University, Shanghai, 200433, China)
【Abstract】ObjectiveTo study the expression of Nuclear factor E2 related factor 2 (Nrf2), Superoxide Dismutas 1 (SOD1), and Heme Oxygenase- 1( HO-1) factors related to Nrf2 signaling pathway in noise-induced cochlear injury of rats.MethodsA total of 30 SD rats were randomly and equally assigned into the following 2 groups: noise group and normal control group. The rats in noise group were exposed to an 115 dB SPL continuous steady white noise for 12 hours, then 1 day, 3 days, and 7 days later, the rats receveid the ABR and DPOAE testing after noise exposure. Both RT-PCR and Peggy Sue trace protein detection techniques were used to detect gene expression in Nrf2 / Keapl-ARE signaling pathway and the protein levels by cochlear tissue sampling after noise exposure 7 days later.ResultsThe ABR thresholds in the noise group was higher than those of in normal control group after noise exposure 1,3, and 7 days later (P<0.05). The DPOAE values of noise group were significantly lower than those of normal control group (P<0.05). The up-regulation of expression of Nrf2, SOD1, HO-1 mRNA(1.11±0.05,1.45±0.12,1.15±0.03) in noise group were higher than those of in the normal control group after noise exposure 7 days later (1.00±0.02,1.10±0.12,0.92±0.08), and the differences were statistically significant (P<0.05). And in Peggy Sue trace detection system, we also found SOD1, HO-1 protein levels in noise group were higher than those of in normal control group.ConclusionAfter the noise-induced cochlear injury in rat, Nrf2 expression in the cochlea increased and up-regulatd expression of downstream gene and protein content such as antioxidant enzymes SOD1 and HO-1gene by regulating Nrf2 / Keapl-ARE signaling pathway, which may be involved in protection against oxidative stress injury in noise-induced cochlear injury of rat.
【Key words】Noise-induced hearing loss;Nrf2;SOD1;HO-1
【中图分类号】R764.43+3
【文献标识码】A
【文章编号】1006-7299(2016)02-0153-04
DOI:10.3969/j.issn.1006-7299.2016.02.011
作者简介:蔡蔚然,女,河南人,硕士研究生,研究方向为耳科学。通讯作者:周义德(Email:ydzhou111@163.com)
网络出版时间:2016-2-116:19
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20160201.1619.026.html
△国家自然科学基金面上项目(81170913)、国家人力资源和社会保障部留学回国人员科研启动基金(2009年)、国家教育部留学回国人员科研启动基金联合资助
1第二军医大学长海医院耳鼻咽喉-头颈外科(上海200433);2上海远洋医院耳鼻咽喉科
#为并列第一作者

