催化湿式过氧化氢氧化苯酚的诱导期研究
周世伟,陈善任,薛朋,徐明岗
中国农业科学院农业资源与农业区划研究所,北京 100081
催化湿式过氧化氢氧化苯酚的诱导期研究
周世伟,陈善任,薛朋,徐明岗*
中国农业科学院农业资源与农业区划研究所,北京100081
摘要针对黏土基催化剂催化过氧化氢(H2O2)氧化苯酚过程中诱导期发生机制及影响因素尚不清楚的问题,采用自制化学反应装置和批动力学试验方法,研究了诱导期发生的原因及其关键影响因子。结果表明:H2O2扩散或吸附到催化剂金属活性位及随后的表面修饰(通过≡Fe(Ⅲ)还原到≡Fe(Ⅱ)降低pH)共同决定了诱导期;Fermi’s方程能很好地拟合苯酚氧化过程(R2>0.99);反应温度和溶液pH强烈影响诱导时间(tI),随温度增加和pH降低,tI分别从59和129 min降到22和0 min(没有诱导期),而催化剂与H2O2浓度对tI的影响相对较小,随催化剂和H2O2浓度增加,tI分别从69和75 min降到32和52 min。尽管诱导时间可通过调整反应参数来缩短或消除,但考虑到成本和环境风险,在用黏土基催化剂处理实际含酚废水时应采用适宜的反应条件:H2O2和苯酚摩尔比为15,催化剂浓度为0.8~1.0 gL,温度为30~40 ℃,不调整介质pH,反应时间为2 h。
关键词催化湿式过氧化氢氧化;黏土基催化剂;苯酚;表面催化反应;诱导期
Study on Induction Period during Catalytic Wet Peroxide Oxidation of Phenol
ZHOU Shiwei, CHEN Shanren, XUE Peng, XU Minggang
Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China
AbstractAiming at improving the understanding of occurrence mechanism and affecting factors of induction period, a small laboratory-made reactor with batch kinetic test method was adopted to investigate the induction period occurrence reasons and the key affecting factors during phenol oxidation by H2O2over clay-based catalysts. The results showed that the contact of active metals with H2O2and the sequent surface modification, by decreasing pH via the reduction of ≡Fe (Ⅲ) to ≡Fe (Ⅱ), jointly determined the induction period. A Fermi′s equation could fit well the kinetic process (R2>0.99), and the reaction temperature and initial solution pH strongly affected the induction time (tI) which reduced from 59 min to 22 min and from 129 min to 0 min (no induction period), respectively, with increasing temperature and decreasing pH. The catalyst amount and H2O2concentration had less effect ontIwhich reduced from 69 to 32 min and from 75 to 52 min, respectively, with increasing the contents of catalyst and H2O2. Although the undesirable induction time could be shortened or eliminated by adjusting reaction parameters, considering its cost and environmental risk, the following optimum reaction conditions should be adopted for CWPO of actual phenol-containing wastewater over clay-based catalysts: the mole ratio of H2O2to phenol being 15, catalyst concentration being 0.8-1.0 gL, temperature being 30-40 ℃, pH of matrix not adjusted, and reaction time being 2 h.
Key wordscatalytic wet peroxide oxidation (CWPO); clay-based catalyst; phenol; surface-catalyzed reaction; induction period
苯酚是工业废水(如精炼厂、焦化厂、煤炭和石化等废水)中常见的污染物[1]。由于高毒性和难生物降解性,苯酚被列为优先控制污染物(priority pollutants),因此,发展有效的苯酚消减技术始终是环境治理中的热点。近年来,催化湿式过氧化氢氧化(catalytic wet peroxide oxidation,CWPO)成为安全、简单、高效和有发展前景的有机物处理技术,由于氧化剂过氧化氢(H2O2)廉价无毒且能在常温常压下快速氧化绝大多数有机物,因此被称为真正的“绿色氧化”,备受青睐[2-6]。黏土基催化剂(水滑石和柱撑黏土等)因其价廉易得,并拓宽了催化剂适用的pH范围,降低了催化剂活性组分的流失,而被广泛应用于含酚废水处理中。
目前,对该反应过程及机理仍不十分清楚,如在苯酚氧化反应过程中,许多研究已观察到诱导期的存在,但对其发生机制却甚少探究,以致存有争议:如Carriazo等[7-8]认为诱导期源于苯酚在催化剂表面的吸附;Park等[9]认为诱导期是由于催化剂表面要降低氧化状态而形成的;Belaroui等[10]将诱导期归于催化剂活性金属组分的溶解;Luo等[11]认为诱导期是由于催化剂表面Fe组分的质子化。深入研究诱导期发生及影响因素有助于阐释类Fenton氧化机理和调控反应过程。笔者研究了苯酚氧化反应中诱导期发生过程和一些关键因素(如反应温度、溶液pH、催化剂浓度和氧化剂浓度等)对诱导期的影响,旨在发展温和、高效的CWPO技术,用于处理难生物降解的有机废水。
1 材料与方法
1.1黏土基催化剂
应用共聚合方法,制备和表征了一系列黏土基催化剂——Cu4.8Ni1.2Al2-水滑石、Cu6Al2-水滑石黏土复合物及Al5-Fe1-柱撑黏土[12-14]。这些催化剂显示出了高催化活性和高稳定性,能够在较低温度(30~40 ℃)、短时间(2 h)内催化H2O2完全氧化苯酚和4-氯酚。因此,将其作为高效非均相催化剂应用于研究中。
1.2苯酚氧化反应
反应条件设定:催化剂剂量为0.5、0.8、1.0、1.5和2.0 gL;H2O2和苯酚摩尔比为5、10、15、20和25;反应温度为30、40和50 ℃;pH为3.5、4.5、5.5、6.5和7.5。
试验在250 mL三口瓶中进行,将150 mL 2.66 mmolL的苯酚溶液与催化剂放入三口瓶后,进行磁力搅拌,加入少量HCl和NaOH调节pH至设定值。待水浴加热到设定温度后,加入一定量的H2O2启动氧化反应,于不同的反应时间(10、20、30、40、50、60、70、80、90和120 min)各取出5 mL反应液,分成2份:一份立即加入0.1 g MnO2以消除残余的,然后离心并收集上清液,用于测定苯酚;另一份直接过滤,测定剩余的H2O2。
溶液用等体积CH2Cl2萃取后,在气相色谱仪(Agilent 7890A GC)上测苯酚浓度,检测器采用火焰离子化监测仪(FID),色谱柱采用气相毛细管色谱柱(HP-5)。操作条件:FID温度为300 ℃;进样口温度为280 ℃;柱头进样及进样体积为1 μL;载气(N2,99.999%)流速恒定,为25 mLmin;柱前压为103.4 kPa。升温程序:40 ℃保持2 min;以10 ℃min升至100 ℃,保持1 min;以25 ℃min升至280 ℃,保持1 min。
基于H2O2与NH4VO3在酸性介质中生成橘红色过氧钒阳离子[17],因此在紫外分光光度计(U-3900H)上可定量测定H2O2浓度,测量波长为450 nm。

注:H2O2和苯酚摩尔比为15;催化剂浓度为1 gL;稳定温度为30 ℃; pH为6.5。图1 不同催化剂下苯酚氧化动力学Fig.1 Kinetics of catalytic oxidation of phenol over different catalysts
2结果与讨论
2.1诱导期的发生
图1是不同催化剂下的苯酚氧化动力学。从图1可以看出,并非所有反应都出现诱导期,可能和催化剂表面特性直接相关:Al5-Fe1-柱撑黏土催化下,有较长的诱导期(50 min);Cu4.8Ni1.2Al2-水滑石催化下,没有诱导期(线性);Cu6Al2-水滑石黏土复合物催化下,有较短的诱导期(<10 min)发生。可能原因是H2O2扩散或吸附到催化剂活性金属表面位是苯酚氧化反应得以发生的前提,因此,该过程决定了诱导期长短。Al5-Fe1-柱撑黏土中活性金属Fe浓度较低,且被包围在黏土层间,与H2O2接触需要一定的时间;相反,Cu4.8Ni1.2Al2-水滑石中活性金属Cu浓度高,且裸露在矿物表面,与H2O2容易接触。

图2 Al5-Fe1-柱撑黏土催化苯酚氧化(30 ℃)过程中H2O2分解动力学Fig.2 Kinetics of H2O2 decomposition during the catalytic oxidation of phenol over Al5-Fe1-PILC at 30 ℃
大量研究表明[2-6],CWPO处理技术中,H2O2分解产生羟基自由基(HO·)是驱动有机物氧化的关键,因此,认为H2O2分解速率或产生HO·速率直接决定了诱导期长短。图2为Al5-Fe1-柱撑黏土催化苯酚氧化过程中H2O2分解动力学。从图2可以看出,在Al5-Fe1-柱撑黏土催化苯酚氧化过程中,H2O2都有一段时间的滞后分解(30~60 min),相应地HO·的产生也会滞后,这会导致苯酚氧化诱导期发生。并且,H2O2分解速率及滞后期受溶液初始pH、催化剂浓度及初始H2O2浓度影响,从而可知这些因素将影响苯酚氧化诱导期。Fermi’s方程能描述整个苯酚氧化动力学过程,该方程表达式如下:
(1)
式中:Ct和C0分别为苯酚在时间t和初始(t= 0)时的浓度,mmolL;k为表观一级动力学速率常数,min-1;t*为过渡时间,min,与S型曲线拐点相关[18-19]。
设三阶微分值为零[11],可以得到诱导时间(tI)计算式:
(2)
Fermi’s方程拟合结果见表1。由表1可知,该方程与苯酚氧化动力学过程拟合较好(R2>0.99,p<0.000 1)。根据表1获得的动力学参数(k和tI),可以评估关键因子(如反应温度和溶液pH等)对苯酚氧化过程的影响。
对H2O2分解速率与苯酚氧化动力学参数k和tI作图,见图3。从图3可以看出,H2O2分解速率与苯酚氧化动力学参数有明显线性相关:随H2O2分解速率加快,k增加且tI变小,即苯酚氧化诱导期缩短,反应速率加快。

表1 Fermi’s方程拟合参数

图3 Al5-Fe1-柱撑黏土催化下H2O2分解速率与苯酚氧化(30 ℃)动力学参数的关系Fig.3 Relationships between H2O2 decomposition rate and oxidation kinetic parameters of phenol over Al5-Fe1-PILC at 30 ℃
总之,Al5-Fe1-柱撑黏土催化苯酚氧化诱导期直接受制于H2O2分解,其分解过程经历如下3个阶段[20-21]:
≡Fe(Ⅲ)+H2O2→≡Fe(Ⅲ)H2O2
(3)
≡Fe(Ⅲ)H2O2→≡Fe(Ⅱ)+HO2·+H+
(4)
≡Fe(Ⅱ)+H2O2→≡Fe(Ⅲ)+HO·+OH-
(5)
通常认为式(4)是H2O2分解速率限制步骤[20],因此,诱导期最终受H2O2分解速率限制步骤,即催化剂表面活化(通过还原过程降低pH)影响。在诱导期,催化剂表面pH持续下降;诱导期后,合适的pH导致大量HO·生成,继而快速氧化苯酚。Tatibou⊇t等[22]发现pH为3.7左右,HO·生成最多,支持了这个猜测。前期的研究[14,23]也证实,无论苯酚还是氯酚,在柱撑黏土上的氧化都存在明显的诱导期,并且,诱导期主要源于柱撑黏土催化剂表面修饰〔通过≡Fe(Ⅲ)还原到≡Fe(Ⅱ)降低表面酸度〕。
本试验进一步表明,诱导期发生的机制是H2O2扩散或吸附到催化剂活性金属位及随后的催化剂表面修饰和H2O2分解,二者共同决定了诱导期长短。
2.2关键因子对诱导期的影响
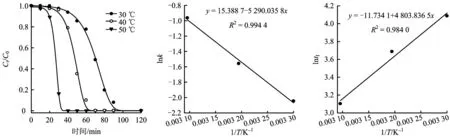
注:H2O2和苯酚摩尔比为15;催化剂浓度为1 gL;pH为6.5。图4 Al5-Fe1-柱撑黏土催化下温度对苯酚氧化过程的影响Fig.4 The effect of temperature on phenol oxidation and its kinetic parameters (k and tI) over Al5-Fe1-PILC
研究表明,反应温度是诱导期最具决定性的影响因子[11,24],温度对苯酚氧化过程的影响见表1和图4。随温度升高,k明显增大(从0.13 min-1升至0.38 min-1),tI显著降低(从59 min降至22 min),并且均存在相关性(R2分别为0.994 4和0.984 0)。该结果与Luo等[11,25]研究结果相似,即诱导时间与反应温度呈指数相关。根据图4的线性关系,可计算出Al5-Fe1-柱撑黏土催化H2O2氧化苯酚的活化能(Ea)为44 kJmol,远低于Akyurtlu等[25]的计算值(139 kJmol),这是因为后者是高温高压下O2氧化苯酚过程。综上,CWPO技术在处理废水中所需能耗低,应予以推广。尽管高温(超过50 ℃)会缩短诱导期,却相应地需要消耗更多电能。

图5 不同反应条件对Al5-Fe1-柱撑黏土催化苯酚氧化过程的影响(30 ℃)Fig.5 Effect of different reaction conditions on phenol oxidation by H2O2 over Al5-Fe1-PILC at 30 ℃
不同反应条件对苯酚氧化过程的影响见表1和图5。从表1和图5可以看出,溶液初始pH极显著地影响诱导期,随pH升高,诱导时间延长。低pH(3.5)下,苯酚浓度几乎随时间直线下降,没有诱导期;高pH(7.5)下,苯酚氧化基本不发生。有研究表明,催化剂表面一定的酸度是HO·得以产生的重要保障[22];Luo等[11]也认为较低pH时催化剂表面Fe能够快速质子化(活化),从而导致H2O2快速分解,苯酚快速氧化。综上,低pH可缩短诱导期。但是,在处理实际废水时,如果靠添加一定量的酸来降低体系pH,进而缩短或消除诱导期是不可取的,因为这可能引起新的环境风险,如Fe和Cu等活性金属淋失。事实上,Al5-Fe1-柱撑黏土等非均相催化剂在正常的pH范围(如苯酚pH为6.5)也能保持极高的催化活性,因此,最为经济友好的CWPO技术是不调整体系的pH。相比反应温度和溶液初始pH,催化剂浓度特别是初始H2O2浓度对诱导期的影响较弱,但都随其用量增加,诱导时间缩短(分别从69 min降至32 min,从75 min降至52 min)(表1和图5)。该结果与Luo等[11]的研究略有不同,其研究结果为苯酚氧化的诱导期基本不受催化剂和氧化剂浓度的影响。总之,适度增大催化剂和H2O2浓度,一定程度上可以加快反应速率,但考虑到效益和环境风险,其用量不宜过大。
综上,CWPO技术处理含酚废水时(使用黏土催化剂),能够观察到反应诱导期,这是因为H2O2吸附、扩散,进而与催化剂活性金属组分接触,最终触发Fenton反应(H2O2分解)和自由基生成-氧化反应,使苯酚等有机污染物快速被氧化降解。研究诱导期发生机制及影响因素具有重要意义:理论上可以揭示类Fenton氧化反应机理,即表面金属还原降低pH是反应限速步骤;实践上可以为缩短甚或消除诱导期提供科学依据,即提高CWPO处理效率。因此,研究并实际调控诱导期是十分必要的。根据本试验结果可知:反应温度、溶液初始pH以及催化剂与氧化剂浓度显著影响(缩短或延长)苯酚氧化反应的诱导时间。因此,在实际处理含酚废水时,可考虑适当增加温度并降低pH,或者适当增加催化剂与氧化剂浓度,以有效缩短诱导期并提升氧化速率。但是,靠改变反应条件来消除或缩短诱导期往往面临着成本增加(增加温度和催化剂氧化剂浓度)或者环境风险增加(降低溶液pH),故不能一味盲目地消除诱导期。结合前期研究,笔者提出最优反应条件:H2O2和苯酚摩尔比为15;催化剂浓度为0.8~1.0 gL;温度为30~40 ℃;pH无需调整;反应时间为2 h。
3结论
(1)黏土催化苯酚氧化过程中,H2O2扩散或吸附到催化剂活性金属位及随后的表面还原修饰(降低pH)决定了诱导期长短。
(2)苯酚氧化过程符合Fermi’s方程(R2>0.99),反应温度、溶液初始pH、催化剂及H2O2浓度明显影响一级动力学速率常数和诱导时间:随温度升高,催化剂和氧化剂浓度增加,或降低pH,诱导期显著缩短。
(3)考虑效益和环境风险,黏土材料催化苯酚氧化的适宜反应条件为:H2O2和苯酚摩尔比为15;催化剂浓度为0.8~1.0 gL;温度为30~40 ℃;pH无需调整;反应时间为2 h。
参考文献
[1]BUSCA G,BERARDINELLI S,RESINI C,et al.Technologies for the removal of phenol from fluid streams:a short review of recent developments[J].Journal of Hazardous Materials,2008,160(23):265-288.
[2]PERATHONER S,CENTI G.Wet hydrogen peroxide catalytic oxidation(WHPCO)of organic waste in agro-food and industrial streams[J].Topics in Catalysis,2005,33(1234):207-224.
[3]LIOTTA L F,GRUTTADAURIA M,DI CARLO G,et al.Heterogeneous catalytic degradation of phenolic substrates:catalysts activity[J].Journal of Hazardous Materials,2009,162(23):588-606.
[4]GARRIDO-RAMIREZ E G,THENG B K G,MORA M L.Clays and oxide minerals as catalysts and nanocatalysts in Fenton-like reactions:a review[J].Applied Clay Science,2010,47(34):182-192.
[5]GIL A,KORILI S A,TRUJILLANO R,et al.Pillared clays and related catalysts[M].Springer:Springer Science+Business Media LLC,2010.
[6]ROKHINA E V,VIRKUTYTR J.Environmental application of catalytic processes:heterogeneous liquid phase oxidation of phenol with hydrogen peroxide[J].Critical Reviews in Environmental Science and Technology,2011,41(2):125-167.
[7]CARRIAZO J G,GUELOU E,BARRAULT J,et al.Catalytic wet peroxide oxidation of phenol over Al-Cu or Al-Fe modified clays[J].Applied Clay Science,2003,22(6):303-308.
[8]KURIAN M,SUGUNAN S.Wet peroxide oxidation of phenol over mixed pillared montmorillonites[J].Chemical Engineering Journal,2006,115(3):139-146.
[9]PARK C,BAKER R T K.Modifications in the catalytic properties of nickel supported on different dielectric oxides[J].Chemistry of Materials,2002,14(1):273-280.
[10]BELAROUI L S,BENGUEDDACH A.Study of the catalytic activity of Al-Fe pillared clays in the Baeyer-Villiger oxidation[J].Clay Minerals,2012,47(2):275-284.
[11]LUO M L,BOWDEN D,BRIMBLECOMBE P.Catalytic property of Fe-Al pillared clay for Fenton oxidation of phenol by H2O2[J].Applied Catalysis(B:Environmental),2009,85(34):201-206.
[12]ZHOU S W,QIAN Z Y,SUN T,et al.Catalytic wet peroxide oxidation of phenol over Cu-Ni-Al hydrotalcite[J].Applied Clay Science,2011,53(4):627-633.
[13]ZHOU S W,GU C T,QIAN Z Y,et al.The activity and selectivity of catalytic peroxide oxidation of chlorophenols over Cu-Al hydrotalciteclay composite[J].Journal of Colloid and Interface Science,2011,357(2):447-452.
[14]ZHOU S W,ZHANG C B,HU X F,et al.Catalytic wet peroxide oxidation of 4-chlorophenol over Al-Fe-,Al-Cu-,and Al-Fe-Cu-pillared clays:sensitivity,kinetics and mechanism[J].Applied Clay Science,2014,95:275-283.
[15]MEI J G,YU S M,CHENG J.Heterogeneous catalytic wet peroxide oxidation of phenol over delaminated Fe-Ti-PILC employing microwave irradiation[J].Catalysis Communications,2004,5(8):437-440.
[16]LIOU R M,CHEN S H.CuO impregnated activated carbon for catalytic wet peroxide oxidation of phenol[J].Journal of Hazardous Materials,2009,172(1):498-506.
[17]NOGUEIRA R F P,OLIVEIRA M C,PATERLINI W C.Simple and fast spectrophotometric determination of H2O2in photo-Fenton reactions using metavanadate[J].Talanta,2005,66(1):86-91.
[18]HERNEY-RAMIREZA J,SILVA A M T,VICENTE M A,et al.Degradation of Acid Orange 7 using a saponite-based catalyst in wet hydrogen peroxide oxidation:kinetic study with the Fermi’s equation[J].Applied Catalysis(B:Environmental),2011,101(34):197-205.
[19]SILVA A M T,HERNEY-RAMIREZ J,SOYLEMEZ U,et al.A lumped kinetic model based on the Fermi’s equation applied to the catalytic wet hydrogen peroxide oxidation of Acid Orange 7[J].Applied Catalysis(B:Environmental),2012,121122:10-19.
[20]KWAN W P,VOELKER B M.Rates of hydroxyl radical generation and organic compound oxidation in mineral-catalyzed Fenton-like systems[J].Environmental Science & Technology,2003,37(6):1150-1158.
[21]HUANG C P,HUANG Y H.Comparison of catalytic decomposition of hydrogen peroxide and catalytic degradation of phenol by immobilized iron oxides[J].Applied Catalysis(A:General),2008,346(12):140-148.
[22]TATIBOUЁT J M,GUELOU E,FOURNIER J.Catalytic oxidation of phenol by hydrogen peroxide over a pillared clay containing iron:active species and pH effect[J].Topics in Catalysis,2005,33(1):225-232.
[23]ZHOU S W,ZHANG C B,XU R,et al.Chloride ions promoted the catalytic wet peroxide oxidation of phenol over clay-based catalysts[J].Water Science and Technology,2015.doi:10.2166wst.2015.571.
[24]VELEGRAKI T,NOULI E,KATSONI A,et al.Wet oxidation of benzoic acid catalyzed by cupric ions:key parameters affecting induction period and conversion[J].Applied Catalysis(B:Environmental),2011,101(34):479-485.
[25]AKYURTLU J F,AKYURTLU A,KOVENKLIOGLU S.Catalytic oxidation of phenol in aqueous solutions[J].Catalysis Today,1998,40(4):343-352.□郭晓娅,年跃刚,闫海红,等.淀粉废水资源化利用现状与应用前景[J].环境工程技术学报,2016,6(2): 117-126.
GUO X Y,NIAN Y G,YAN H H, et al.Current status and application prospect of resource utilization of starch wastewater[J].Journal of Environmental Engineering Technology,2016,6(2): 117-126.
中图分类号:X703.1
文章编号:1674-991X(2016)02-0111-06
doi:10.3969j.issn.1674-991X.2016.02.017
作者简介:周世伟(1975—),男,助理研究员,博士,主要从事环境化学研究,swzhou77@163.com*责任作者:徐明岗(1961—),男,研究员,博士,主要从事土壤化学研究,xuminggang@caas.cn
基金项目:国家自然科学基金项目(41271254)
收稿日期:2015-11-27

