氧化钙吸附剂的制备及CO2吸附性能
范莎莎,沈 辉,赵玉军,王胜平,马新宾
由于化石燃料的燃烧和工业废气的排放,导致二氧化碳的排放量逐渐增加,已经引起了很严重的全球气候问题。在过去的几十年,大气中二氧化碳浓度迅速增加[1-3]。二氧化碳的储存、补集及利用技术已经引起了研究者的广泛关注[4-6]。目前,用于二氧化碳分离的技术主要有吸附分离、膜分离、吸收分离等。其中用氧化钙作为吸附剂是分离高温二氧化碳的有效方法,具有很广泛的工业应用前景。
氧化钙作为高温吸附剂具有很多优势,如原材料广泛、价廉易得、吸附容量较高、吸附速率快等。但它同时也存在明显的缺点,主要是稳定性较差,随着循环次数的增加吸附容量下降较快,在应用过程中需经常更换新鲜的吸附剂,操作复杂导致成本变高,阻碍了氧化钙基吸附剂的工业应用[7-11]。为了提高氧化钙基吸附剂的稳定性,研究者们进行了很多探索和尝试,包括合成纳米氧化钙、掺杂惰性组分、用乙醇溶液改性等,取得了比较好的结果[12-14]。
碳球本身具有较强的亲水性且表面富含官能团,近年来被广泛用作催化剂载体和储能材料,同时碳球可以被当做模板来制备具有中空结构的材料[15-21]。本研究以葡萄糖水解得到的胶体碳球为模板,采用尿素水解法来制备具有中空结构的氧化钙小球,研究了碳球制备过程中水热时间、改性试剂和尿素水解过程中水解温度对吸附性能的影响。
1 实验部分
1.1 实验试剂
葡萄糖(C6H12O6),硝酸钙[Ca(NO)3·4H2O],尿素[CO(NH2)2],氢氧化钠(NaOH),分析纯,购买于天津市科密欧化学试剂有限公司。
1.2 吸附剂制备
1.2.1碳球制备
配制葡萄糖溶液,浓度为1 mol/L,取100 mL配制的葡萄糖溶液转入容积为150 mL的聚四氟乙烯晶化釜中。密封后将晶化釜放入烘箱中,160℃保持一定时间(6、8、10和12 h)。然后过滤得到棕色液体,并用乙醇和去离子水反复洗涤多次。将过滤后的物质放入烘箱中,80℃干燥后即可得胶体碳球。
1.2.2吸附剂制备
取0.2 g碳球加入到50 mL去离子水,超声分散20 min。加入0.01 mol硝酸钙,80℃水浴条件下搅拌预吸附3 h,接着向悬浮液中加入0.04 mol尿素,在一定温度下(80和120℃)搅拌24 h。然后对所得的悬浮液进行过滤洗涤,80℃干燥。将干燥后的棕色产物放入马弗炉焙烧,500℃焙烧2 h,即得尿素水解法制备的氧化钙基吸附剂。
1.3 吸附剂表征
采用日本日立公司的Hitachi S-4800型场发射扫描电子显微镜来对吸附剂的形貌及微观结构进行分析。扫描电镜是用背散射电子束或者二次电子进行成像,放大倍数100~800 K,加速电压0~30 kV。因为CaO材料导电性较差,在表征之前需在真空条件下对样品进行喷金处理(约90 s)。
1.4 吸附剂评价
采用德国耐驰公司STA449F3型热分析仪对吸附剂的二氧化碳吸附性能进行表征评价,样品装填量10 mg左右。600℃吸附45 min,700℃脱附20 min;吸附时二氧化碳体积分数为50%,脱附在氮气气氛下进行。升温速率与降温速率均为10℃/min。吸附容量以1 g吸附剂所吸附的CO2的质量计。
2 结果与讨论
2.1 不同水热时间对吸附性能的影响
水热时间的长短会影响碳球的形成,导致碳球粒径大小发生变化,影响最终制备出的吸附剂的颗粒大小,进而影响吸附性能。制备碳球时,考察5个不同的水热时间,分别为 4、6、8、10 和 12 h,对制备的碳球进行SEM的表征,如图1所示。水热时间为4 h时,基本没有产物生成。

图1 不同水热时间所得碳球的SEM图Fig.1 SEM images of the carbon sphere with different hydrothermal time
从图1中可以看出,水热时间为6和8 h时得到的碳球形貌较好,碳球以单个形态存在且大小相对比较均一。水热时间超过8 h时,碳球出现了明显的交联现象,尺寸变大。当水热时间达到12 h时,碳球之间的交联现象比较严重,基本不存在球状形貌。
对不同水热时间制备的碳球进行了粒径分布统计,以平均粒径大小代表,结果列于表1中。

表1 水热时间与碳球平均粒径大小的关系Table 1 The relation between hydrothermal time and mean diameter of the carbon sphere
从表1中可以看出,随着水热时间的延长,碳球平均粒径逐渐变大。水热时间为8 h及更短时,碳球粒径变化趋势较为平缓,超过8 h时碳球粒径突然增大。
以不同粒径大小的碳球为模板,采用尿素水解法制备吸附剂,并对其进行了15个循环的吸附性能评价,如图2和3所示。
图2给出了吸附剂15个循环的吸附曲线,从图2中可以看出每个循环脱附后得到的吸附剂质量基本相同,且在脱附阶段吸附剂质量随时间出现先降低后不变的变化趋势说明脱附完全。
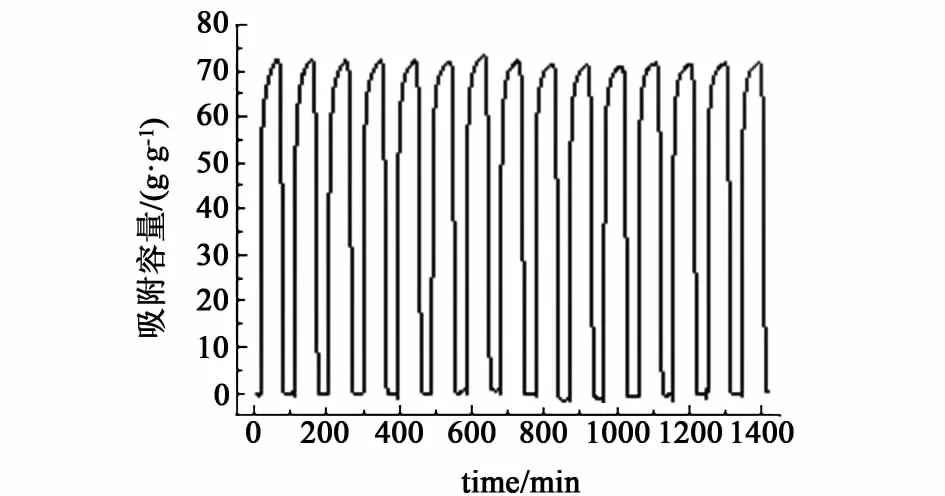
图2 水热6 h的吸附曲线Fig.2 Adsorption curve of sorbent(hydrothermal time 6 h)
图3表明以水热时间为6和8 h的碳球为模板得到的吸附剂稳定性较好,15个循环吸附容量基本没有降低。以水热时间为6 h的碳球为模板制备的吸附剂同时表现出了最高的吸附容量,初始吸附容量为74%,15个循环之后吸附容量仍然可以达到70%左右,因此在制备碳球时选择水热时间6 h为最适宜值。
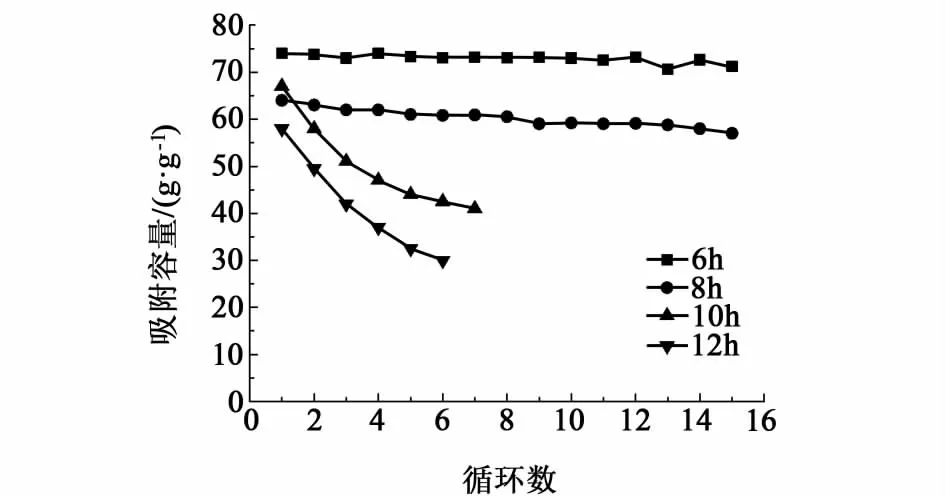
图3 水热时间对吸附性能的影响Fig.3 Effect of hydrothermal time on adsorption capacity
2.2 碳球改性对吸附性能的影响
分别使用氢氧化钠和氨水对水热时间为6 h的碳球进行改性,以改性后的碳球为模板制备吸附剂,图4给出了吸附剂的吸附性能曲线。
从图4中可以看出,3种吸附剂的初始吸附容量基本相同,都在74%左右,但是稳定性差别较大。未改性的吸附剂15个循环之后,吸附容量仍有约70%,但是碱液改性后的吸附剂15个循环之后吸附容量仅剩余约50%,稳定性远低于未改性的吸附剂。其中氨水改性得到的吸附剂前6个循环吸附容量下降不明显,从第7个循环开始显著下降;而氢氧化钠改性得到的吸附剂吸附容量一直呈现快速下降的趋势。为了探究碱改性造成稳定性下降的原因,对改性后的碳球做了SEM的表征,如图5所示。图5说明碱改性对碳球的形貌产生了较大的影响,破坏了原来的实心球结构呈现出块状颗粒的形貌,且有一定程度的烧结。其中氢氧化钠改性的碳球烧结情况比氨水改性的碳球严重,说明碱性越强,碳球烧结越厉害,吸附剂的稳定性也越差。
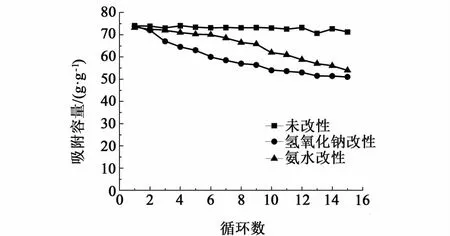
图4 碱改性对吸附性能的影响Fig.4 Effect of alkali modification on adsorption capacity

图5 氢氧化钠和氨水改性后的碳球形貌Fig.5 SEM images of the carbon sphere after modification of NaOH and NH 3·H 2O
2.3 尿素水解过程水解温度的影响
尿素水解程度和速度与水解时的温度有很大关系,温度越高,尿素水解速度越快。以水热时间为6 h、未进行碱改性的碳球作为模板,选择80和120℃作为尿素的不同水解温度,制备的吸附剂的吸附性能如图6所示。从图6中可以看出,两种水解温度得到的吸附剂初始吸附容量相差不大,但120℃水解得到的吸附剂的稳定性明显较差,吸附15个循环之后吸附容量降低到仅40%。
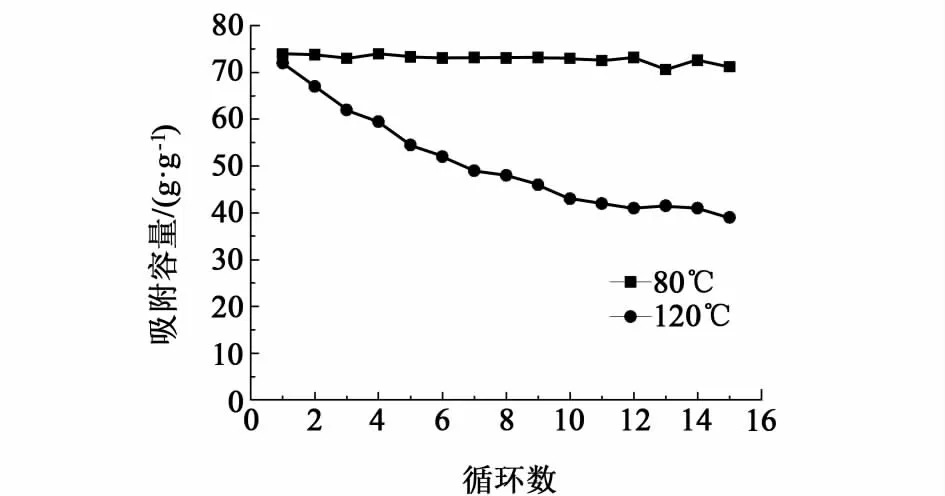
图6 不同尿素水解温度对吸附性能的影响Fig.6 Effect of hydrolysis temperature on adsorption capacity
3 结论
以胶体碳球为模板,通过尿素水解法成功制备了具有较好吸附容量和较高稳定性的氧化钙吸附剂。碳球模板和尿素水解温度对吸附剂的吸附性能影响较大,以水热时间为6 h未进行碱改性的碳球为模板,尿素水解时温度为80℃,此条件制备的吸附剂表现出了最优的吸附性能。初始吸附容量达到约74%,经历15个循环吸附容量降低不明显仍然可以达到70%。与石灰石等钙基原材料相比,吸附性能较高且稳定性良好,可以循环多次使用,简化了操作过程进而降低了成本。
参考文献:
[1]Wang S,Yan S,Ma X,et al.Recent advances in capture of carbon dioxide using alkali-metal-based oxides[J].Energ Environ Sci,2011,4(10):3 805-3 819
[2]Hsu H C,Shown I,Wei H,et al.Graphene oxide as a promising photocatalyst for CO2to methanol conversion[J].Nanoscale,2013,5(1):262-268
[3]Wang Q,Luo J,Zhong Z,et al.CO2capture by solid adsorbents and their applications:Current status and new trends[J].Energ Environ Sci,2011,4(1):42-55
[4]An C,Wang J,Jiang W,et al.Strongly visible-light responsive plasmonic shaped AgX:Ag(X=Cl,Br)nanoparticles for reductionof CO2tomethanol[J].Nanoscale,2012,4(18):5 646-5 650
[5]Liu W,An H,Qin C,et al.Performance enhancement of calcium oxide sorbents for cyclic CO2capture—A review[J].Energy & Fuels,2012,26(5):2 751-2 767
[6]Latempa T J,Rani S,Bao N,et al.Generation of fuel from CO2saturated liquids using a p-Si nanowire‖n-TiO2nanotube array photo electrochemical cell[J].Nanoscale,2012,4(7):2 245-2 250
[7]ValverdeJ M.Ca-Basedsyntheticmaterials with enhanced CO2capture efficiency[J].J Mater Chem A,2013,1(2):447-468
[8]Martinez I,Grasa G,Murillo R,et al.Evaluation of CO2carrying capacity of reactivated CaO by hydration[J].Energy & Fuels,2011,25(3):1 294-1 301
[9]AlonsoM, LorenzoM, GonzálezB, etal.Precalcination of CaCO3as a method to stabilize CaO performance for CO2capture from combustion gases[J].Energy& Fuels,2011,25(11):5 521-5 527
[10]Phalak N,Deshpande N,Fan L S.Investigation of hightemperature steam hydration of naturally derived calcium oxide for improved carbon dioxide capture capacity over multiple cycles[J].Energy & Fuels,2012,26(6):3 903-3 909
[11]王胜平,沈辉,范莎莎,等.固体二氧化碳吸附剂研究进展[J].化学工业与工程,2014,31(1):72-78
Wang Shengping, Shen Hui, Fan Shasha, et al.Research progress of solid adsorbents for CO2capture[J].Chemical Industry and Engineering,2014,31(1):72-78(in Chinese)
[12]Wang S,Shen H, Fan S, et al.Enhanced CO2adsorption capacity and stability using CaO-based adsorbents treated by hydration[J].AIChE Journal,2013,59(10):3 586-3 593
[13]Li Y,Zhao C,Qu C,et al.CO2capture using CaO modified with ethanol/water solution during cyclic calcination/carbonation[J].Chemical Engineering & Technology,2008,31(2):237-244
[14]Al-Jeboori M J,Fennell P S,Nguyen M,et al.Effects of different dopants and doping procedures on the reactivity of CaO-based sorbents for CO2capture[J].Energy& Fuels,2012,26(11):6 584-6 594
[15]Hu J,Chen M,Fang X,et al.Fabrication and application of inorganic hollow spheres[J].Chem Soc Rev,2011,40(11):5 472-5 491
[16]Sun X,Li Y.Ga2O3and GaN semiconductor hollow spheres[J].Angew Chem Int Ed,2004,43(29):3 827-3 831
[17]Deshmukh A A,Mhlanga S D,Coville N J.Carbon spheres[J].Mater Sci Eng R-Rep Sep,2010,70(1/2):1-28
[18]Yu J,Yu X,Huang B,et al.Hydrothermal synthesis and visible-light photocatalytic activity of novel cage-like ferric oxide hollow spheres[J].Cryst Growth Des,2009,9(3):1 474-1 480
[19]Guo C, HuP, YuL, et al. Synthesisand characterization of ZrO2hollow spheres[J].Mater Lett,2009,63(12):1 013-1 015
[20]Qian H,Lin G,Zhang Y,et al.A new approach to synthesize uniform metal oxide hollow nanospheres via controlled precipitation[J].Nanotechnology,2007,18(35):1 366-1 370
[21]Jia G,Yang M,Song Y,et al.General and facile method to prepare uniform Y2O3:Eu hollow microspheres[J].Cryst Growth Des,2008,9(1):301-307

