表皮葡萄球菌生物膜形成与细菌耐药性的相关性分析
叶杨芹,包裕杰,马 珂,张雯雁,奚 婷,陈芳莹,宗 明,范列英
(上海市东方医院/同济大学附属东方医院检验科,上海 200120)
·论著·
表皮葡萄球菌生物膜形成与细菌耐药性的相关性分析
叶杨芹,包裕杰,马珂,张雯雁,奚婷,陈芳莹,宗明,范列英
(上海市东方医院/同济大学附属东方医院检验科,上海 200120)
摘要:目的探讨表皮葡萄球菌临床分离株生物膜的形成情况,分析其生物膜形成与细菌耐药性的相关性。方法收集2014年1月至2015年2月住院患者血标本分离出的表皮葡萄球菌62株,采用生物膜形成试验和聚合酶链式反应(PCR)扩增试验检测细菌生物膜,并采用纸片扩散法(K-B法)进行细菌药物敏感性试验。结果利用生物膜形成试验检出生物膜阳性菌株23株,检出率为37.1%;PCR扩增试验检出icaA基因27株,检出率为43.5%,差异无统计学意义(P>0.05);两种方法同时阳性的菌株为14株。生物膜阳性菌株对所测抗菌药物的耐药率普遍高于生物膜阴性菌株,其中对庆大霉素、青霉素G、苯唑西林、左旋氧氟沙星、头孢西丁的耐药率比较差异有统计学意义(P<0.05),所有菌株对万古霉素、利奈唑胺、奎奴普丁/达福普汀均敏感。结论两种方法对表皮葡萄球菌生物膜的检出率无明显差异,生物膜阳性菌株耐药率普遍高于生物膜阴性菌株。
关键词:表皮葡萄球菌;生物膜;耐药性;ica操纵子
表皮葡萄球菌是一类凝固酶阴性的革兰阳性球菌,是寄生于人体的正常菌群之一,属于条件致病菌。近年来,随着多种插管、透析技术、人工心瓣膜、人工晶体、人工关节等侵入性医疗材料的使用,表皮葡萄球菌已经成为医院感染的主要病原菌之一。表皮葡萄球菌容易黏附于异物表面,形成细菌生物膜,增加临床治疗难度,造成严重危害[1]。本研究以引起血流感染的表皮葡萄球菌为研究对象,利用生物膜形成实验及分子生物学方法筛选生物膜阳性细菌,并进一步分析表皮葡萄球菌对抗菌药物的耐药特征,以期更好地了解表皮葡萄球菌耐药性与生物膜形成的相关性,为指导临床有效地预防及控制表皮葡萄球菌感染奠定基础。
1材料与方法
1.1菌株来源收集本院2014年1月至2015年2月住院患者血液标本分离得到的表皮葡萄球菌62株(单瓶血培养瓶阳性检出视为污染菌,不作为实验用菌株)。以表皮葡萄球菌ATCC12228(SE ATCC12228)为生物膜形成的阴性对照株,以金黄色葡萄球菌ATCC25923为药敏质控菌株及icaA阴性对照菌株。
1.2仪器与试剂Micro-Scan Walkaway-96 全自动微生物鉴定系统(德国西门子公司),ABI-7000荧光定量聚合酶链式反应(PCR)分析仪(美国应用生物系统公司),Tanon-2500凝胶成像系统(上海天能公司),Biotek-Elx808U酶标仪(美国伯滕仪器有限公司)。PCR反应所需试剂及引物购自美国 Invitrogen公司;LB肉汤、结晶紫、Bouin固定液、琼脂糖均为国产分析纯;抗菌药物纸片购自英国Oxoid公司;血琼脂平板、M-H琼脂平板购自北京赛默飞世尔有限公司。
1.3方法

1.3.2PCR扩增检测icaA基因(1)表皮葡萄球菌基因组DNA的提取:将临床分离的表皮葡萄球菌及指控菌株接种于血平板上,35 ℃培养过夜。用接种环取适量菌于300 μL无菌生理盐水中,充分混匀后12 000 r/min离心5 min,去上清。在上清中加入300 μL无菌水,充分混匀,煮沸15 min,12 000 r/min离心5 min,留上清。(2)PCR扩增检测icaA基因:通过PCR的方法特异性扩增icaA 基因。50 μL PCR扩增体系:25 mmol/L氯化镁(MgCl2)3 μL,10 mmol/L三磷酸脱氧核糖核苷(dNTP)1 μL,Taq DNA聚合酶(5 U/μL,0.5 μL),10×PCR(25 mmol/L,5 μL),上游引物5′-GAT GGG CTC AAG GCG GGC AT-3′(50 pmol/L,1 μL),下游引物5′-GAT GGG CTC AAG GCG GGC AT-3′(50 pmol/L,1 μL),DNA模板5 μL。PCR反应扩增条件:94 ℃ 5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,共30个循环,72 ℃ 5 min。(3)PCR扩增产物的分析:1%琼脂糖凝胶于1×TAE缓冲液,用0.5 μg/mL溴化乙锭染色,150 V电压下电泳约30 min,将PCR扩增所得特异性片段克隆测序,并在MegaBlast上进行基因序列比对。
1.3.3药敏试验采用纸片扩散法(K-B法)对所有表皮葡萄球菌临床分离株及质控菌株做药物敏感性试验,结果按照美国临床实验室标准化协会(CLSI )2013版判断标准执行[3]。
1.4统计学处理采用WHONET5.6软件进行细菌耐药性分析。采用SAS6.12软件进行数据处理与统计分析,计数资料以例数或百分率表示,采用χ2检验进行比较分析,P<0.05为差异有统计学意义。
2结果
2.1半定量黏附试验结果利用生物膜形成实验检出生物膜阳性菌株23株,检出率为37.1%,部分结果见图1(见《国际检验医学杂志》网站主页“论文附件”)。
2.2PCR扩增结果62株表皮葡萄球菌临床分离株中有27株检出icaA,检出率为43.5%,特异性片段长度在300~400 bp之间,见图2。将PCR扩增得到特异性片段克隆测序,得到片段长度为386 bp,经与GeneBank比对为icaA基因。
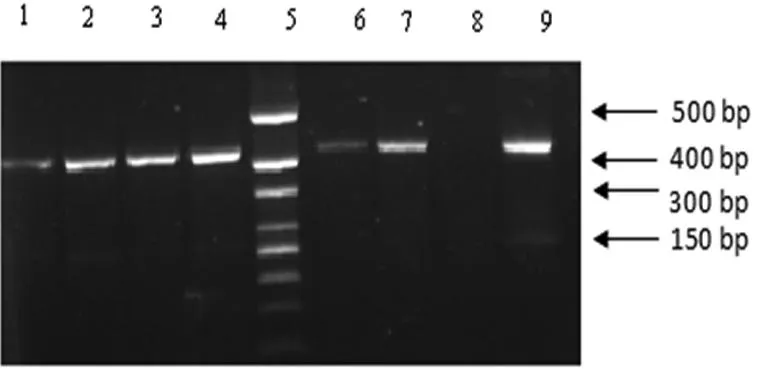
泳道1~4、6、7、9:表皮葡萄球菌临床分离株;泳道8:金黄色葡萄球菌ATCC25923;泳道5:DL500 ladder。
图2PCR扩增结果
2.3两种方法检测生物膜的结果比较ica基因检测与半定量黏附试验检测菌株生物膜阳性率比较,差异无统计学意义(χ2=0.41,P>0.05)。见表1。
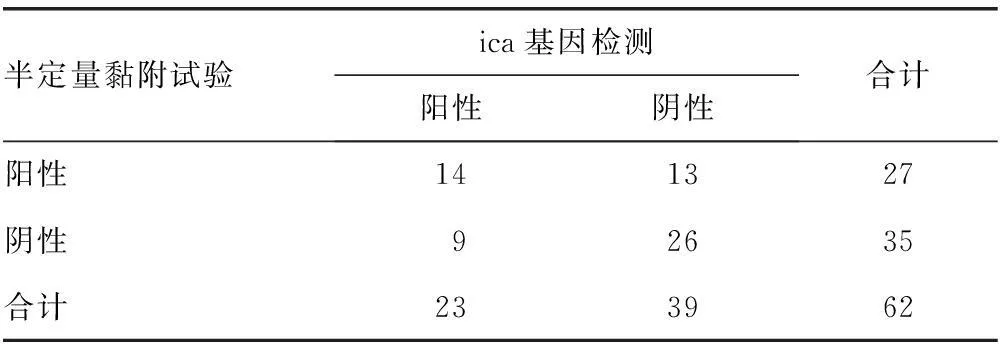
表1 两种方法检测生物膜的结果比较(n)
2.4药敏试验结果生物膜阳性菌株与生物膜阴性菌株对庆大霉素、青霉素G、苯唑西林、左旋氧氟沙星、头孢西丁的耐药率比较,差异有统计学意义(P<0.05);对其余检测药物的耐性比较,差异无统计学意义(P>0.05)。见表2。
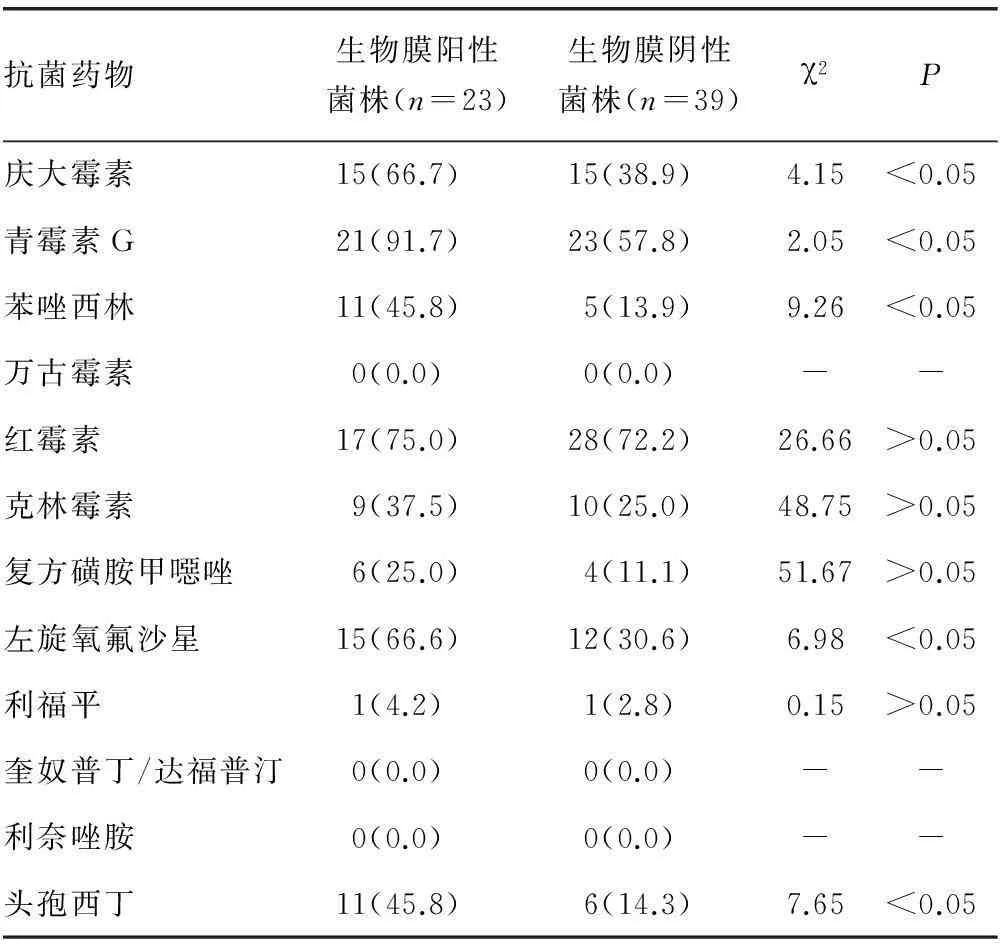
表2 表皮葡萄球菌临床分离株细菌耐药性比较[n(%)]
-:无数据。
3讨论
生物膜具有保护细菌、对抗抗菌药物、促进细菌逃避机体免疫系统的作用,使细菌对抗菌药物和机体免疫力的抵抗能力大大增强,出现耐药,甚至多重耐药,为临床预防及治疗细菌感染带来巨大的挑战。因此,正确认识表皮葡萄球菌的生物膜及其形成机制和相关因子的调控,将对临床防治起到有效的指导作用。
3.1表皮葡萄球菌生物膜形成能力分析表皮葡萄球菌形成生物膜除了受周围环境的影响外,还受到自身遗传基因的调控。多糖胞间黏附素(PIA)是表皮葡萄球菌生物膜形成的必需成分[4-8],表皮葡萄球菌可产生大量PIA。目前,明确的是PIA合成的基础为ica基因,ica基因位点包含一个操纵子结构icaADBC,4个基因序列依次排列,其中icaD基因位于icaA和icaB基因之间,且与二者有部分重叠。国内邢铭友等[9]研究发现表皮葡萄球菌ica操纵子的存在与生物膜表型密切相关,PIA的合成是生物膜形成的关键环节。
本研究利用生物膜形成试验(半定量黏附试验)检测出的生物膜阳性菌株为23株,检出率为37.1%。;而利用PCR扩增icaA基因检测生物膜测得阳性菌株27株,检出率为43.5%。基因检测的检出率略高于生物膜形成试验,但经统计学分析两种方法检出率比较差异无统计学意义(P>0.05)。有13株菌株icaA基因检测阳性,而生物膜形成试验结果为阴性。初步认为可能的原因有以下两种:(1)检测到icaA 基因可能由于某种缺失或抑制等原因得不到充分的表达或完全没有表达,因而无法形成生物膜;(2)本试验中检测的ica基因为icaA基因型,并没有对icaD、icaC、icaB基因型进行检测,而icaA、icaD和icaC这3个基因型,任何缺失或突变都有可能影响生物膜的形成,因此,所测菌株可能由于缺失或突变等原因不表达或弱表达icaD、icaC、icaB基因而无法形成生物膜。此外,icaA、icaD、icaB、icaC基因的表达还受其他生物因子(如SigB因子、RsbU因子)及环境因子(氯化钠、乙醇)的影响[10]。确切原因涉及表皮葡萄球菌生物膜的基因调控等多方面因素,机制较为复杂,需要进一步学习、研究。本研究结果中还有9株菌株为生物膜形成试验阳性而基因检测结果为阴性。其原因可能是表皮葡萄球菌生物膜的形成受到除受icaA、icaD、icaB、icaC调控外,还受到其他调控机制的影响,值得深入探讨[11-12]。
3.2表皮葡萄球菌生物膜形成与细菌耐药性的相关性生物膜阳性菌株对庆大霉素、青霉素G、红霉素、左旋氧氟沙星的耐药率均在65%以上,而对苯唑西林、克林霉素、头孢西丁的耐药率在50%以下。对复方磺胺甲噁唑和利福平也存在一定程度的耐药。生物膜阴性菌株耐药率整体低于生物膜阳性菌株,其中对庆大霉素、青霉素G、苯唑西林、左旋氧氟沙星、头孢西丁的耐药率比较差异有统计学意义(P<0.05),提示生物膜阳性细菌对上述抗菌药物的耐药性更明显。随着细菌的生长繁殖及抗菌药物的使用,敏感菌群受到抑制,而耐药菌得到优势生长,细菌形成生物膜后定植在体内,难以清除,而生物膜又极大地限制了抗菌药物的作用效果,增加了临床治疗难度。此外,未发现对万古霉素、奎奴普丁/达福普汀和利奈唑胺耐药的菌株。
综上所述,本研究发现表皮葡萄球菌临床分离株有一定的生物膜形成能力,因本次试验所用菌株分离自住院患者血液,分析生物膜形成可能与细菌从皮肤定植部位入侵或静脉留置针使用增加定植黏附风险等有关。形成生物膜的菌株较生物膜阴性菌株耐药率高,提示应该采取有效手段消毒灭菌,降低生物膜形成率,减少医疗及经济负担。
参考文献
[1]Wojtyczka RD,Orlewska K,Kepa M,et al.Biofilm formation and antimicrobial susceptibility of Staphylococcus epidermidis strains from a hospital environment[J].Int J Environ Res Public Health,2014,11(5):4619-4633.
[2]Christensen GD,Simpson WA,Younger JJ,et al.Adherence of coagulase-negative staphylococci to plastic tissue culture plates:a quantitative model for the adherence of staphylococci to medical devices[J].J Clin Microbiol,1985,22(6):996-1006.
[3]Clinical Laboratory Standards Institute.M100-S23 Performance standards for antimicrobial susceptibility testing[S].Wayne,PA,USA:CLSI,2013.
[4]Cue D,Lei MG,Lee CY.Genetic regulation of the intercellular adhesion locus in staphylococci[J].Front Cell Infect Microbiol,2012,2(1):38.
[5]Yu D,Zhao L,Xue T,et al.Staphylococcus aureus autoinducer-2 quorum sensing decreases biofilm formation in an icaR dependent manner[J].BMC Microbiol,2012,12(4):1-12.
[6]Ziebuhr W,Dietrich K,Trautmann M,et al.Chromosomal rearrangements affecting biofilm production and antibiotic resistance in a Staphylococcus epidermidis strain causing shunt-associated ventriculitis[J].Int J Med Microbiol,2000,290(1):115-120.
[7]Arciola CR,Campoccia D,Ravaioli S,et al.Polysaccharide intercellular adhesin in biofilm:structural and regulatory aspects[J].Front Cell Infect Microbiol,2015(5):7.
[8]Solati SM,Tajbakhsh E,Khamesipour F,et al.Prevalence of virulence genes of biofilm producing strains of Staphylococcus epidermidis isolated from clinical samples in Iran[J].AMB Express,2015,5(1):134.
[9]邢铭友,刘莉娜,宋世会,等.表皮葡萄球菌ica操纵子与细胞间多糖黏附素及生物膜表型的相关性[J].华中科技大学学报:医学版,2008,37(4):449-452.
[10]Luther MK,Bilida S,Mermel LA,et al.Ethanol and isopropyl alcohol exposure increases biofilm formation in Staphylococcus aureus and Staphylococcus epidermidis[J].Infect Dis Ther,2015,4(2):219-226.
[11]Salaberry SR,Saidenberg AB,Zuniga E,et al.Virulence factors genes of Staphylococcus spp.isolated from caprine subclinical mastitis[J].Microb Pathog,2015(85):35-39.
[12]Büttner H,Mack D,Rohde H.Structural basis of Staphylococcus epidermidis biofilm formation:mechanisms and molecular interactions[J].Front Cell Infect Microbiol,2015(5):14.
Analysis on correlation between biofilm formation and bacterial resistance in Staphylococcus epidermidis
YeYangqin,BaoYujie,MaKe,ZhangWenyan,XiTing,ChenFangying,ZongMing,FanLieying
(DepartmentofClinicalLaboratory,ShanghaiEastHospital/EastHospitalAffiliatedtoTongjiUniversity,Shanghai200120,China)
Abstract:ObjectiveTo investigate the formation of biofilm in clinical isolates of Staphylococcus epidermidis,and to analyse the correlation between biofilm formation and antibacterial resistance of Staphylococcus epidermidis.MethodsA total of 62 strains of Staphylococcus epidermidis isolated from blood specimens of inpatients with bloodstream infection,from January 2014 to February 2015,were collected.The biofilm formation of Staphylococcus epidermidis was detected by using the semi-quantitative adherence assay and polymerase chain reaction(PCR) amplification experiment.The antibacterial susceptibility test was carried out according to K-B method.ResultsThe positive rate of biofilm formation detected by using the semi-quantitative adherence assay and PCR for icaA gene were 37.1%(23 strains) and 43.5%(27 strains) respectively,and there was no statistically significant difference(P>0.05).There were 14 positive strains detected by both methods.The resistance rates of strains producing biofilm to antibacterial agents were generally higher than those of non-producing biofilm strains,and there were statistically significant differences in resistance rates of strains to gentamicin,penicillin,oxacillin,levofloxacin and cefoxitin(P<0.05).All bacteria were sensitive to vancomycin,linezolid and quinupristin/dalfopristin.ConclusionThere is no significant difference between the two methods in detecing biofilm formation.The resistance rates of strains producing biofilm to antibacterial agents were generally higher than those of non-producing biofilm strains.
Key words:Staphylococcus epidermidis;biofilm;drug resistance;ica operon
(收稿日期:2015-09-26)
DOI:10.3969/j.issn.1673-4130.2016.05.016
文献标识码:A
文章编号:1673-4130(2016)05-0618-03
作者简介:叶杨芹,女,主管检验技师,主要从事临床微生物学与检验研究。

