Ro52表达水平下降与系统性红斑狼疮患者B细胞异常激活的相关性
万姝岑,周 炜
(北京大学第一医院风湿免疫科, 北京 100034)
ChinJAllergyClinImmunol,2016,10(3):219- 224
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多系统的自身免疫性疾病,B细胞过度活化、增殖,产生多种自身抗体是疾病发生的重要机制之一[1]。
Ro52是可提取核抗原(extracted nuclear antigens,ENA)的一种,是抗干燥综合征A针对的自身抗原之一,因在N端含有RING锌指-B盒-卷曲螺旋三个结构域(RING finger domain,B-box domain,coiled coil domain)组成的基序,是三基序(tripartite motif,TRIM)蛋白家族的一员,被称为TRIM21[2- 3]。抗Ro52与皮肤损害和新生儿心脏传导阻滞相关[4- 5]。研究表明Ro52具有E3泛素连接酶活性,并参与细胞增殖的调控[6]。泛素是保守的含有76个氨基酸的小蛋白,真核细胞通过泛素激活酶(E1)、泛素结合酶(E2)以及泛素连接酶(E3)将泛素连接到特定蛋白质上的过程被称为泛素化,是重要的蛋白翻译后修饰。泛素化不但是细胞内蛋白通过蛋白酶体降解的信号,也是调控蛋白定位与功能的重要机制之一,参与了淋巴细胞的激活、免疫耐受诱导等多种免疫反应过程,泛素连接酶的功能异常可以造成自身免疫性疾病的异常免疫反应[7- 8]。
作为泛素连接酶,Ro52有可能参与免疫反应的调控。在小鼠B细胞系中过度表达Ro52可抑制淋巴细胞增殖,并在CD40激活时增加细胞的凋亡[6]。为进一步探讨Ro52是否参与了SLE患者B淋巴细胞的异常激活,我们通过CD40与B细胞受体信号通路激活SLE患者和健康对照外周血单个核细胞中的B淋巴细胞并检测Ro52表达水平。
材料与方法
对象
选择北京大学第一医院风湿免疫科随访的14例SLE患者,符合美国风湿协会诊断标准[9],男性1例,女性13例,平均年龄(53±27)岁;10名健康的医务人员作为对照,包括男性1名,女性9名,平均年龄(45±17)岁,与患者年龄差异无统计学意义。本研究得到北京大学第一医院伦理委员会批准,患者签署了知情同意书。
使用淋巴细胞分离液(天津灏洋生物技术公司)通过密度梯度离心分离外周血单个核细胞。在平底96孔板培养新鲜分离的细胞,每孔150 000个细胞,培养基为含5%胎牛血清的RPMI- 1640,其中含青霉素100 U/ml,链霉素100 μg/ml,2 nmol/L L-谷氨酰胺。使用抗IgM(Jackson Immuno Research)2.5 μg/ml和0.5 μg/ml+抗CD40(abcam B-B20 ab47021)0.2 μg/ml,抗IgG(Jackson ImmunoResearch)2.5 μg/ml和0.5 μg/ml+抗CD40 0.2 μg/ml刺激B细胞受体诱导B细胞增殖;另外还用美洲商陆有丝分裂原(pokeweed mitogen,PWM)1和0.2 μg/ml以及单独的抗CD40 1和0.2 μg/ml刺激B细胞增殖,培养5 d。
细胞周期测定
细胞周期检测使用碘化丙啶(propidium iodide,PI)染色流式细胞仪分析。每例患者每个刺激条件收集3个培养孔的细胞,合并后用1 ml PBS洗两次,分出0.2 ml 细胞进行定量PCR。在1 ml 80%预冷乙醇重悬细胞,加入0.5 ml PI/RNase染色液(BD Pharmingen 550825),4 ℃避光孵育1 h,用PBS洗两次后上流式细胞仪进行细胞周期分析。G1代表细胞处于静止状态,S+G2/M期细胞代表细胞处于增殖状态。
Ro52的定量RT-PCR
培养细胞提取总RNA,通过随机引物法反转录为cDNA,使用SYBR Green PCR Kit(Qiagen)试剂盒,ABI PRISM 7700 Sequence Detection System(Applied Biosystem)进行定量PCR。Ro52扩增引物,上游5′-GAACTGCTGCAGGAGGTGATAA-3′,下游5′-AGTTCT GGAGAGGTAATATCCAGGTC-3′;GAPDH扩增引物,上游5′-AGGGCTGCTTTTAACTCTGGTAAA-3′,下游5′-CATATTGGAACATGTAAACCATGTAGTTG-3′[6]。Ro52与内参GAPDH的比值为Ro52的相对表达水平。
统计学处理
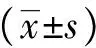
结 果
SLE患者B细胞受刺激后增殖水平与健康对照比较
1.6 疗效标准 临床症候观察项目为:气促、发热、咳嗽。参照卫生部制定的《中药新药临床研究指导原则》和国家中医药管理局制定的《中医病证诊断疗效标准》及相关文献进行检索[5-6],将主要症状按轻重程度分为4级,以3分制积分:正常为0分,轻度为1分,中度为2分,重度为3分。
细胞周期分析发现,SLE患者外周血单个核细胞未经刺激培养5 d后,S期和G2/M期细胞为3.0%±1.0%,显著高于健康对照的1.8%±0.7%,差异具有统计学意义(P<0.05)。在抗CD40(1 μg/ml),抗IgM(2.5 μg/ml)+抗CD40(0.2 μg/ml)以及小剂量抗IgG(0.5 μg/ml)+抗CD40(0.2 μg/ml)刺激诱导B细胞活化后,SLE患者细胞培养第5天检测S期和G2/M期细胞分别为3.6%±0.7%,7.9%±2.5%及5.1%±1.3%,显著高于健康对照(2.4%±0.6%,3.7%±1.3%及2.7%±0.5%,P<0.05)(图1)。
SLE患者Ro52表达水平与健康对照比较
SLE患者B细胞激活后增殖水平显著高于对照,相反在未经刺激培养5 d的外周血单个核细胞以及PWM,抗CD40,抗IgM+抗CD40和抗IgG+抗CD40诱导B细胞增殖的细胞中,SLE患者Ro52表达水平均显著低于健康对照(图2)。
Ro52表达水平与B细胞激活后增殖细胞的数量关系
SLE患者与健康对照在B细胞激活后检测Ro52表达水平与增殖细胞数呈现负相关的趋势。将PWM、抗CD40、抗IgM+抗CD40以及抗IgG+抗CD40刺激细胞后S+G2/M细胞百分数与Ro52表达水平呈负相关,相关系数r分别为-0.42,-0.25,-0.49,-0.40,P均<0.05,显示增殖细胞中Ro52表达水平下调(图3)。
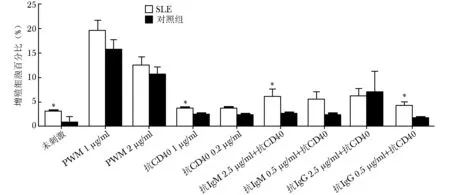
图1SLE患者B细胞增殖水平高于对照
Fig1B cell proliferation level of SLE patients was higher than that of healthy controls
经过抗CD40,抗IgM+抗CD40以及抗IgG+抗CD40刺激B细胞增殖后,SLE患者增殖细胞百分比显著高于对照组,*P<0.05
抗CD40激活SLE患者B细胞使Ro52表达下降与健康对照比较
SLE患者与健康对照在B细胞激活后Ro52 表达水平均下降,大剂量(1 μg/ml)抗CD40激活B细胞时,SLE患者较健康对照出现更加显著的Ro52表达下降(0.62±0.1vs. 1.04±0.2,P=0.04);其他刺激造成B细胞激活后Ro52下降的程度,SLE患者与健康对照差异无统计学意义(图4)。
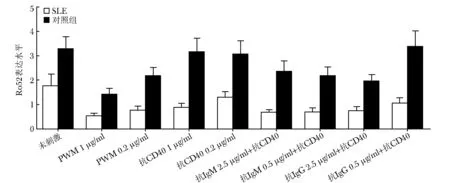
图2SLE患者Ro52表达水平低于健康对照
Fig2Ro52 expression level of SLE patients was lower than that of healthy controls
SLE患者未经刺激的外周血单个核细胞以及PWM,抗CD40,抗IgM+抗CD40或抗IgG+抗CD40刺激B细胞增殖后,Ro52表达水平显著低于健康对照,均P<0.05

图3Ro52表达水平与B细胞激活后增殖细胞的数量相关性分析
Fig3Correlation analysis of Ro52 expression level and proliferating cell number after B cells were activated
当PWM,抗CD40,抗IgM+抗CD40以及抗IgG+抗CD40刺激B细胞增殖后,增殖细胞百分比(%)与Ro52表达水平呈现负相关的趋势,相关系数分别为-0.42,-0.25,-0.49,-0.40,P<0.05
讨 论
实验选择使用的抗CD40可以产生类似CD40配体的作用,单独或联合抗IgG/抗IgM激活B细胞受体,可诱导B细胞活化。PWM的特异性稍差,但主要作用是诱导B细胞增殖。本研究发现,SLE患者B细胞激活后增殖细胞数量显著高于健康对照,而在激活的细胞中Ro52表达水平显著低于对照。Ro52表达水平与增殖细胞数量呈负相关,SLE患者的B细胞在CD40被激活后Ro52表达水平的下降程度显著高于健康对照。研究结果提示CD40信号通路活化使Ro52表达下调可能参与了SLE患者B细胞的异常活化。

图4抗CD40激活B细胞后,SLE患者Ro52表达水平的下降显著高于对照
Fig4After B cells were activated by anti-CD40, the expression level of Ro52 in SLE patients decreased more significantly than that of healthy controls
Ro52基因敲除小鼠出现严重皮炎,伴高球蛋白血症和抗核抗体的出现,提示Ro52有重要的免疫调控作用[10]。Ro52在B细胞系A20中过度表达会导致细胞生长变慢并增加细胞凋亡,提示Ro52具有抑制B细胞活化的作用[6]。有研究发现,Ro52依赖E3泛素连接酶活性,通过泛素化途径调控p27与Bcl- 2的活性来调控细胞增殖[11]和凋亡[12]。提示本研究发现的增殖细胞中Ro52表达水平的下调可能是SLE患者B细胞增殖水平增高的调控机制之一。
CD40信号通路的激活在B细胞增殖、分化中发挥重要作用[13- 14]。而CD40信号通路的异常也参与了SLE的发病[15],也有研究试图抑制CD40信号传导治疗SLE[16]。本研究发现刺激CD40可以在SLE患者B细胞更加显著地抑制Ro52表达,因此CD40激活-Ro52表达下调-B细胞增殖增加,这个调控机制在SLE发病中的作用值得进一步研究。
SLE患者B细胞激活水平显著高于健康对照,Ro52表达水平与B细胞的增殖水平呈负相关,抗CD40激活SLE患者B细胞后Ro52表达下调更加显著,提示Ro52可能参与了SLE 患者B细胞异常激活的调控。Ro52调控SLE患者B细胞异常激活的机制值得进一步研究。
[1]Kotzin BL. Systemic lupus erythematosus[J]. Cell,1996,85:303- 306.
[2]Wahren-Herlenius M, Muller S, Isenberg D. Analysis of B-cell epitopes of the Ro/SS-A autoantigen[J]. Immunol Today,1999,20:234- 240.
[3]Chan EK,Hamel JC, Buyon JP, et al. Molecular definition and sequence motifs of the 52-kD component of human SS-A/Ro autoantigen[J]. J Clin Invest, 1991, 87:68- 76.
[4]Salomonsson S. A serologic marker for fetal risk of congenital heart block[J]. Arthritis Rheum, 2002,46:1233- 1241.
[5]Mond CB, Peterson MG,Rothfield NF. Correlation of anti-Ro antibody with photosensitivity rash in systemic lupus erythematosus patients[J]. Arthritis Rheum, 1989,32:202- 204.
[6]Espinosa A. The Sjogren’s syndrome-associated auto-antigen Ro52 is an E3 ligase that regulates proliferation and cell death[J]. J Immunol, 2006,176:6277- 6285.
[7]Lutz-Nicoladoni C, Wolf D,Sopper S. Modulation of immune cell functions by the E3 ligase Cbl-b[J]. Front Oncol, 2015,5:58.
[8]Park Y, Jin HS, Aki D, et al. The ubiquitin system in immune regulation[J]. Adv Immunol, 2014,124:17- 66.
[9]Tan EM. The 1982 revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum, 1982,25:1271- 1277.
[10] Espinosa A. Loss of the lupus autoantigen Ro52/Trim21 induces tissue inflammation and systemic autoimmunity by disregulating the IL- 23-Th17 pathway[J]. J Exp Med,2009, 206:1661- 1671.
[11] Sabile A. Regulation of p27 degradation and S-phase progression by Ro52 RING finger protein[J]. Mol Cell Biol,2006, 26: 5994- 6004.
[12] Jauharoh SN. SS-A/Ro52 promotes apoptosis by regulating Bcl- 2 production[J]. Biochem Biophys Res Commun, 2012,417:582- 587.
[13] Bishop GA, Hostager BS. The CD40-CD154 interaction in B cell-T cell liaisons[J]. Cytokine Growth Factor Rev, 2003, 14:297- 309.
[14] Homig-Holzel C. Constitutive CD40 signaling in B cells selectively activates the noncanonical NF-kappaB pathway and promotes lymphomagenesis[J]. J Exp Med, 2008, 205:1317- 1329.
[15] de Sanctis JB, Garmendia JV, Chaurio R, et al. Total and biologically active CD154 in patients with SLE[J]. Autoimmunity,2009, 42:263- 265.
[16] Davis JC Jr, Totoritis MC, Rosenberg J, et al. Phase Ⅰ clinical trial of a monoclonal antibody against CD40-ligand (IDEC- 131) in patients with systemic lupus erythematosus[J]. J Rheumatol, 2001, 28:95- 101.

