基于线粒体凋亡途径探讨纳达合剂的胃黏膜保护作用机制*
李 勇,阙任烨,沈艳婷,林柳兵,陶智会,钱春美
(1.上海中医药大学附属市中医医院脾胃病科,上海 200071; 2.上海中医药大学附属市中医医院实验中心,上海 200071)
基于线粒体凋亡途径探讨纳达合剂的胃黏膜保护作用机制*
李 勇1,阙任烨1,沈艳婷1,林柳兵1,陶智会1,钱春美2
(1.上海中医药大学附属市中医医院脾胃病科,上海 200071; 2.上海中医药大学附属市中医医院实验中心,上海 200071)
目的:本实验旨在观察纳达合剂对胆汁反流性胃炎大鼠胃黏膜保护作用的分子机制。方法:利用大鼠胆汁反流性胃炎模型,将60只大鼠按随机数字表法分为对照组、模型组、纳达低、中、高剂量组和麦滋林组各10只。通过HE染色观察大鼠胃黏膜病理变化,JC-1染色检测线粒体膜电位变化,化学发光法检测胃黏膜ATP含量变化,Tunel法检测胃黏膜上皮细胞凋亡情况,Western blotting方法检测胃黏膜Bax、p-Bcl-2、Bcl-2、caspase-3、cleaved-caspase-3、caspase-9、cleaved-caspase-9片段的表达。结果:纳达合剂可显著保护大鼠胃黏膜受损,并能显著提高胃黏膜ATP含量,虽能使线粒体膜电位水平有所升高,但差异无统计学意义。纳达合剂能够显著减少胃黏膜上皮细胞凋亡率,提高胃黏膜p-Bcl-2的表达,降低Bax、cleaved-caspase-3、cleaved-caspase-9的表达,且p-Bcl-2/Bax比值显著增加。结论:纳达合剂保护胃黏膜的作用可能与其抑制线粒体凋亡途径有关。
纳达合剂;胆汁反流性胃炎;线粒体凋亡途径
胆汁反流性胃炎(bile reflux gastritis,BRG)是由于多种原因导致十二指肠胃反流(duodenogastricreflux,DGR)现象异常增多,引起胃黏膜损伤的一种疾病[1-2]。
DGR作为一种存在于机体内的常见生理现象,其发生及反流量与胃十二指肠动力异常以及幽门括约肌功能失常密切相关[3]。当幽门括约肌功能异常,出现关闭不全时,十二指肠胃反流增加,其内容物与胃黏膜长时间接触,最终导致胃黏膜损伤的发生,随着病情的持续和进展,引起胃黏膜的慢性炎症、糜烂,更有甚者可以进展为胃溃疡[4-5]。
纳达合剂是上海中医药大学附属市中医医院余莉芳老中医临床经验方,1995年开发为院内制剂。本方功效为养阴清胃、降逆理气,临床应用于慢性浅表性胃炎、BRG、非溃疡性消化不良等疾病。大量的临床实践证明,其具有良好的治疗作用。因此,为进一步验证纳达合剂的疗效并深入探讨其作用机制,本研究通过大鼠BRG模型,观察纳达合剂对BRG大鼠胃黏膜保护作用的分子机制。
1 材料与方法
1.1 动物
SD清洁级雄性大鼠,体质量180~220 g,购自上海实验动物中心。清洁级动物房饲养,恒温(25 ±2)℃恒湿,人工光照12 h、黑暗12 h,自由进食饮水。
1.2 主要试剂
纳达合剂(由上海市中医医院制剂科提供,沪药制字Z05190757(批号14061901),麦滋林(日本寿制药株式会社),牛胆酸钠(上海源叶生物科技有限公司),胰酶、卵磷脂(国药集团化学试剂有限公司),含半胱氨酸的天冬氨酸蛋白水解酶-3 (caspase3)、含半胱氨酸的天冬氨酸蛋白水解酶-9 (caspase9)、β-肌动蛋白(β-actin)一抗、HRP标记山羊抗鼠、兔IgG(Cell signaling公司),磷酸化B淋巴细胞瘤-2基因(p-Bcl-2)、B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2相关X蛋白质(Bax)一抗(abcam公司),ECL化学发光试剂盒(Millipore公司),一步法Tunel检测试剂盒、组织线粒体分离试剂盒、线粒体膜电位(JC-1)检测试剂盒、ATP检测试剂盒、BCA法蛋白定量试剂盒(碧云天公司)。反流液的配制:以牛胆酸钠5 g、胰酶3 g、卵磷脂0.5 g溶于生理盐水200 ml中。麦滋林的配制:将麦滋林(1袋0.67 g)溶于30 ml生理盐水中,配制成约22 mg/ml的麦滋林药液。
1.3 主要仪器
Var10skan Flash荧光酶标仪(Thermo scientific公司),Model 237型微板孵育器(Bio-Rad公司),微型垂直电泳、电转移系统 (Bio-Rad公司),ChemiDocTM XRS+自动显影系统(Bio-Rad公司),电动匀浆机(上海净信科技有限公司),Neofuge 15R型台式高速冷冻离心机(Heal force公司),DM2500型正置荧光显微镜(Leica公司),KD-BM22型电脑生物组织包埋机(科迪仪器设备有限公司),KD1508型轮转式切片机(科迪仪器设备有限公司)。
1.4 实验方法
1.4.1 模型制备、分组、给药及取材方法[6,7]
BRG模型制备:根据大鼠体质量按随机数字表法分为对照组、模型组、纳达低剂量组、纳达中剂量组、纳达高剂量组、麦滋林组各10只共60只。大鼠给予15 ml/kg反流液灌胃造模8周,对照组给予同等体积的生理盐水。第5周起治疗组分别给予纳达合剂低剂量(12.75 g/kg)、纳达合剂中剂量(25.5 g/ kg)、纳达合剂高剂量(38.25 g/kg)及麦滋林(0.33 g/kg)以15 ml/kg灌胃,对照组与模型组给予同等体积的生理盐水。给药完毕后禁食不禁水24 h,乌拉坦腹腔麻醉后开腹摘取全胃,用生理盐水漂洗后滤纸吸干剩余血液,并沿胃大弯侧将胃剪开,去除胃内容物后做常规胃窦标本取材,一部分用4%多聚甲醛固定后用于石蜡切片的制作,一部分在液氮中浸泡30 min后置入-80℃冰箱长期储存,用于后续实验,另外一部分在取材后4 h内直接抽提组织线粒体,完成线粒体相关指标检测。
1.4.2 胃黏膜病理组织学观察 胃组织石蜡切片后采用HE染色法,高倍生物显微镜下(100X)观察胃黏膜病理变化。
1.4.3 胃黏膜线粒体膜电位、ATP的测定(1)抽提胃黏膜线粒体:剪取50 mg新鲜的胃黏膜组织PBS洗涤,将组织块置于冰上的离心管内用剪刀剪碎,加入500 μl 4℃的含苯甲基磺酰氟(PMSF)的线粒体分离试剂A,电动匀浆60 s/次共3次,将匀浆600 g4℃离心5 min。将上清液吸至新的EP管中,4℃离心11000 g 10 min。倒掉上清液,EP管中所剩之沉淀就是获得的线粒体;(2)胃黏膜线粒体膜电位的测定:将分离的线粒体质量悬于40 ul的线粒体贮存液中。再将JC-1工作液与JC-1染色缓冲液(1X)以1∶4的比例稀释,取90 μl加入10ul重悬的线粒体。用荧光酶标仪检测检测JC-1单体(绿光)时,将激发光与发射光分别设置为490 nm及530 nm波长;检测JC-1聚合物(红光)时,将激发光与发射光分别设置为525 nm及590 nm波长,红绿光比值即为线粒体膜电位值;(3)胃黏膜线粒体ATP的测定:将获得的线粒体中加入100 ul ATP检测裂解液充分震荡,裂解后12000 g 4℃离心15 min取上清。用96孔板,毎孔加入100 ul ATP检测工作液,室温放置3~5 min。在检测孔中毎孔加入50 μl待测样本或标准品震荡混匀,至少2 s后用荧光酶标仪化学发光模式检测ATP含量,根据所得的ATP标准曲线,计算出样本中ATP的浓度。用BCA法检测样品蛋白浓度,把 ATP浓度换算成 nmol/ mgprot的形式。
1.4.4 胃黏膜上皮细胞凋亡的测定 胃组织石蜡切片后,按照试剂盒说明(一步法Tunel检测试剂盒)检测胃黏膜上皮细胞凋亡情况,高倍生物显微镜下(200X)记录各病理切片各5个视野,按公式计算胃黏膜上皮细胞凋亡率。胃黏膜上皮细胞凋亡率=(凋亡阳性细胞数/总上皮细胞数)×100%。
Western blot检测凋亡相关蛋白的表达(Bax,p-Bcl-2,Bcl-2,caspase-3,cleaved-caspase-3,caspase-9 and cleaved-caspase-9),按参考文献[8]操作。
1.4.5 统计学方法 应用SPSS 18.0统计软件进行统计分析,计量资料采用均数±标准差(±s)表示,各组间比较采用单因素方差分析及SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 纳达合剂对BRG大鼠胃黏膜病理组织学的改善作用
正常组胃黏膜厚度正常,上皮细胞及黏膜腺体排列规则整齐,大小形状较为一致,未见脱落和缺损,腺上皮和腺管分界清楚。固有腺体及黏膜层无扩张瘀血,无明显炎细胞浸润,黏膜肌层及间质未见明显异常。
模型组胃黏膜明显变薄,胃黏膜上皮细胞破损、脱落,黏膜腺体不同程度破坏,腺体数量明显减少,体积缩小明显,排列无规则,胃黏膜充血水肿明显,黏膜下小血管清晰可见,并有大量炎细胞浸润和纤维组织增生,以中重度炎症表现为主。
纳达合剂高剂量组胃黏膜厚度适中,结构较为清晰,胃黏膜上皮细胞及黏膜腺体排列较为规则整齐,大小形态相对一致,未见明显变性坏死。间质及黏膜层有少量炎细胞浸润,较为接近正常组胃黏膜。
纳达合剂中、低剂量组胃黏膜厚度相对适中,结构尚清晰,腺体排列稍欠规整,间质及黏膜层可见炎性细胞浸润,有轻微的破损、脱落。
图1显示,麦滋林组胃黏膜破损、脱落较轻,结构尚清晰,腺体间隙稍增宽,间质及黏膜层有轻度炎性细胞浸润。
2.2 纳达合剂对BRG大鼠胃黏膜线粒体功能的影响
表1显示,模型组与对照组比较,胃黏膜线粒体ATP含量显著降低,差异有统计学意义(P<0.01);胃黏膜线粒体膜电位水平有所降低,但差异无统计学意义(P>0.05)。纳达合剂各剂量组及麦滋林显著升高BRG大鼠胃黏膜线粒体ATP合成量,差异有统计学意义(P<0.01),但对BRG大鼠胃黏膜线粒体膜电位水平的改善差异无统计学意义(P>0.05)。
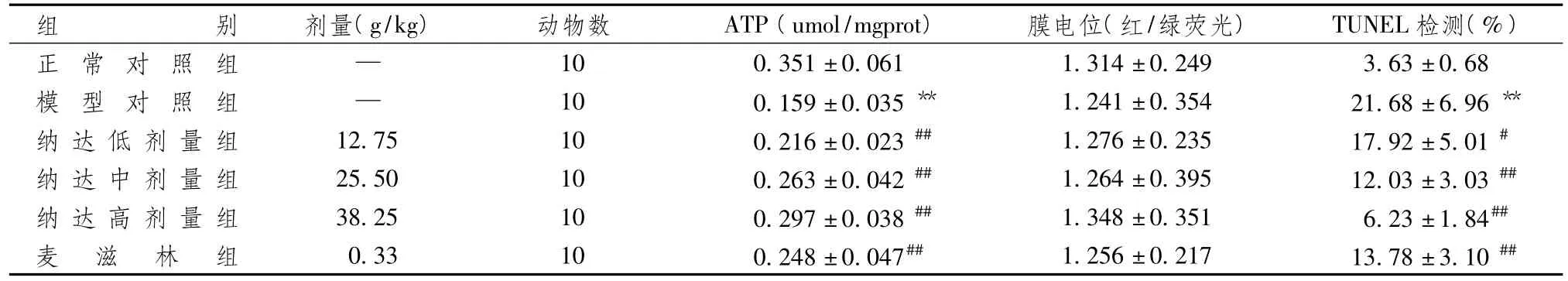
表1 纳达合剂对BRG大鼠胃黏膜线粒体ATP、膜电位及凋亡率的影响[例(%)]
2.3 纳达合剂对BRG大鼠胃黏膜上皮细胞凋亡的影响
表1、2和图2、3显示,模型组与对照组比较,凋亡细胞显著增多(P<0.01),凋亡拮抗基因p-Bcl-2表达显著降低(P<0.01),凋亡启动蛋白cleavedcaspase-3、cleaved-caspase-9及凋亡促进基因Bax表达均显著升高(P<0.01),且p-Bcl-2/Bax比值明显下降(P<0.01)。纳达合剂呈剂量依赖性,抑制促凋亡蛋白的表达,增加抑制凋亡蛋白的表达,减少胃黏膜上皮组织中凋亡细胞数量(P<0.05),且p-Bcl-2/Bax比值明显升高(P<0.05)。

表2 纳达合剂对BRG大鼠胃黏膜凋亡相关蛋白表达的影响(目的蛋白/参照蛋白)
结果表明,纳达合剂通过抑制线粒体凋亡途径的作用可能是其抵御胃黏膜损伤的分子机制之一。
3 讨论
在胆汁反流性胃炎的形成中,胆汁酸是造成黏膜损伤的主要成分。胆汁酸是亲脂性类固醇,它具有很强的“皂化”特性,使胃黏膜屏障被损坏[9],促使氢离子逆向弥散,刺激肥大细胞脱颗粒并释放组胺,导致胃黏膜炎症的发生发展。
在炎症的刺激下,线粒体呼吸链受到损伤,导致细胞膜通透性增加以及细胞膜流动性降低,从而促使大量的钙离子向线粒体内流,线粒体膜通透性转换孔道(mitochondrial permeability transition pore,MPTP)将持续性地开放,促使线粒体膜电位的丧失,释放线粒体内细胞色素C(Cytochrome C)。细胞色素C能够与凋亡蛋白酶活化因子-1(Apaf-1)相结合,并形成多聚体,促使caspase-9与其结合成为凋亡小体,使caspase-9被激活,被活化的caspase-9又继续激活下游的caspase-3、caspase-6、caspase-7等,最终使细胞发生凋亡[10-12]。此外,凋亡还受许多基因调控,如Bcl-2和Bax分别具有抗凋亡及促凋亡的作用,Bax能与Bcl-2形成异源二聚体(Bcl-2-Bax,heterodimer)抑制凋亡,而且其自身还能形成同源二聚体(Bax-Bax,homodimer)诱导凋亡。Bcl-2与Bax蛋白量的比率决定异二聚体(Bcl-2/Bax)与同二聚体(Bax/Bax)的比值,这对决定细胞凋亡的易感性起关键作用。
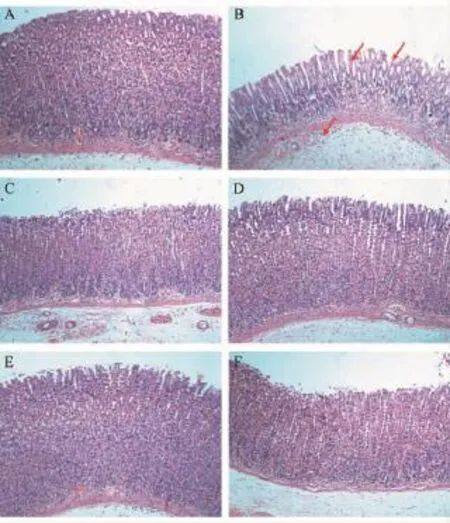
图1 纳达合剂对BRG大鼠胃黏膜病理学改变的影响(HE×100)注:A.对照组;B.模型组;C.纳达低剂量组; D.纳达中剂量组;E.纳达高剂量组;F.麦滋林组;黑色箭头标示模型组胃黏膜显著损伤与炎症处

图2 纳达合剂对BRG大鼠胃黏膜上皮凋亡的影响(Tunel×200)注:A.对照组;B.模型组;C.纳达低剂量组; D.纳达中剂量组;E.纳达高剂量组;F.麦滋林组;棕黑代表阳性凋亡细胞(5视野/样本)(黑色箭头标注为阳性表达)

图3 纳达合剂对BRG大鼠胃黏膜凋亡相关蛋白表达的影响
当前,西医学治疗BRG的常用药物[13-14]有质子泵抑制剂、H2受体拮抗剂、促动力药、胃黏膜保护剂等。应用以上几类药物可以在一定程度上缓解症状,但疗效单一,往往需要配合使用,增加了出现药物毒副作用的可能性。因此,余莉芳以胃阴不足型BGR的基本病因病机为切入点,综合历代医家的治疗经验,结合20余年对大量患者的临床验证,形成经验方纳达合剂。方中北沙参、玉竹、麦冬、天花粉滋阴清热润胃共为君药;制半夏、代赭石、枳壳、木香、延胡索等理气和胃,使动静结合、补而不腻共为臣药;黄连、黄芩、蒲公英等苦寒之品清胃中郁热共为佐药;甘草调和诸药为使[15-16]。全方共奏“养阴清胃、降逆理气”之功效,临床上广泛应用于慢性浅表性胃炎、胆汁反流性胃炎和非溃疡性消化不良等疾病。
本科室自1993年起对该方进行临床研究发现,纳达合剂治疗非溃疡性消化不良62例总有效率达95.2%,并发现加味纳达合剂对BRG合并黄疸亦具有良好的临床疗效[17-18]。因此,本研究拟采用大鼠BRG模型,观察纳达合剂能否通过抑制线粒体凋亡途径改善BRG大鼠胃黏膜损伤。实验结果发现,纳达合剂能够显著提高BRG大鼠线粒体ATP合成量,但对线粒体膜电位无显著影响,并能显著减少BRG大鼠胃黏膜上皮组织中凋亡细胞百分比,促进p-Bcl-2蛋白的表达,抑制Bax、活化的caspase-3片段、活化的caspase-9片段的表达,增加p-Bcl-2/Bax比值。
综上所述,本实验首次证实线粒体凋亡途径参与了BRG中胃黏膜的损伤过程,而纳达合剂可通过抑制线粒体凋亡途径发挥胃黏膜保护效应,这为临床纳达合剂治疗BRG提供了现代药理学依据,为进一步扩大纳达合剂的临床适应症、加速纳达合剂的临床推广提供了实验依据。
[1]中华中医药学会脾胃病分会.慢性浅表性胃炎中医诊疗共识意见[J].中国中西医结合消化杂志,2010,18(3):207-209.
[2]CORREA P.A human model of gastric carcinogenesis[J].Cancer Research,1988,48(13):3554-3560.
[3]中华中医药学会脾胃病分会.慢性浅表性胃炎中医诊疗共识意见[J].中国中西医结合消化杂志,2009,18(3):207-209.
[4]郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:135.
[5]李乾构,周学文,单兆伟.中医消化病诊疗指南[M].北京:中国中医药出版社,2006:21-28.
[6]沈艳婷,阙任烨,陶智会,等.纳达合剂对胆汁反流性胃炎大鼠胃黏膜TNF-α、IL-8、ICAM-1及MCP-1的影响[J].上海中医药大学学报,2015,29(6):55-59.
[7]钱春美,沈艳婷,阙任烨,等.纳达合剂对大鼠胃肠动力的影响[J].世界中医药,2016,11(1):117-119.
[8]王健,姜入铭,李勇,等.芪榔合剂对便秘模型小鼠结肠水通道蛋白4、8表达的影响[J].江苏中医药,2013,58(7): 72-74.
[9]郭伟强,姚萍.原发性胆汁反流性胃炎的发病机制及相关因素[J].中国全科医学,2009,12(6):511-513.
[10]王友臣,阮士荣.线粒体损伤与氧自由基的关系[J].华北国防医药,2003,15(4):243-244.
[11]J K.Rsk-mediated phosphorylation and 14-3-3ε binding of Apaf-1 suppresses cytochrome c-induced apoptosis.[J].Embo Journal,2012,31(5):1279-1292.
[12]朱玉山,陈佺.线粒体与细胞凋亡调控[J].生命科学,2008,20(4):506-513.
[13]张万岱,曾锦章.胆汁反流性胃炎的病因病机和诊治进展[J].现代消化及介入诊疗,2004,9(1):31-34.
[14]童桂法.胆汁反流性胃炎的诊断与治疗探讨[J].浙江临床医学,2002,4(1):27.
[15]沈艳婷,阙任烨,陶智会,等.纳达合剂对胆汁反流性胃炎大鼠的胃黏膜保护作用[J].中成药,2016,38(2):246-251.
[16]沈艳婷,阙任烨,钱春美,等.纳达合剂对胆汁反流性胃炎大鼠免疫功能的影响[J].中药药理与临床,2016,32(1): 156-160.
[17]余莉芳.纳达合剂治疗非溃疡性消化不良62例临床观察[J].中国中西医结合消化杂志,1995,3(2):92-93.
[18]刘晏,吴坚炯,李琼,等.加味纳达合剂治疗胆汁反流性胃炎合并黄疸的临床观察[J].中成药,2012,34(12):2462-2464.
Gastric Mucosal Protective Functional Mechanism of Nada Decoction Based on Mitochondrial Apoptosis
LI Yong1,QUE Ren-ye1,SHEN Yan-ting1,LIN Liu-bing1,TAO Zhi-hui1,QIAN Chun-mei2
(1.Department of Gastroenterology,Shanghai Municipal Hospital of Traditional Chinese Medicine Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 200071,China;2 Department of Central Laboratory,Shanghai Municipal Hospital of Traditional Chinese Medicine Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 200071,China)
Objective:To observe protective effect of Na Da Mixture on the Gastric Mucosal in BRG rats.Methods: SD rats were used and randomly divided into control group,model group,Na Da Mixture low group,Na Da Mixture middle group,Na Da Mixture high group and Marzulene group,10 rats per group.HE staining was used to observe the Pathological changes of gastric mucosa.JC-1 staining was used to observe the change of mitochondrial transmembrane potential.Chemiluminescence was used to observe the generation of mitochondrial ATP.Tunel staining was used to observe the apoptosis of gastric mucosal epithelial cells.Western blot analysis was used to detect the expression of Bax,p-Bcl-2,Bcl-2,caspase-3,cleaved-caspase-3,caspase-9 and cleaved-caspase-9.Results:HE staining showed that Na Da Mixture could significantly improve the pathological changes of gastric mucosa impaired in rats.Chemiluminescence showed Na Da Mixture could significantly increase the generation of mitochondrial ATP.JC-1 staining showed Na Da Mixture had no effect on mitochondrial transmembrane potential.Tunel staining showed Na Da Mixture could significantly reduce the apoptosis of gastric mucosal epithelial cells.Western blot analysis showed that Na Da Mixture could significantly increase the expression of p-Bcl-2,and decrease the expression of Bax,cleaved-caspase-3 and cleaved-caspase-9,and the ratio of p-Bcl-2/Bax significantly increased.Conclusion:The effect of Na Da Mixture on protecting the gastric mucosa may be related to its inhibition of mitochondrial apoptosis pathway.
Na Da Mixture;Bile reflux gastritis;Mitochondrial apoptosis pathway
R573.1
B
1006-3250(2016)12-1625-04
2016-05-19
国家自然科学基金资助项目(81573775)-基于ERβ-自噬途径对ROS/NLRP3信号通路的负调控探讨柴胡皂苷d抗肝纤维化作用机制;上海市卫生局资助项目(2011ZJ006)-纳达合剂治疗胃阴亏虚型慢性胃炎的药效学及初步安全性评价;上海市“新百人”人才计划项目(XBR2013120)-柴胡皂苷d抗肝纤维化作用的雌激素受体机制
李 勇(1968-),男,河南唐河人,主任医师,医学博士,博士研究生导师,从事消化性疾病的临床与基础研究,Tel:18116070688,E-mail:liyong8256@126.com。

