参附强心丸对心肾综合征大鼠心肾Bcl-2/Bax抗凋亡作用机制研究*
王 梓, 郝 迪,吕 楠,王 蕾
(天津市医药科学研究所,天津 300020)
参附强心丸对心肾综合征大鼠心肾Bcl-2/Bax抗凋亡作用机制研究*
王 梓, 郝 迪,吕 楠,王 蕾△
(天津市医药科学研究所,天津 300020)
目的:基于大鼠心肾综合征(cardiorenal syndrome,CRS)模型,探讨参附强心丸对CRS大鼠心肾部位Bcl-2/Bax蛋白表达及抗凋亡的作用机制。方法:采用腹主动脉缩窄合并肾脏急性缺血再灌注致大鼠心肾综合征模型,大鼠随机分为假手术对照组、模型对照组、参附强心丸高、中、低剂量组、卡托普利对照组6组,给药4周后测定血液中脑钠肽、醛固酮、肌酐等,计算左肾、心室脏器指数,TUNEL法测定心、肾凋亡,免疫组化测定心、肾Bax、Bcl-2蛋白表达。结果:模型组大鼠血浆脑钠肽、醛固酮、肌酐、心室指数明显高于假手术组,肾素活性、左肾指数明显降低,组织凋亡明显。参附强心丸中剂量组脑钠肽、肌酐降低明显;高剂量组醛固酮明显降低,可明显改善心肌肥厚及左肾坏死萎缩状态,上调大鼠心肾组织Bcl-2表达,抑制Bax表达,降低心、肾细胞凋亡率。结论:参附强心丸高、中剂量组可以改善CRS大鼠肾功能、水钠潴留状态,通过上调Bcl-2表达,抑制Bax表达,降低心肾组织凋亡,起到对心肾的保护作用。
参附强心丸;心肾综合征;脑钠肽;细胞凋亡:Bcl-2;Bax;tunel
随着社会老龄化发展进程加快,慢性心脏疾病和肾脏病的发病率呈上升趋势,心力衰竭合并慢性肾功能不全发病率显著增加,2005年荷兰学者Bongartz提出“心肾综合征”的概念,从而使得心肾综合征(CRS)备受关注。本研究采用肾脏急性缺血再灌注损伤(RIRI)合并腹主动脉缩窄(ACC)的手术方法制备大鼠“心肾共损”模型,旨在建立模拟临床心肾综合征病理特点的大鼠模型,探讨参附强心丸对CRS大鼠心肾功能改善、细胞凋亡、Bcl-2及Bax蛋白表达等环节的作用机制,期望为其临床应用提供进一步的药理学依据。
1 材料
1.1 动物
Wistar雄性大鼠,体质量290 g~300 g,购自中国人民解放军军事医学科学院卫生学环境医学研究所动物实验中心(许可证号SCXK-(军)2009-003)。动物饲养在室温20~25℃、湿度30%~70%和明暗交替的环境中(12 h∶12 h)。
1.2 药物、试剂及相关仪器
参附强心丸由天津中新药业集团达仁堂制药厂提供,规格为1 g药粉/g生药(批号zj001)。卡托普利片(天津太平洋制药有限公司,批号130102),脑钠肽试剂盒(南京建成科技有限公司,批号20141125),TUNEL试剂盒(罗氏生物公司)。Bcl-2、Bax免疫组化染色试剂盒、DAB显色试剂盒(武汉博士德生物工程有限公司)。PL203精密电子天平(梅特勒-托利多仪器(上海)有限公司制造),科华ST360酶标仪、生物组织包理机 BMJ-1B、切片机LEICARM21351、显微镜OLYMPUS(日本OLYMPUS B071型显微摄影器材),IDA-2000高清晰度数码显微图像分析系统。
2 方法
2.1 造模方法
采用腹主动脉缩窄合并肾脏急性缺血再灌注损伤制备CRS大鼠模型。大鼠经戊巴比妥钠腹腔注射45mg/kg麻醉后,腹部正中切开,沿腹白线进入腹腔,暴露分离左右侧肾蒂,阻断结扎30 min后解除阻断,恢复血流,造成急性缺血再灌注损伤。随后暴露分离后腹膜,在左肾动脉上方游离腹主动脉。沿游离腹主动脉长轴置一折弯的7号针头,以3-0丝线绕腹主动脉后与7号针头一起结扎,随后立即抽出针头,使腹主动脉残留直径为0.7 mm的残腔,造成腹主动脉狭窄。假手术组只分离肌肉、血管,但不缩窄。术后腹腔内滴入庆大霉素预防感染,分层关闭腹腔。
2.2 分组和给药方法
将存活动物按体质量随机分为模型对照组、参附强心丸高剂量组(13.2 g/kg,相当于人用剂量12倍)、参附强心丸中剂量组(6.6 g/kg,相当于人用剂量6倍)、参附强心丸低剂量组(3.3 g/kg,相当于人用剂量3倍)、卡托普利对照组(2.3 mg/kg,相当于人用剂量6倍)。给药组术后第9周开始给药,持续4周,假手术组和模型对照组灌胃同体积饮用水。
2.3 标本取材
大鼠称重,腹腔注射戊巴比妥钠麻醉后剪开腹部,分离腹主动脉,用一次性针管腹主动脉取血,血液置于促凝管中测定血清脑钠肽、肌酐、尿素氮;3 ml血液置于(0.3 mol依地酸二钠30 μL,0.3 mol 8-羟基喹啉60μL,0.32 mol二巯基丙醇30 μL)抗凝测定血浆肾素活性、血管紧张素Ⅰ、血管紧张素Ⅱ;肝素抗凝测定血浆醛固酮。取血后将大鼠左肾、心脏摘除,分离左心室。脏器称重后放入福尔马林溶液中固定,以备病理切片。
2.4 指标检测方法
2.4.1 实验室指标 酶联免疫法测定血清脑钠肽(BNP),苦味酸法测定血清肌酐(Cr),酶偶联速率法测定血清尿素氮(Bun),放射免疫法测定血浆肾素活性(PRA)、血管紧张素Ⅰ(AT1)、血管紧张素Ⅱ(AT2)、醛固酮(ALD)含量。
2.4.2 大鼠心室、肾脏质量指数 称量心室、全心湿重,计算心室、全心、肾脏指数。计算公式如下:心室指数=心室湿重/体质量×100%;全心指数=全心湿重/体质量×100%;肾脏指数=左肾湿重/体质量×100%。
2.4.3 TUNEL法测定大鼠心肌、肾脏细胞凋亡 经烤片、3 μm切片、脱蜡、梯度酒精水化,用proteinase K工作液处理、50 μL TUNEL反应混合液于标本上,PBS浸泡3次,滴加50 μL Converter POD试剂,PBS浸泡3次。每张切片加100 μL DAB工作液,显微镜下观察随时终止反应,再经自来水浸泡,苏木素复染,自来水浸泡、晾干,中性树胶封固。计算各组细胞凋亡率,凋亡率计算方法为同一个视野下,凋亡细胞占整体细胞数量的比重,IPP6.0计数计算。
2.4.4 免疫组化法测定大鼠心肌、肾脏细胞Bax、Bcl-2蛋白表达 取相应部位的组织切片,常规二甲苯脱蜡,梯度酒精入水后,采用免疫组化SABC法检测大鼠心肌、肾脏细胞Bax、Bcl-2蛋白表达,DAB显色,苏木素复杂、脱水、透明、封片,细胞浆染成棕黄色为阳性细胞,采用软件计算灰度值。
2.4.5 统计学方法 采用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析。
3 结果
3.1 参附强心丸对血清BNP、Bun、Cr、PRA、AT1、AT2、ALD的影响
表1显示,模型对照组BNP、Bun、Cr明显高于假手术对照组(P<0.05,P<0.01);PRA、AT1、AT2明显低于假手术对照组(P<0.01,P<0.05),表明该方法制备的CRS模型具备低肾素特点,而ALD明显升高(P<0.05),表明模型对照组大鼠机体呈水钠潴留状态,参附强心高剂量组能够改善CRS大鼠低肾素状态与水钠潴留状态。
3.2 参附强心丸对CRS大鼠心室、肾脏指数及细胞凋亡率的影响
表2显示,与假手术对照组比较,模型对照组大鼠心室指数明显增加,左肾质量明显减小(P<0.01),参附强心丸中、低剂量组可明显改善心肌肥厚(P<0.05)。参附强心高、中剂量组可明显改善左肾坏死萎缩状态(P<0.05)。
图1显示,模型组大鼠左心室、左肾凋亡率较假手术组明显升高(P<0.05,P<0.01),凋亡细胞形态学呈现细胞变圆,染色质凝聚、分块,胞质皱缩。参附强心丸高、中剂量组可明显抑制模型组大鼠心肌和肾脏细胞凋亡率(P<0.01)。
表1 参附强心丸对血清BNP、Bun、Cr、PRA、AT1、AT2、ALD的影响(±s)

表1 参附强心丸对血清BNP、Bun、Cr、PRA、AT1、AT2、ALD的影响(±s)
注:与假手术对照组比较:★P<0.05;★★P<0.01;与模型对照组比较:▲P<0.05
组别 鼠数 BNP (ng/L) Bun (mmol/L) Cr (μmol/L) PRA (ng/ml) AT1 (ng/ml) AT2 (pg/ml) ALD (ng/dl)假 手 术 对 照 组 10 444.17±59.04 5.90±0.82 29.71±5.05 4.96±2 2.27 10.15±5.00 1662.25±733.62 22.30±7.72 .32 12.49±4.52 1921.67±557.40 17.31±3.15模 型 对 照 组 10 535.00± 91.14★ 8.59±2.03★★ 40.00±9.38★ 2.11±1.59★★ 6.51±2.78★★1221.33±500.71★ 24.93±5.81★参附强心高剂量组 10 515.50±111.57 7.32±1.61 32.11±4.17▲ 2.90±2.24 11.20±5.77▲ 1461.00±704.94 19.87±3.58▲参附强心中剂量组 10 480.29± 63.21▲ 7.31±1.10 32.75±6.52▲ 2.43±1.29 11.40±5.32▲ 1678.00±542.53 20.65±2.48参附强心低剂量组 10 573.60±137.13 7.44±1.16 35.50±8.69 2.70±2.80 9.50±5.16 1500.00±593.10 22.09±6.73卡托普利对照组 10 511.42±108.58 6.97±1.50 31.86±7.95 2.72±
表2 参附强心丸对CRS大鼠心室、左肾指数及细胞凋亡率的影响(±s)

表2 参附强心丸对CRS大鼠心室、左肾指数及细胞凋亡率的影响(±s)
注:与假手术对照组比较:★P<0.05,★★P<0.01;与模型对照组比较:▲P<0.05,▲▲P<0.01
组别 鼠数 心室指数(g/100 gBW) 全心指数(g/100 gBW) 左肾指数(g/100 gBW) 心肌凋亡率(%) 肾脏凋亡率(%)假 手 术 对 照 组 10 0.246±0.051 0.310±0.665 0.383±0.098 7.1±5.7 18.8±9.5模 型 对 照 组 10 0.312±0.023★★ 0.358±0.053 0.115±0.094★★ 31.2± 4.1★ 62.8±5.7★★参附强心高剂量组 10 0.307±0.027 0.360±0.024 0.239±0.128▲ 23.6±10.4 15.6±2.5▲▲参附强心中剂量组 10 0.271±0.035▲ 0.351±0.041 0.227±0.088▲ 20.8± 6.9▲▲ 24.6±4.7▲▲参附强心低剂量组 10 0.274±0.036▲ 0.334±0.039 0.183±0.110 22.5± 8.7 37.6±3.0▲卡托普利对照组 10 0.290±0.060 0.357±0.052 0.173±0.130 36.9± 4.1 12.0±6.1▲▲

图1 参附强心丸对CRS大鼠心肌、肾脏细胞凋亡的影响(TUNEL×400)
3.3 参附强心丸对CRS大鼠心肌、肾脏细胞Bax、Bcl-2蛋白表达的影响
图2表3显示,与模型对照组比较,参附强心丸高剂量组Bax、Bcl-2在左肾平均灰度均明显增高(P<0.05),表明大鼠心、肾的抗凋亡基因Bcl-2表达上调,促凋亡基因Bax表达下降,平均灰度数据。
表3 参附强心丸对CRS大鼠心肌、肾脏Bax、Bcl-2蛋白表达的影响(±s)

表3 参附强心丸对CRS大鼠心肌、肾脏Bax、Bcl-2蛋白表达的影响(±s)
注:与模型对照组比较:▲P<0.05,▲▲P<0.01
组别Bcl-2模 型 对 照 组平均灰度/Dip左心室Bax 左肾Bax 左心室Bcl-2 左肾143.3± 5.5 114.3± 4.2 188.5±21.9 173.0±16.9参附强心高剂量组 160.5±12.1▲ 159.0± 2.2▲▲ 153.3± 9.4 145.2±14.8▲参附强心中剂量组 159.3±13.7 160.7± 8.3 168.5±21.9 169.5± 6.4参附强心低剂量组 138.0± 5.5 150.2±10.4 162.8±14.1 165.8± 6.2卡 托 普 利 对 照 组 164.3±14.4 166.5±14.4▲▲ 151.0±11.5▲150.5±12.4
4 讨论
心脏和肾脏在神经体液的共同调节下一起维护着血流动力学的稳定及各器官的血流灌注,两者中其中1个器官的急慢性功能不全,导致另一器官急慢性功能不全称为心肾综合征(CRS)[1]。已有文献报道,参附强心丸对慢性充血性心衰大鼠及犬的血流动力参数和心肌纤维化的改善作用[2-3],对腹主动脉缩窄致慢性心衰大鼠心肌Bcl-2表达上调起到抗心衰作用[4]。本研究在大鼠慢性心衰的模型基础下建立“心损及肾、肾损及心”或“心肾共损”的CRS模型,阐明参附强心丸对肾脏和心脏的共同保护作用及作用机制,体现中医“水火既济”的基础理论和益气助阳、强心利水的中医治则。
目前,心衰模型主要采用手术致前后负荷加重,或冠状动脉结扎致缺血性心肌病,或心肌毒性化学物质,或基因敲除等方法;肾衰模型多采用肾脏单侧全肾或部分肾组织切除、肾蒂或肾动脉永久结扎或缺血再灌、化学物质合并肾脏切除术等方法。以往已有文献报道,采用合并手术方法造成心肾损伤程度大于单一手术的模型制备手段,多为大鼠急性心肌缺血合并肾组织切除术[5-7],但对心肾损伤程度并不一致,稳定性较差。本实验采用RIRI+ACC的手术方法制备大鼠“心肾共损”模型,模拟临床心肾综合征的病理特点。已有报道表明,RIRI可以导致由肾脏急性损伤转归为慢性肾损伤。RIRI+ACC可不同程度地增加慢性心衰和肾衰损伤程度[8-9],该方法操作简单、手术过程可控,一致性较强。
BNP主要在心室合成,当其在心室负荷过重或扩张时合成会急速增加,可充分反映心室的功能状态[10],是反映心衰较新的指标。实验中,参附强心丸中剂量组可有效降低模型大鼠血清BNP浓度,通过提高CRS大鼠PRA、AT2含量,作用于RAAS系统,减少心室重构,从而改善心功能。“水钠潴留”用中医病机可描述为“水饮内停,阳虚水泛”,临床最明显的体征为水肿,但动物试验对水肿的观察欠直观,ALD可反映机体水钠潴留状态,是观察药物利水的客观指标之一。参附强心丸高剂量组通过降低ALD水平,改善CRS大鼠水钠潴留状态,降低Cr、Bun,从而达到改善肾脏功能的作用。
CRS大鼠的肾脏处于缺血再灌注状态,从而造成左肾坏死萎缩,急性肾衰经过一段时间转变为慢性肾衰。大鼠腹主动脉缩窄后,心脏后负荷增加,心脏形成心室壁增厚的向心性肥厚,诱导心肌、肾脏细胞凋亡的发生[11],导致心肌细胞、肾脏细胞减少,这一过程受凋亡基因的调控,其中Bcl-2基因家族起着重要的作用[12]。Bcl-2基因家族中,Bcl-2主要通过对细胞内质网的Ca2+调控,控制细胞信号传导途径,影响细胞凋亡;Bax蛋白可与Bcl-2蛋白形成异二聚体,使Bcl-2蛋白失活,因此对细胞凋亡有促进作用[13-14],且二者相互作用。参附强心丸可增加CRS大鼠心肾部位Bcl-2蛋白表达,抑制Bax蛋白表达,达到心肾保护和抗凋亡作用。
本实验中,参附强心丸高、中剂量能明显改善CRS大鼠心肌肥厚和左肾坏死萎缩状态,显著降低CRS大鼠心肌和肾脏细胞凋亡率,有效增加CRS大鼠心肾Bcl-2蛋白表达,抑制Bax蛋白表达,从而对CRS大鼠心肾有共同保护作用。
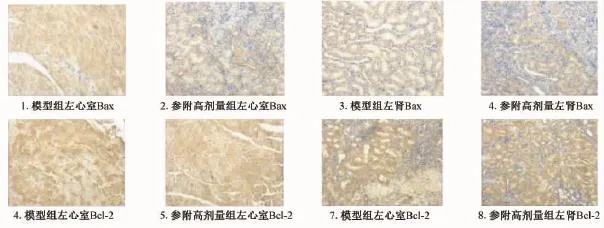
图2 参附强心丸对CRS大鼠心脏、肾脏Bax、Bcl-2蛋白表达的影响(×100)
[1]李偲,杜晓刚.心肾综合征研究进展[J].中华临床医师杂志,2015,9(5):833.
[2]霍根红.参附强心胶囊抗充血性心力衰竭大鼠心肌纤维化的作用[J].中国中医药现代远程教育,2009,7(5):52.
[3]李欣志,刘建勋,尚晓泓.参附强心胶囊对犬急性心力衰竭的保护作用[J].中国实验方剂学杂志,2006,12(4):29.
[4]王蕾,蒋永萍,康利,等.参附强心对腹主动脉缩窄大鼠心肌细胞Bcl-2表达及抗心衰作用机制研究[J].中国实验方剂学杂志,2013,19(4):254-258.
[5] MK SZYMANSKI,RA DE BOER,WH VAN GILST,et al.Animal models of cardiorenal syndrome:a review[J].Heart Fail Rev,2012,17(3):411-420.
[6]BASILE D P.The endothelial cell in ischemic acute kidney injury:implications for acute and chronic function[J].Kidney Int,2007,72:151-156.
[7]DIKOW R,KIHM LP,ZEIER M,et al.Increased infarct size in uremic rats:reduced ischemia tolerance[J].J Am Soc Nephrol,2004,15:1530-1536.
[8]BASILE D P.The endothelial cell in ischemic acute kidney injury:implications for acute and chronic function[J].Kidney Int,2007,72:151-156.
[9]BASILE D P.Rarefaction of peritubular capillaries following ischemic acute renal failure:a potential factor predisposing progressive nephropathy[J].Curr Opin Nephrol Hypertens,2004,13:1-13.
[10]耿威,慢性心衰患者血浆脑钠肽浓度变化的临床意义[J].中国实验诊断学,2011,15(11):1992.
[11]HAMCT P,RICHARD L. Apoptosis in target organs of hypertension[J].Hypertension,1995,26(4):642.
[12]ADAMS JM,CORY S.The Bcl-2 protein family:arbiters of cell survival[J].Science,1998,281(28):1317-22.
[13]BOISE LH,GONZALEZ G.Bcl-x A dominant regular of apoptosis cell death[J].Cell,1993,74(4):597-608.
[14]OLTARI Z,MILLIMAN C.Bcl-2 heterodimers in vivo with a con served homolog,Bax,that accelerates programmed cell death[J].Cell,1993,74(4):609-619.
Effects of Shenfu Qiangxin Pill on Bcl-2/Bax Apoptosis in Rats with Cardiac and Renal Syndrome
WANG Zi,HAO Di,LV Nan,WANG Lei△
(Tianjin institute of medical and pharmaceutical sciences,Tianjin 300020,China)
Objective:Based on the cardiorenal syndrome rats model,to explore Shenfu Qiangxin(SFQX)pills of CRS in rat heart and kidney site of Bcl-2/Bax protein expression and anti apoptosis mechanism.Methods:A rat model of CRS was induced by ACC+RIRI.After operation,the CRS rats were randomly divided into 6 groups:Sham group,CRS model group,SFQX pills high、medium、low group and captopril group,Gavage rats 4 weeks,testing rats of BNP,ALD,Cr etc.Computed ventricular,heart,left renal index;Apoptosis of myocardium and kidney were measured by TUNEL and Bax and Bcl-2 protein expression in myocardium and kidney were measured by immunohistochemistry.Results:The CRS group BNP,Bun,Cr,ALD,ventricular index were higher than that of the sham group,PRA,AT1 and AT2,left renal index was significantly decreased,left ventricular and left renal tissue apoptosis.SFQX pills of BNP and Cr obviously decrease,can improve the low renin status of CRS rats;high group ALD decreased significantly; significantly improve myocardial hypertrophy,improve atrophy of left kidney necrosis,tune of CRS rats myocardial and kidney Bcl-2 expression and inhibition of Bax expression,reduce myocardial and renal cell apoptosis rate.Conclusion: SFQX pills can improve CRS rats renal function,sodium and water retention,by up regulating Bcl-2 protein expression and inhibiting the expression of Bax,reduce apoptosis of heart and kidney tissues to have a protective effect on the heart and kidney.
SFQX pills;CRS;BNP;Cell apoptosis,;Bcl-2;Bax;tunel
R285.5
B
1006-3250(2016)12-1616-04
2016-04-25
国家自然科学基金青年基金项目(81202801)-(P)RR介导MAPK信号通路对心肾综合征联动作用及益气温阳、活血利水治则机制研究
王 梓(1987-),男,天津人,研究实习员,医学学士,从事心脑血管药理的临床与研究。
△通讯作者:王 蕾(1979-),女,天津人,副研究员,医学硕士,Tel:13820803501,E-mail:zws9905@sina.com。

