慢性刺激对链脲佐菌素诱导糖尿病大鼠的影响
李 想 李若男 夏良锋 华 锋 王 瑶 王丹丹 杨利敏(佳木斯大学基础医学院生理教研室,黑龙江 佳木斯 154007)
慢性刺激对链脲佐菌素诱导糖尿病大鼠的影响
李想李若男夏良锋华锋王瑶王丹丹杨利敏
(佳木斯大学基础医学院生理教研室,黑龙江佳木斯154007)
〔摘要〕目的观察慢性刺激( CMS)对大鼠糖尿病( DM)发病及进程的影响及其在DM发生、发展中的作用。方法应用链脲佐菌素( STZ)加高脂高糖饮食诱导DM大鼠的过程中,增加CMS因素,观察CMS对大鼠生化指标和行为学的影响。结果与正常组相比,DM组和DM+CMS组大鼠血糖及血清胰岛素水平均升高( P<0.05),出现了明显的胰岛素抵抗现象;与正常组大鼠相比,CMS组、DM组及DM+CMS组大鼠的上窜时间均缩短,不动时间延长(均P<0.05) ; DM+CMS组大鼠进入开放臂的次数和停留时间亦明显缩短( P<0.05) ;与正常组相比,各实验组大鼠血清皮质醇水平均明显升高( P<0.05)。结论慢性刺激本身并不能直接诱发DM,但它的存在可加重大鼠的胰岛素抵抗,促进DM的发生和发展。
〔关键词〕慢性刺激;糖尿病;强迫游泳实验;高架十字迷宫
大量资料显示〔1〕,慢性刺激( CMS)对人类的健康具有非常重要的影响,尤其是对糖尿病( DM)病人影响更大,但CMS对DM的发生、发展会造成什么样的结果还不十分清楚。本实验在应用链脲佐菌素( STZ)诱导DM的基础上增加了CMS的因素,观察了CMS因素对大鼠血糖、抑郁和焦虑行为、血清皮质醇及胰岛素水平的影响,从而确定CMS对大鼠DM发生、发展的影响。
1材料与方法
1. 1动物分组与模型制备将48只清洁级Wistar雄性大鼠随机分成四组,正常组: 12只,不做任何处理; DM模型组( DM 组) : 12只,腹腔注射STZ( 25 mg/kg溶于0.1 mol/L柠檬酸缓冲液,pH=4.45),同时给予高脂高糖饮食,以空腹血糖值高于13.6 mmol/L者为DM造模成功; CMS组: 12只,给予电击足底30 min,45℃热刺激5 min,黑白颠倒24 h、禁食40 h、禁水24 h、4℃冰水游泳5 min、夹尾1 min、无刺激24 h,28 d为1个循环,每天采取一种刺激,同种刺激不连续出现; DM+CMS组: 12只,在腹腔注射STZ+高脂高糖饮食的基础上增加CMS因素。DM组死亡4只,DM+CMS组死亡2只。
1. 2标本采集及指标检测
1. 2. 1强迫游泳行为学测定CMS前后对大鼠进行行为绝望探究试验,记录5 min内大鼠上窜和不动时间,观察大鼠CMS前后产生抑郁的行为学变化,实验方法详见参考文献〔2〕。
1. 2. 2高架十字迷宫行为学测定记录5min内CMS前后大鼠十字迷宫的行为学指标〔3〕:①进入开放臂次数( OE) :进入到任一开放臂的次数,以大鼠4个爪子均进入到臂内为准,中途一个爪子从该臂中完全退出则为该次进行活动完成;②进入开放臂时间( OT) ;③进入封闭臂次数( CE) :进入任一封闭臂的次数,以大鼠4个爪子均进入到臂内为准。OE% = OE/( OE+ CE)×100%; OT%=OT/300 s×100%〔4〕。
1. 2. 3血糖测定实验结束后对大鼠禁食12 h,且乙醚麻醉后内眦静脉取血应用电化学方法检测血糖水平。
1. 2. 4血清胰岛素及皮质醇水平测定实验结束后禁食12 h,乙醚麻醉后内眦静脉取血,分离血清,应用放射免疫分析法测定血清胰岛素和皮质醇水平。胰岛素抵抗指数( HOMA) =空腹胰岛素×空腹血糖/22.5〔5〕。
1. 3药物及试剂STZ:美国Sigma公司。胰岛素试剂盒:北京北方生物技术研究所。皮质醇试剂盒:北京北方生物技术研究所。
1. 4统计学处理采用SPSS21.0软件进行单因素方差分析、LSD检验和t检验。
2结果
2. 1 CMS对大鼠血糖及胰岛素的影响与正常组比较,DM组和DM+CMS组血糖明显升高( P<0.05),且两组之间亦有显著性差异( P<0.05) ;在胰岛素水平上,DM组和DM+CM组较正常组明显升高( P<0.05),但CM组血清胰岛素水平升高不显著( P>0.05) ; DM组和DM+CMS组HOMA-IR均较正常组高,其中,DM+CMS组升高更加显著( P<0.05)。见表1。
表1各组大鼠血清、胰岛素及HOMA-IR比较(±s)

表1各组大鼠血清、胰岛素及HOMA-IR比较(±s)
与正常组比较: 1) P<0.05;与DM组比较: 2) P<0.05
正常组 12 8.16±0.20 46.54±5.37 17.00±2.13 DM组 8 15.59±1.431) 99.75±11.711) 67.43±12.621)CMS组 12 7.7±0.322) 58.47±5.902) 20.30±2.49 DM+CMS组10 18.51±1.071) 2) 123.59±22.831)98.71±17.781) 2)
表2各组大鼠游泳指标比较(±s,s)
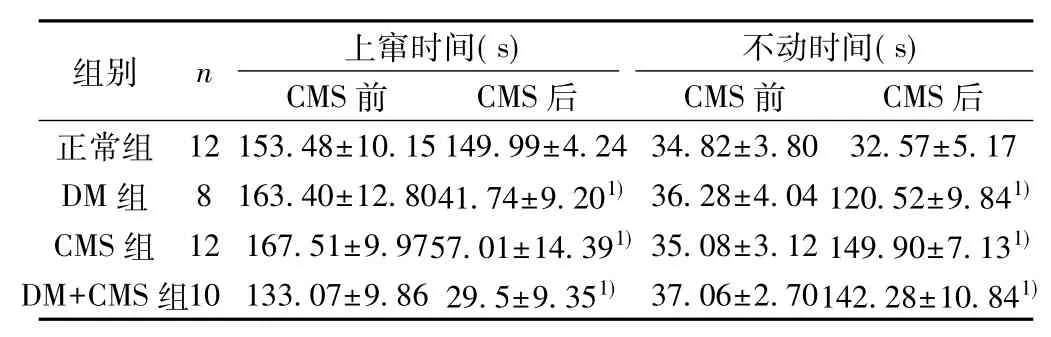
表2各组大鼠游泳指标比较(±s,s)
与CMS前比较: 1) P<0.05;下表同
.80 32.57±5.17 .04 120.52±9.841).12 149.90±7.131)DM+CMS组10 133.07±9.86 29.5±9.35 37.06±2.70142.28±10.841)
2. 2 CMS对大鼠强迫游泳的影响见表2。实验后DM组、CMS组和DM+CMS组大鼠的上窜时间均明显降低,不动时间均显著升高(均P<0.05),而且DM+CMS组大鼠上窜时间缩短的更加明显。
2. 3 CMS对大鼠高架十字迷宫的影响与实验前相比DM+ CMS组OE%与OT%具有显著性差异( P<0.05),OT和OE均明显减少,但其他组的缩短时间和次数并不明显。见表3。
表3各组大鼠高架十字迷宫指标比较(±s,s)

表3各组大鼠高架十字迷宫指标比较(±s,s)
分组 n OE( %)OT CMS前 CMS后CMS前 CMS后正常组 12 43.67±5.68 28.72±9.12 31.98±5.18 15.32±5.25 CMS组 8 42.68±5.18 24.09±9.16 32.26±5.71 14.09±8.24 CMS组 12 41.00±5.03 34.43±8.24 24.37±4.73 14.95±4.11 DM+CMS组10 57.74±3.71 17.70±7.771)52.32±3.66 7.22±3.411)
2. 4 CMS对大鼠血清皮质醇的影响与正常组〔( 23.79± 2.91) ng/ml〕相比,DM组、CMS组、DM+CMS组血清皮质醇水平〔( 129.31±24.35) ng/ml、( 44.20±6.86) ng/ml、( 96.18± 20.82) ng/ml〕均明显升高( P<0.05)。且DM组和DM+CMS组升高较CMS组更加明显。
3讨论
CMS通过对动物长时间、无规律的刺激,导致动物心理状态改变,抵抗外界刺激的敏感性下降,机体自身调节能力降低,神经-内分泌系统功能紊乱,出现情绪和行为障碍,从而可导致抑郁症等多种疾病的发生。DM作为一种慢性疾病,近年来发病率呈现逐年增加的趋势,成为当今社会威胁人们健康的一个主要因素。随着人们生活节奏的加快,在日常生活中各种CMS因素也逐渐增多。
本实验结果说明MCS对动物的心理改变并不足以诱发DM的发生,但当CMS与其他因素合并作用于机体时就会大大地促进DM的发生、发展。这可能是由于CMS本身对机体造成心理紊乱状态和行为上的改变,导致机体内分泌功能失调,出现激素水平上的变化,这些变化又进一步加重糖代谢紊乱的发生,从而加速了DM的发生和发展。此结果与国外实验室的研究结果一致〔6〕。
强迫游泳是评价大鼠抑郁行为的一个公认指标〔7〕,我们发现DM大鼠在未受到CMS的情况下也均表现出了不同程度的抑郁,CMS则又加重了这种抑郁状态。CMS和DM本身虽然可导致大鼠出现轻微的焦虑状态,但实验前后并无显著性差异,而CMS合并DM却可导致大鼠出现明显的焦虑行为。此结果进一步证明了CMS可加重DM的发展进程。CMS以一种心理应激形式作用于DM大鼠,使大鼠机体内糖代谢紊乱,糖耐量降低,胰岛素水平增加,使得胰岛素抵抗显著增加,从而导致血糖升高,加重DM的进程。
海马是应激损伤的敏感区,也是HPA轴应激反应的高级调节中枢〔8〕,CMS作为一种应激源,能够使机体产生负性心理和行为状态的改变,从而造成海马结构和功能损伤,而海马的损伤又使得HPA轴对多种应激源的敏感性增强〔9〕,最终导致皮质醇的分泌升高,而这一分泌升高又会促进糖异生,增加胰岛素抵抗,促进DM的发生、发展。本研究中结果显示,DM和CMS都可引起皮质醇的升高,这可能是CMS加速DM发生、发展的一个主要因素。
综上所述,CMS本身并不是诱发DM的原因,但CMS可加速和加重DM的发生和发展。这为临床DM病人的护理提供了一个可靠的理论依据,应尽量减少对DM病人心理和环境的刺激,这样有利于减少并发症和病情的控制。
4参考文献
1 Kim GM,Woo JM,Jung SY,et al.Positive association between serious psychiatric outcomes and complications of diabetes mellitus in patients with depressive disorders〔J〕.Int J Psychiatry Med,2015;〔Epub ahead of print〕.
2杨利敏,姚海涛,张晓波,等.缰核损毁降低外源性抑郁症大鼠室旁核促肾上腺皮质激素释放激素的表达〔J〕.中国老年学杂志,2012; 32( 12) : 5201-3.
3李宁,唐启盛,赵珍瑞,等.慢性焦虑应激大鼠行为学的变化及高架十字迷宫的测评〔J〕.中华中医药学刊,2010; 28( 4) : 711-3.
4 Daher F,Mattioli R.Impairment in the aversive memory of mice in the inhibitory avoidance task but not in the elevated plus maze through intra-amygdala injections of histamine〔J〕.Pharmacol Biochem Behav,2015; 135: 237-45.
5 Gu S,Zeng Y,Tang Z,et al.Astragalus polysaccharides affect insulin resistance by regulating the hepatic SIRT1-PGC-1α/PPARα-FGF21signaling pathway in male Sprague Dawley rats undergoing catchup growth〔J〕.Mol Med Rep,2015; 12( 5) : 6451-60.
6 Rubinstein MR,Cremaschi GA,Oliveri LM,et al.Possible involvement of stress hormones and hyperglycaemia in chronic mild stress-induced impairment of immune functions in diabetic mice〔J〕.Stress,2010; 13( 5) : 384-91.
7马行,库宝善,姚海燕,等.对抑郁模型小鼠强迫游泳实验方法的探讨〔J〕.徐州医学院学报,2005; 25( 3) : 230-3.
8连晓媛,张均田,包天桐.海马与下丘脑-垂体-肾上腺轴功能调节〔J〕.国际内分泌学代谢杂志,1998; 18( 4) : 169-72.
9 Jacobson L,Sapolsky R.The role of the hippocampus in feedback regulation of the hypothalamic-ppituitary-adrenocortical axis〔J〕.Endocr Rev,1991; 12( 2) : 118-34.
〔2015-06-22修回〕
(编辑滕欣航)
通讯作者:杨利敏( 1973-),女,博士,副教授,硕士生导师,主要从事神经生理学研究。
〔中图分类号〕R749
〔文献标识码〕A
〔文章编号〕1005-9202( 2016) 02-0278-03;
doi:10. 3969/j. issn. 1005-9202. 2016. 02. 010基金项目:黑龙江省大学生创新创业训练重点项目( No.201410222012) ;佳木斯大学研究生科技创新项目( No.LZZ2014_005) ;佳木斯大学大学生创新创业训练项目( No.XSYM2014-009)
第一作者:李想( 1989-),女,在读硕士,主要从事神经生理学研究。

