“位—构—性”知识要点探究
安徽 张茹英 杨 宁
“位—构—性”知识要点探究
安徽 张茹英 杨 宁
“位置、结构、性质”问题虽然属于高一化学必修教材中所学习的内容,但该知识点近年来却是我们新课标卷中的高频考点,该类试题借助化学中较为基础的知识要点,不仅能够很好的考查物质结构、元素周期表、元素周期律的知识,而且还更好的考查我们学生的推断能力、信息的挖掘能力以及解决综合问题的能力,所以我们要重视和学好“位置、结构、性质”的相关知识要点!
“位置、结构、性质”问题是元素周期律和周期表中的重点,为更好掌握该知识要点,我们针对该知识点可以做如下分析探究。
一、明确“位置—结构—性质”三者间的关系
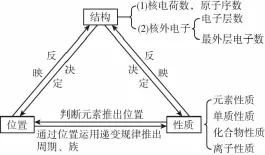
二、“位置—结构—性质”关键点点拨
1.“结构与位置”的典型关系导析
(1)学习该知识要点时,重点需要掌握如下几个关系式:
①电子层数=周期数
②质子数=原子序数
③主族元素原子最外层电子数=主族序数
④主族元素的最高化合价=族序数,
最低化合价=主族序数-8(一般规律)
(2)针对“位置”问题,学习过程中,我们好熟练掌握周期表中的一些特殊规律,具体如下:
①各周期所含元素的种数,即:一到七周期分别为2、8、8、18、18、32、26。
②明确稀有气体的原子序数及其在周期表中的具体位置:
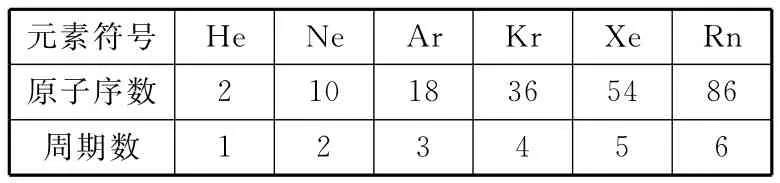
元素符号_ _He_ _ __Ne_ _ __Ar_ _ _______ ______ ______ Kr_Xe_Rn原子序数_ __2_ _ ___10_ _ ___18_ ______ _____ ______ _36_54_86 __周期数1_ __ ____2__ _____ _____ ______ _____ _ _3_4_5_6
③理解同主族上下相邻元素原子序数的关系:

______位置关系实例位于过渡元素左侧的主族元素,即ⅠA、ⅡA族同主族、邻周期元素原子序数之差为上一周期元素所在周期所能__________________容纳元素种数钠与钾的原子序数差为19-11=8(即钠原子所在第3周期所能容纳元素种数)______________位于过渡元素右侧的主族元素,即ⅢA~ⅦA族同主族、邻周期元素原子序数之差为下一周期元素所在周期所能__________________容纳元素种数氯和溴的原子序数之差为35-17=18(溴原子所在第4周期所能容纳元素种数)___________
2.“性质与位置”的典型关系导析
(1)根据不同元素的性质差异可以推知元素在周期表中的相对位置
例如:若同周期元素A、B、C的金属性逐渐增强,则A、B、C在同周期中按照C、B、A的顺序从左到右排列。
(2)根据元素在周期表中的位置关系可以推断元素间的性质差异。
例如:若同主族元素A、B、C在同一主族中从上往下排列,则可推知A、B、C的单质的氧化性依次减弱或还原性依次增强。
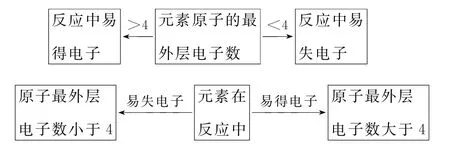
3.“结构和性质”的典型关系导析
三、“位置—结构—性质”经典例题分析
例题1:短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如下图所示,其中只有Z为金属元素。则下列说法正确的是( )
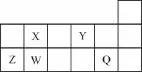
A.W、X两种元素在自然界中都存在相应的单质
B.Q、W相比,后者更易与氢气发生反应
C.Y、Z分别形成的简单离子中,前者的半径较大
D.X、Z的最高价氧化物对应的水化物之间容易相互发生反应
【解析】由短周期元素Q、W、X、Y、Z在元素周期表中的相对位置及只有Z为金属元素,可以确定分别为Cl、Si、C、O、Al。自然界中存在碳单质,但没有硅单质,A项错误;Cl的非金属性强于Si,因此更易与氢气反应,B项错误;O、Al形成的简单离子O2-、Al3+具有相同的电子层排布,但O的核电荷数小,因此离子半径大,C项正确;X、Z的最高价氧化物对应的水化物分别为碳酸、氢氧化铝,二者不能反应,D项错误。
【答案】C
例题2:短周期元素Q、R、T、W在元素周期表中的位置如图,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )

A.氢化物的稳定性:R>Q>T
B.T的氧化物是一种良好的半导体材料
C.Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同
D.T、W的最高价氧化物的水化物的酸性W强于T
【解析】T原子的M层电子数比K层多2个,为硅元素,故Q、R、W分别为N、O、Cl。氢化物的稳定性:H2O>NH3>SiH4,A正确;Si是一种半导体材料,而不是其氧化物,B错误;NH3、H2O、Ne都是10个质子、10个电子的微粒,C正确;高氯酸的酸性强于硅酸,D正确。
【答案】B
例题3:四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
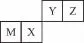
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的弱
D.Z位于元素周期表中第2周期ⅥA族
【解析】由题给信息可知,M为Al,X为Si,Y为N,Z为O。原子半径Al>Si>N>O,A项正确;因为N的非金属性比Si强,所以HNO3的酸性比H2SiO3强,B项错误;因为O的非金属性比Si强,所以简单气态氢化物的热稳定性H2O>SiH4,C项正确;氧元素位于元素周期表的第2周期ⅥA族,D项正确。
【答案】B
(作者单位:安徽省灵璧中学)

