实验活动9粗盐中难溶性杂质的去除
李德前

本活动旨在引导同学们体验固体混合物初步提纯的实验过程,进一步学习蒸发操作技能,巩固溶解、过滤操作技能,从而提升实验能力,培养科学素养。另外,适当拓展粗盐中可溶性杂质的除去,有利于同学们深化复分解反应的概念,认识复分解反应发生的条件。
一、粗盐中难溶性杂质的去除
1.溶解
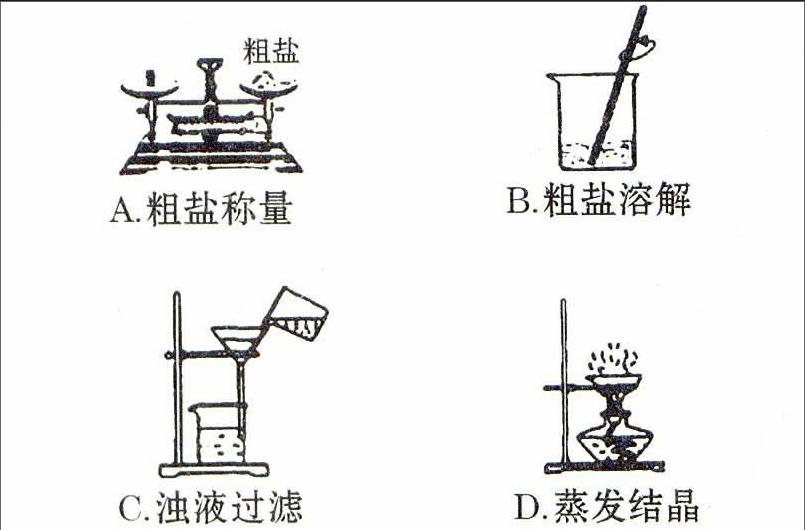
(1)实验操作:①用量筒量取约10 mL水倒入烧杯中,用托盘天平称取5.0 g粗盐;将称取的粗盐逐渐加入烧杯里,并用玻璃棒不断搅拌,直至粗盐不再溶解为止,最终得到浑浊的粗盐水。②称量剩余的粗盐,计算出10 mL水中溶解粗盐的质量。
(2)注意事项:①粗盐具有吸湿性,因此在称量时为防止天平的托盘受污染,必须在天平左、右托盘上各放一张相同的纸张,或将粗盐放在小烧杯中称量。②量取10 mL蒸馏水,应选用10 mL规格的量筒,溶解时选用50 mL规格的烧杯。③用玻璃棒搅拌时,通过手指和手腕的运动,使玻璃棒做圆周形的搅拌动作,在搅拌过程中避免玻璃棒与烧杯壁接触,发出叮当的声音。
2.过滤
(1)实验操作:①用滤纸和漏斗制一个过滤器,将烧杯中的浊液沿玻璃棒倒入过滤器;不溶的泥沙留在了滤纸上,澄清的盐水流入下面的烧杯中。②若滤液仍浑浊,应再过滤一次,从而彻底滤去粗盐中的不溶性杂质。
(2)注意事项:①过滤时必须做到一贴(滤纸与漏斗内壁紧密相贴)、二低(滤纸边缘低于漏斗口、溶液低于滤纸边缘)、三接触(烧杯嘴与玻璃棒接触、玻璃棒下端与漏斗中的三层滤纸处轻轻接触、漏斗颈下端长的一边与烧杯内壁接触)。②在过滤时,先让上层澄清溶液过滤,然后再将混有大量沉淀的溶液倒入漏斗,并用蒸馏水将烧杯洗净,洗涤液必须倒入漏斗中洗涤滤渣,最后用少量蒸馏水洗涤滤渣2~3次,确保溶质全部进入滤液中。③若重新过滤后,滤液仍浑浊,必须查明原因。滤液仍浑浊的原因可能是:滤纸破损,过滤时没有做到“二低”的要求,造成浊液通过漏斗壁进入烧杯。
3.蒸发
(1)实验操作:①将蒸发皿放到铁架台的铁圈上,把滤液倒入蒸发皿中,用酒精灯加热。为使滤液受热均匀,在加热过程中必须用玻璃棒不断搅拌滤液,防止滤液局部过热,造成液滴飞溅。②待蒸发皿中出现较多的固体(液体很少)时停止加热,最终得到白色细小的晶体,其主要成分是氯化钠。
(2)注意事项:①加入蒸发皿的滤液不超过蒸发皿容积的2/3为宜,若倒入溶液过多,在沸腾时容易造成溶液迸溅,也不便于加热过程中对溶液的搅拌。②在蒸发皿中出现较多固体时停止加热,利用蒸发皿的余热将滤液蒸干。
4.计算产率
蒸发结束,待蒸发皿冷却至室温,用玻璃棒将精盐转移到纸上,进行称量。根据“精盐的产率=精盐质量/粗盐质量×100%”进行计算,然后将精盐回收到指定的容器中。
二、粗盐中可溶性杂质的清除
初步提纯的精盐中一般还含有可溶性杂质(MgCl2、CaCl2、Na2SO4等),要顺利清除这些杂质,既要知道选择哪些除杂试剂,还要明白加入除杂试剂的先后顺序。
1.除杂试剂的选择
根据粗盐中含有的杂质种类(SO2-4、Ca2+和Mg2+,它们在复分解反应中只能转变为沉淀),并考虑粗盐的有效成分(NaCl),不难确定4种除杂试剂。
清除CaCl2的除杂试剂,既要使Ca2+转变为易于清除的沉淀,又要使Cl-转变为有效成分NaCl,因此清除Ca2+一般选用Na2CO3溶液,有关的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl。
清除MgCl2的除杂试剂,既要使Mg2+转变为易于清除的沉淀,又要使Cl-转变为有效成分NaCl,因此清除Mg2+一般选用NaOH溶液,有关的化学方程式为MgCl2+2NaOH=Mg(OH)2↓+2NaCl。
清除Na2SO4的除杂试剂,既要使SO2-4转变为易于清除的沉淀,又要使Na+转变为有效成分NaCl,因此清除SO2-4一般选用BaCl2溶液,有关的化学方程式为BaCl2+Na2SO4=BaSO4↓+2NaCl。
若从简化操作方面考虑,也可以使用Ba(OH)2溶液代替NaOH和BaCl2溶液,因为它既可以清除Na2SO4,还可以清除MgCl2,有关的化学方程式为Ba(OH)2+Na2SO4=BaSO4↓+2NaOH,Ba(OH)2+MgCl2=Mg(OH)2↓+BaCl2。
因为每一步的除杂试剂都必须稍微过量(确保杂质被彻底清除),那么,在BaCl2溶液、Na2CO3溶液、NaOH溶液这几种除杂试剂中,最后加入的除杂试剂肯定还需要外加一种试剂来清除。为了简化操作,这种试剂的过量部分应该容易清除(无需外加试剂,可利用蒸发等操作清除)。显然,应该选择含有Cl-的酸,即盐酸(因为后续的蒸发结晶操作,不仅能除去水,HCl也会随之挥发)。
2.除杂试剂的加入顺序
既然盐酸要最后加入,那么,在BaCl2溶液、Na2CO3溶液、NaOH溶液这几种除杂试剂中,最后加入的那种除杂试剂一定能被盐酸反应,所以与盐酸不反应的BaCl2溶液不能在加入盐酸的前一步加入。因为每一步的除杂试剂都是过量的,因此,后加入的除杂试剂,不仅要除去相关的杂质,还要把先前加入的除杂试剂的过量部分也彻底清除。因此,Na2CO3溶液必须在BaCl2溶液的后面加入,这样Na2CO3既能清除杂质CaCl2,又能清除过量的BaCl2。
3.几种具体的除杂方案
第Ⅰ种方案:加过量BaCl2溶液(完全除去Na2SO4,引入少量杂质BaCl2)→加过量Na2CO3溶液(完全除去CaCl2和BaCl2,引入少量杂质Na2CO3)→加过量NaOH溶液(完全除去MgCl2,少量杂质Na2CO3没有清除,又引入少量杂质NaOH)→加过量盐酸(完全除去Na2CO3和NaOH,引入少量杂质HCl)→过滤(除去沉淀)、蒸发(除去H2O和HCl),得到精盐。endprint
第Ⅱ种方案:加过量BaCl2溶液(完全除去Na2SO4,引入少量杂质BaCl2)→加过量NaOH溶液(完全除去MgCl2,少量杂质BaCl2没有清除,又引入少量杂质NaOH)→加过量Na2CO3溶液(完全除去CaCl2和BaCl2,引入少量杂质Na2CO3)→加过量盐酸(完全除去Na2CO3和NaOH,引入少量杂质HCl)→过滤(除去沉淀)、蒸发(除去H2O和HCl),得到精盐。
第Ⅲ种方案:加过量NaOH溶液(完全除去MgCl2,引入少量杂质NaOH)→加过量BaCl2溶液(完全除去Na2SO4,少量杂质NaOH没有清除,还引入少量杂质BaCl2)→加过量Na2CO3溶液(完全除去CaCl2和BaCl2,少量杂质NaOH没有清除,还引入少量杂质Na2CO3)→加过量盐酸(完全除去Na2CO3和NaOH,引入少量杂质HCl)→过滤(除去沉淀)、蒸发(除去H2O和HCl),得到精盐。
三、疑难解答
1.能否采用降温法将氯化钠溶液浓缩
氯化钠的溶解度受温度影响变化不大,其高温饱和溶液降温后,析出氯化钠晶体的量少,大部分还溶解在水中。另一方面,降温后氯化钠的饱和溶液的浓度小于其高温下饱和溶液的浓度,降温后溶液浓度反而减小。所以,不能通过降低溶液温度的方法来达到使其溶液浓缩的目的。
2.在粗盐提纯实验中玻璃棒的作用
在溶解、过滤、蒸发实验操作中都用到了玻璃棒,“溶解”时,玻璃棒起着搅拌的作用,可以加快氯化钠等可溶性物质的溶解速率,以及确保可溶性物质的充分溶解;“过滤”时,玻璃棒起着引流的作用;“蒸发”时,玻璃棒起着搅拌的作用,使滤液受热均匀,防止滤液局部受热,造成液滴飞溅。
3.造成产率偏低或偏高的原因
造成产率偏低的原因主要有:①溶解时没有将粗盐完全放入烧杯;②粗盐没有完全溶解就进行过滤;③滤渣没有充分洗涤;④烧杯中的洗涤液被丟弃;⑤过滤时溶液没有完全加到过滤器中过滤;⑥蒸发时有部分氯化钠溶液飞溅出去;⑦提纯的食盐没有完全转移到纸上进行称量。
造成产率偏高的原因主要有:①过滤时得到的滤液浑浊,没有进行二次过滤就进行蒸发;②蒸发时提纯的食盐未完全干燥就进行称量。
四、例题导学
【例1】(2015·兰州)某同学对含有泥沙的粗盐进行提纯,并用提纯后的氯化钠配制100 g质量分数为5%的氯化钠溶液。请回答有关问题。
(1)按下面的步骤提纯粗盐:①取一定质量的粗盐样品,加水溶解;②通过操作将泥沙除去;③将滤液移入蒸发皿,蒸发结晶,得到氯化钠晶体。
(2)在上述实验步骤中,都使用的同一种仪器是(填名称),它在步骤①和③的操作方法相同,但目的不同,步骤①的目的是,步骤③的目的是。
(3)利用上述实验得到的氯化钠晶体,配制100 g质量分数5%的氯化钠溶液:①配制溶液的步骤:计算、、溶解、装瓶;②量取所需的水,应选用mL的量筒。
【解析】(1)粗盐提纯的主要步骤是溶解、过滤、蒸发等,其中过滤操作可将不溶性的泥沙除去。(2)溶解、过滤、蒸发都要用到玻璃棒,在步骤①中玻璃棒用于搅拌,以加快粗盐溶解速率,在步骤③中也用于搅拌,但目的是使滤液蒸发时受热均匀,防止液滴飞溅。(3)配制溶液的主要步骤是计算、称量、溶解、装瓶等;本实验中需要量取95 mL的水,所以应选择量程为100 mL的量筒。
【答案】(1)过滤(2)玻璃棒加快粗盐溶解速率搅拌散热,防止液滴飞溅(3)①称量
②100
【例2】为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中错误的操作顺序是()
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.④②⑤①③B.⑤④②①③
C.②⑤④①③D.⑤②④①③
【解析】粗盐中不仅含有不溶性泥沙,还含有可溶性杂质(所含杂质离子分别是SO2-4、Mg2+、Ca2+)。根据复分解反应发生的条件可知,Mg2+用NaOH除去,SO2-4用BaCl2除去,Ca2+用Na2CO3除去。因为每一步的除杂试剂都是过量的,因此,后加入的除杂试剂,不仅要除去相关的杂质,有时还要把先前加入的除杂试剂的过量部分也顺便清除,像Na2CO3就必须在BaCl2的后面加入,这样Na2CO3既能清除杂质CaCl2,又能清除过量的BaCl2。NaOH、NaCO3这两种除杂试剂的过量部分,最后用盐酸除去(因为盐酸即使过量,在蒸发时也会自行挥发)。既然盐酸是最后加入的除杂试剂,那么,BaCl2溶液、Na2CO3溶液、NaOH溶液这三种除杂试剂中,最后加入的那种除杂试剂一定要能被盐酸反应,所以与盐酸不反应的BaCl2溶液不能在加入盐酸的前一步加入。综上,除杂试剂的加入顺序有:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。另外,整个提纯操作还要考虑过滤,一般在加入盐酸之前过滤。
【答案】A
五、对点训练
1.判断下列说法,不正确的是()
A.使氯化钠从溶液中结晶出来,只能采用蒸发溶剂法
B.降低饱和溶液的温度,不一定都有晶体析出
C.使硝酸钾从溶液中析出一般采用降温结晶法
D.粗盐的提纯用结晶法便能达到目的
2.在粗盐提纯的实验中,下列操作正确的是()
3.要从KMnO4完全分解后的残留固体中分离出K2MnO4,正确的操作顺序是()
A.过滤→溶解→蒸发
B.溶解→蒸发→过滤endprint
C.过滤→蒸发→溶解
D.溶解→过滤→蒸发
4.据《说文解字》记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是()
A.日晒风吹使海水中的氯化钠蒸发
B.日晒风吹使溶液由饱和变为不饱和
C.日晒风吹使水分蒸发、晶体析出
D.日晒风吹使氯化钠的溶解度变小
5.为了除去粗盐中的Ca2+、Mg2+、SO2-4等离子,可将粗盐溶于水后进行如下操作:①加入适量盐酸;②加过量NaOH溶液;③加过量Na2CO3溶液;④加过量BaCl2溶液;⑤过滤。下列操作顺序合理的是()
A.②③④⑤①B.②④③⑤①
C.④②③①⑤D.④③②①⑤
6.加热氯酸钾和二氧化锰混合物制取氧气后,留下残渣,从残渣中回收氯化钾,操作见图1。
(1)可以把浊液中的难溶物除去的是(填字母,下同) ,其中玻璃棒的作用是;可以从溶液中获得氯化钾固体的是,其中玻璃棒的作用是。
(2)图示操作步骤的正确顺序为。
(3)C步骤中,当蒸发皿内出现较多固体时,应该。
A.移去酒精灯,停止搅拌
B.移去酒精灯,用玻璃棒继续搅拌
C.继续加热蒸干水分,再移去酒精灯
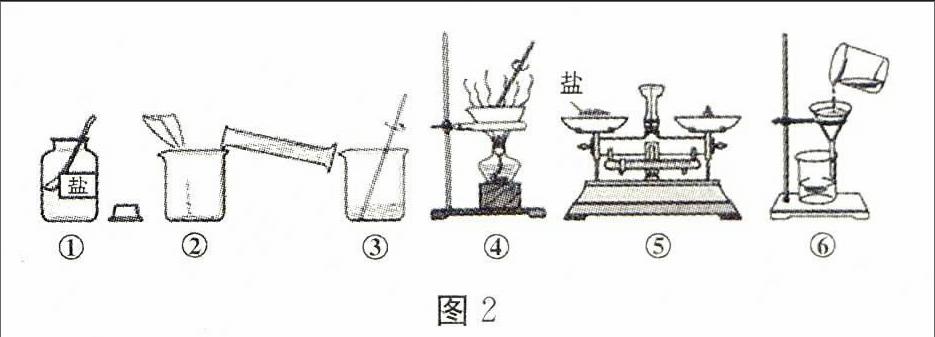
7.某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,操作见图2。
请回答下列问题。
(1)操作③中用玻璃棒搅拌的作用是。
(2)操作⑥中的错误是。
(3)粗盐提纯实验的操作顺序为(填操作序号)、 称量精盐并计算产率。
(4)操作④中,当观察到时,停止加热。
8.四川省遂宁市大英县境内的卓筒井是手工制盐的活化石,被誉为“中国古代第五大发明”“世界石油钻井之父”,不仅是古代劳动人民勤劳、智慧的象征,也造福了千秋万代。其工艺流程包括下面五个步骤:
请结合所学化学知识,回答下列问题。
(1)第②步汲出的卤水浑浊,浓度一般在7~10度(即溶质质量分数为7%~10%,下同),这样的卤水碱度低,耗燃料,成本高,为了把卤水浓度提高到18~20度,就产生了“晒卤”这一环节。在“晒卤”的过程中,溶液中溶质的质量分数(填“不变”“变大”或“变小”)。
(2)第④步“滤卤”和实验室“过滤”的原理一样,都是为了除去液体中的杂质。
(3)第⑤步“煎盐”和实验室(填结晶的方法)结晶的原理相同。
9.同学们称量了5 g粗盐,在老师的指导下经过提纯操作,得到了较纯的精盐。请回答下列问题。
(1)仪器B的名称是;在除去不溶性杂质实验中,用的最多的仪器是(填字母)。
(2)“活动与探究”中,他们称取5.0 g粗盐,用药匙逐步加入10 mL水中,直到粗盐不再溶解为止。还需要进行的实验步骤的顺序为:称量剩余粗盐、(填序号)。
①过滤②计算产率③蒸发④称量精盐
(3)称量时,食盐应放在仪器A的盘。
(4)过滤操作如图G所示,指出其中的错误之处:,,,。
10.“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。某同学设计了除去三种可溶性杂质的实验方案:
先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。
部分物质的溶解性表(室温)
OH-Cl-SO2-4CO2-3
H+溶、挥溶溶、挥
Ba2+溶溶不溶不溶
Ca2+微溶溶微溶不溶
Mg2+不溶溶溶微溶
请参考上表回答:
(1)溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
(2)加入Na2CO3溶液的目的是什么?
(3)以上方案还需完善,请说明原因并加以补充。
11.工业上利用太阳能进行海水晒盐。已知海水蒸发浓缩过程中析出盐的种类和质量如下表:
(1)海水从密度为1.21 g/mL浓缩到1.22 g/mL时,发生的变化是(填字母,下同)。
A.各种盐的溶解度增大
B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大
D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是。实际晒盐生产中,海水的密度一般控制在1.21~1.26 g/mL范围内,由上表可知,所得粗盐中含有的杂质离子有。
12.浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔。探究学习小组以含有Ca2+、Mg2+、Cl-的卤水和贝壳(主要成分为CaCO3)为主要原料,在实验室中制备无水CaCl2。流程如下:
请回答下列问题。
(1)操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒、。
(2)以MgCl2为例,写出卤水中除去Mg2+时发生反应的化学方程式:。
(3)操作Ⅱ酸化时,应选择的酸是(填化学式)。
(4)上述反应中未涉及的基本反应类型是(填字母)。
a.复分解反应b.置换反应
c.化合反应d.分解反应
(5)回收的CO2在紫外光照射和催化剂作用下能与水蒸气反应,生成CH4和O2。该反应的化学方程式为。紫外光照射时,在不同催化剂(①②③)的作用下,CH4产量随光照射时间的变化如图6所示,在第10小时时,CH4产量最高的是(填“①”“②”或“③”)。
(6)已知T ℃时四种化合物在水中和液氨中的溶解度如下表:
AgNO3Ba(NO3)2AgClBaCl2
H2O(液)170 g92.0 g1.5 g33.3 g
NH3(液)86.0 g97.2 g0.8 g0.0 g
上述四种物质,能在液氨中发生复分解反应的化学方程式为。
附:对点训练参考答案
1.D2.B3.D4.C5.B
6.(1)A引流C搅拌,防止液体局部过热,造成液滴飞溅(2)BAC(3)B
7.(1)加速溶解(2)未用玻璃棒引流(3)①⑤②③⑥④(4)出现较多固体
8.(1)变大(2)不溶性(3)蒸发
9.(1)漏斗F(2)①③④②(3)左
(4)没有用玻璃棒引流滤纸的高度超过漏斗边缘滤纸没有紧贴漏斗内壁漏斗的尖端没有紧靠烧杯B的内壁
10.(1)用玻璃棒不断搅拌,防止液体局部过热,造成液滴飞溅。(2)除去CaCl2杂质和过量的BaCl2。(3)过量的NaOH和Na2CO3未除去,还应在过滤后加入适量的盐酸。
11.(1)C(2)CaSO4Ca2+、Mg2+、SO2-4、Br-
12.(1)漏斗(2)MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2(3)HCl(4)b(5)CO2+2H2O紫外线催化剂CH4+2O2②(6)Ba(NO3)2+2AgCl=2AgNO3+BaCl2↓endprint

