机械通气相关性肺损伤大鼠模型的建立与评价
任俊明 郭永清

[摘要] 目的 建立机械通气相关性肺损伤大鼠模型并进行评价,确定建立机械通气相关性肺损伤大鼠模型的最适通气条件。 方法 选取成年雄性SD大鼠72只,体重250~300 g,随机分为A、B、C、D组(n=18):对照组(A 组,自主呼吸组),小潮气量(VT)组(B组,VT=6 ml/kg),常规VT组(C组,VT=10 ml/kg),大VT组(D组,VT=40 ml/kg),各组按机械通气时间(2、4、6 h)再随机分为3个亚组(n=6)。A组仅作气管切开插管,其余各组气管切开后接小动物呼吸机行机械通气,呼吸机参数均设置为RR 70/min,FiO2 21%,PEEP 0 cmH2O。机械通气结束后处死大鼠,剖胸取右肺组织计算湿重干重比(W/D),计算细胞凋亡指数,HE染色后光镜下观察肺组织病理学结果,并进行肺损伤评分。比较不同VT及通气时间条件下大鼠的肺损伤情况。 结果 与A、B、C组比较,D组通气2 h时开始出现肺损伤病理学表现,通气4 h时肺损伤评分、肺组织W/D和细胞凋亡指数均升高,差异有统计学意义(P<0.05)。 结论 给予大鼠40 ml/kg VT通气4 h可以成功建立机械通气相关性肺损伤模型。
[关键词] 机械通气相关性肺损伤;机械通气;动物模型;大鼠
[中图分类号] R332 [文献标识码] A [文章编号] 1674-4721(2016)02(c)-0011-04
[Abstract] Objective To establish and evaluate the rat model of ventilator-induced lung injury,and to determine the best ventilation condition of rat model of ventilator-induced lung injury. Methods 72 adult male SD rat were selected,weight was 250-300 g,and they were randomly divided into group A,B,C and D (n=18).Control group (group A,spontaneous breathing group),low tidal volume group (group B,VT=6 ml/kg),routine tidal volume group (group C,VT=10 ml/kg) and high tidal volume group (group D,VT=40 ml/kg).Each group was divided into 3 subgroups (n=6) according to duration of mechanical ventilation (2 h,4 h and 6 h).group A was only given tracheotomy tube,the others were given small animal breathing machine to conduct mechanical ventilation after tracheotomy.The parameter of breathing machine was set as RR 70/min,FiO2 was 21%,PEEP was 0 cmH2O.The rat were sacrificed after the end of mechanical ventilation,W/D of right lung tissue taken by splitting chest was counted and cell apoptosis index was counted.The pathology results of lung tissue were observed under light microscope after HE staining.The score of lung damage was valued.Lung damage of rat at different tidal volume and duration of ventilation was compared. Results Compared with group A,B and C,lung damage pathology feature appeared after 2 h ventilation in group D and all of the lung damage score,W/D of lung tissue and cell apoptosis index was increased respectively,and the difference was statistical significance (P<0.05). Conclusion Rat is given 40 ml/kg of tidal volume and ventilation for 4 h can establish the model of ventilator-induced lung injury successfully.
[Key words] Ventilator-induced lung injury;Mechanical ventilation;Animal model;Rat
机械通气(mechanical ventilation,MV)在危重患者的救治和麻醉维持过程中起重要作用,然而MV使用不当本身可以诱发严重肺损伤[1]。MV过程中较高的潮气量(VT)可以损害肺泡-毛细血管黏膜屏障,破坏肺组织内皮细胞和上皮细胞增加其通透性[2],同时机械刺激导致肺泡内炎症细胞募集活化并释放炎症介质和细胞因子从而引起肺损伤[3]。目前,国内外肺损伤动物模型制备多选择鼠类、兔类、犬类、绵羊等动物,其中鼠类具有经济性、细胞生物学角色的可用性等优点使其在肺损伤模型建立研究中运用较多[4-5]。本研究主要比较不同VT及通气时间条件下大鼠的肺损伤情况,确定建立MV所致肺损伤大鼠模型的最适通气条件。
1 材料与方法
1.1 实验动物
选取健康的成年清洁级雄性SD大鼠72只,体重250~300 g,由北京海淀兴旺动物养殖场提供。
1.2 仪器与试剂
HX-300动物呼吸机(成都,泰盟);动物天平-YB102(中国,海康);电热鼓风干燥箱(上海,精宏);细胞凋亡检测试剂盒(武汉博士德生物工程有限公司);戊巴比妥(西安沃尔森生物技术有限公司)。
1.3 方法
1.3.1 动物准备 用2%戊巴比妥钠(50 mg/kg)溶液进行腹腔注射麻醉,待麻醉起效后给予称重、固定架体位固定。颈部皮肤备皮、碘伏消毒,用手术刀沿气管长轴切约1.0 cm皮肤切口,同时用止血钳钝性分离切口下皮肤组织和肌肉,暴露大鼠气管。将自制14G气管导管缓慢刺入气管向前推进1.0 cm、拔出管芯,通气确定在主气管内手术缝线固定套管后接小动物呼吸机行MV,四肢连接生物机能监护仪持续进行心电图监测。行尾静脉穿刺保持静脉通畅;整个过程中维持室温26~28℃。实验中按大鼠出血量和生理需要量维持输液[1 ml/(kg·h)生理盐水][6]。
1.3.2 动物分组 将大鼠随机分为A、B、C、D组(n=18),予以不同VT和通气时间。对照组(A 组,自主呼吸组),小VT组(B组,VT=6 ml/kg),常规VT组(C组,VT=10 ml/kg),大VT组(D组,VT=40 ml/kg),每组18只,各组分别按通气时间(2、4、6 h)再随机分为3个亚组,每个亚组各 6 只大鼠。A组仅作气管切开插管,其余各组气管切开后接小动物呼吸机行MV,B、C、D组呼吸机参数均设置为RR 70/min,FiO2 21%,PEEP 0 cmH2O。
1.4 检测指标
实验中观察心电图,通气结束即刻处死动物。剖胸取右侧肺组织计算湿重干重比(W/D),另一侧肺做病理学及细胞学凋亡检测。
1.4.1 血流动力学指标 连续观察心电图变化、心率。
1.4.2 肺组织 W/D 取大鼠右肺组织,先称湿重,再放置于电热鼓风干燥箱中,干燥箱温度设定为80℃,恒温烘烤直到肺组织至恒重后称肺干重,然后计算肺组织 W/D。
1.4.3 肺组织病理学检查 取部分左肺组织用4%多聚甲醛溶液固定,经过石蜡包埋、切片、HE染色等处理后,置于光学显微镜下观察肺泡及毛细血管充血、肺内出血、中性粒细胞在血管壁及肺间隙浸润、肺泡壁增厚或者透明膜形成以上四项进行肺损伤评分。采用3分制计分:无改变0分,轻度改变1分,中度改变2分,重度改变3分,然后累计总分。每个标本选取5个高倍视野,评分后取其均值。
1.4.4 TUNEL法检测肺组织细胞凋亡程度 经过TUNEL染色的肺组织细胞若细胞核内出现棕黄色颗粒即为阳性结果,置于高倍镜下(×400)随机选取5个不重复视野,计数100个细胞中TUNEL阳性细胞数,计算细胞凋亡指数。
1.5 统计学处理
采用SPSS 19.0软件进行统计分析,计量资料用均数±标准差(x±s)表示,不同组别、组内不同时间点间比较采用方差分析,用Bartlett检验进行方差齐性检验,满足方差齐性则用LSD做两两比较,若不满足方差齐性则采用Dunnet检验,以P<0.05为差异有统计学意义。
2 结果
2.1 肺的病理学改变
肉眼观察可见,A、B组肺组织未见明显的损伤改变,C组通气6 h时可见肺组织出现中度充血、水肿,横切面可见不规则淤血区。D组在通气2 h后可见肺组织水肿充血明显,通气4 h后肺表面出现大量出血点,通气6 h后出血点形成不规则片状。经HE染色后光镜下可见A、B组病理形态大致正常,C组通气6 h出现肺内轻度出血、肺泡壁轻度增厚并有透明膜形成。D组2 h即可见肺内弥散存在出血点,通气4 h时可见大量散在出血点,肺泡间隔增宽,肺泡腔渗液较多,通气6 h肺组织结构完全破坏,肺泡发生融合,肺组织实变。C、D肺组织损伤程度随通气时间的增加而加剧(图1)。
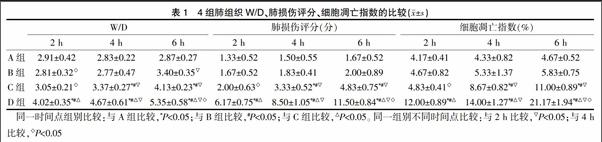
2.2 4组肺组织W/D、肺损伤评分及细胞凋亡指数的比较
与A组比较,C、D组肺组织 W/D、肺损伤评分及细胞凋亡指数随着通气时间的增加均明显升高(P<0.05),B组上述各项指标差异无统计学意义(P>0.05)。C、D组内3个时间点肺组织 W/D、肺损伤评分及细胞凋亡指数值均随时间的变化明显升高(P<0.05),A组上述各项指标差异无统计学意义(P>0.05)(表1)。
3 讨论
危重患者在呼吸机的支持治疗中常并发机械通气相关性肺损伤(VILI)。目前,国内外研究认为,VILI的发生主要由于呼吸机参数设置不当,即较高气道压或容量导致吸气末肺组织的过度扩张而呼气末肺容积过低使不张的终末小气道和肺泡随机械通气周期性地开放和关闭[7],从而导致机械性肺损伤的发生。有的研究也发现,随着通气时间的增加,肺损伤的趋势也越来越明显[8]。临床工作中主要是通过改变呼吸机通气模式和通气策略来避免VILI的发生,但是至今对于呼吸机通气模式的设置没有达成明确的共识,本研究通过动物肺损伤模型制备来寻找最适通气模式。
目前,国内外研究中常见的机械通气肺损伤动物模型制备方法有两种:一是在压力控制通气模式下给予较高的吸气压力导致肺损伤的发生,2015年,Yang等[9]研究发现,给予大鼠吸气压力10 cmH2O,PEEP=0 cmH2O,RR 50/min,通气4 h后可以复制大鼠肺损伤的发生。Dreyfuss等[10]的研究也证实,给予家兔45 cmH2O的吸气压力,MV过程中会很快出现肺损伤的表现。该方法的缺点是吸气压力大小的设置不好确定,没有明确的文献支持,没有找出导致肺损伤发生的最佳吸气压力值[11-12],此类方法在实验研究中运用较少。二是容量控制通气模式下给予大VT的MV,随着时间的增加肺损伤程度逐渐加重。Huang等[13]的研究发现,当VT设定为30 ml/kg,RR 25/min,FiO2=21%,通气2 h即可出现肺损伤,这说明VT和通气时间是导致肺损伤发生的关键因素[14-16]。
本研究中比较了不同VT(6、10、40 ml/kg)和不同通气时间(2、4、6 h)条件下肺损伤的发生程度,同时通过肺损伤评分、细胞凋亡指数、光镜下病理结果来评价VILI模型建立的成功与否。结果发现,给予VT 40 ml/kg通气2 h时光镜下可见大鼠肺内点状出血点,肺泡腔内渗出液增多。通气4 h后可见肺内大量散在出血点,肺泡间隔增宽肺泡膜增厚,肺泡腔内大量渗出液,部分肺泡破裂融合。通气6 h后肺组织结构完全破坏。同时随着VT的增大和通气时间的增加,肺损伤评分及细胞凋亡指数在增高也说明了肺损伤程度的加重。相比之下,VT=6 ml/kg通气组大鼠肺组织没有出现肺泡水肿、炎症渗出等急性肺损伤表现。VT=10 ml/kg通气组大鼠在通气6 h后可见有轻度肺内出血点、肺泡壁轻度增厚表现。综上所述可以得出结论:VT=40 ml/kg通气2 h即可导致肺损伤,通气4 h可稳定建立大鼠MV所致肺损伤大鼠模型。
本研究中给予大鼠小VT(VT=6 ml/kg)通气大鼠可以存活数小时甚至数天,小潮气量对大鼠肺部的损伤是极其缓慢的。相比之下,给予大VT(VT=40 ml/kg)通气的大鼠肺损伤发展较快数小时内即可出现典型的肺损伤表现,因此建立大鼠VILI模型需要给予合适的VT和通气时间,本实验成功建立了大鼠VILI模型,为今后从事相关肺损伤的研究提供了动物学模型的参考依据。
[参考文献]
[1] Kuchnicka K,Maciejewski D.Ventilator-associated lung injury[J].Anaesthesiol Intensive Ther,2013,45(3):164-170.
[2] Albaiceta GM,Blanch L.Beyond volutrauma in ARDS:the critical role of lung tissue deformation[J].Crit Care,2011,15(2):304.
[3] de Prost N,Ricard JD,Saumon G,et al.Ventilator-induced lung injury:historical perspectives and clinical implications[J].Ann Intensive Care,2011,1(1):28.
[4] Schouten LR,Schultz MJ,van Kaam AH,et al.Association between maturation and aging and pulmonary responses in animal models of lung injury:a systematic review[J].Anesthesiology,2015,123(2):389-408.
[5] Beurskens CJ,Aslami H,de Beer FM,et al.Mechanical ventilation with heliox in an animal model of acute respiratory distress syndrome[J].Intensive Care Med Exp,2014,2(1):8.
[6] Xie J,Lv R,Yu L,et al.Hydroxyethyl starch 130/0.4 exerts its anti-inflammatory effect in endotoxemic rats by inhibiting the TLR4/NF-kappaB signaling pathway[J].Ann Clin Lab Sci,2010,40(3):240-246.
[7] Jaecklin T,Engelberts D,Otulakowski G,et al.Lung-derived soluble mediators are pathogenic in ventilator-induced lung injury[J].Am J Physiol Lung Cell Mol Physiol,2011, 300(4):L648-L658.
[8] Rehan VK,Fong J,Lee R,et al.Mechanism of reduced lung injury by high-frequency nasal ventilation in a preterm lamb model of neonatal chronic lung disease[J].Pediatr Res,2011,70(5):462-466.
[9] Yang SH,Lin JC,Wu SY,et al.Membrane translocation of IL-33 receptor in ventilator induced lung injury[J].PLoS One,2015,10(3):e0121391.
[10] Dreyfuss D,Ricard JD,Saumon G.On the physiologic and clinical relevance of lung-borne cytokines during ventilator-induced lung injury[J].Am J Respir Crit Care Med,2003,167(11):1467-1471.
[11] Gil Cano A,Monge García MI,Gracia Romero M,et al.Incidence,characteristics and outcome of barotrauma during open lung ventilation[J].Med Intensiva,2012,36(5):335-342.
[12] Del Sorbo L,Goffi A,Ranieri VM.Mechanical ventilation during acute lung injury:current recommendations and new concepts[J].Presse Med,2011,40(12 Pt 2):e569-e583.
[13] Huang LT,Chou HC,Wang LF,et al.Tissue plasminogen activator attenuates ventilator-induced lung injury in rats[J].Acta Pharmacol Sin,2012,33(8):991-997.
[14] Pastore CV,Pirrone F,Mazzola S,et al.Mechanical ventilation and volutrauma:study in vivo of a healthy pig model[J].Biol Res,2011,44(3):219-227.
[15] Biehl M,Kashiouris MG,Gajic O.Ventilator-induced lung injury:minimizing its impact in patients with or at risk for ARDS[J].Respir Care,2013,58(6):927-937.
[16] 刘龙,李新华,李强.减少呼吸机相关性肺损伤的新方法[J].中国现代医生,2014,52(4):157-160.
(收稿日期:2015-11-11 本文编辑:许俊琴)

