β-葡萄糖苷酶交联聚合物的制备及酶学性质
朱 春,程 倩,丁成新,贾建波,王朝宇
(淮阴工学院 生命科学与食品工程学院,江苏 淮安 223003)
β-葡萄糖苷酶交联聚合物的制备及酶学性质
朱春,程倩,丁成新,贾建波,王朝宇
(淮阴工学院 生命科学与食品工程学院,江苏 淮安 223003)
摘要:对来源于黑布林的β-葡萄糖苷酶进行了交联法制备(CLEAs),并对其酶学性质进行了初步研究。结果发现,当异丙醇为蛋白沉降剂时CLEAs的酶活回收率最高达58.9%;该聚合酶的最适温度为55℃,显示出良好的温度耐受性;CLEAs的Km、Vmax和Ki值分别为5.74 mM、203.4 μmol/(min·mg蛋白)和394.03 mM;此外,金属离子Hg2+、Ag+可显著降低CLEAs的酶活。
关键词:黑布林;β-葡萄糖苷酶;交联酶聚合物;酶学性质
0引言
β-葡萄糖苷酶(β-glucosidase,E.C.3.2.1.21)是纤维素酶系中的一个组分,属于水解酶类,由Liebig和Wohler[1]于1837年首次在苦杏仁中发现,可水解各类β-葡萄糖苷、二糖及低聚糖糖苷键从而释放出末端非还原性葡萄糖基。目前已知,β-葡萄糖苷酶广泛存在于自然界中,相对于动物和微生物来源的β-葡萄糖苷酶而言,植物源的β-葡萄糖苷酶被认为具有更为广泛的生理功能,包括参与植物细胞壁的降解、木质化作用;糖苷类化合物的合成;植物激素的共价激活、宿主防御及香味前体的水解作用等[2-3]。研究者已从大豆、马蓝叶、荞麦、西梅籽,莲子等植物中均分离得到了高活性的β-葡萄糖苷酶[4-7]。
固定化技术作为提高酶稳定性和重复利用性的主要工程手段被广泛研究[8],其中交联法被广泛使用。CLEAs的概念由Sheldon课题组[9]于2000年首次提出,其制备过程是先将溶液态酶形成物理聚集体而沉降,利用戊二醛将沉降物进行交联既可形成CLEAs[10]。CLEAs的制备不需要繁琐而复杂的结晶过程,制备过程简单,无载体,原料廉价,使得这一固定化技术展现出了广阔的应用前景和研究价值。本文对来源于黑布林的β-葡萄糖苷酶进行了交联聚合,并对该酶聚合物的性质和动力学特性进行了研究,为该酶的固定化应用提供理论依据。
1材料与方法
1.1试验材料
黑布林购于当地市场,对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)和对硝基苯酚购于上海晶纯生化科技股份有限公司,其他试剂均为分析纯。
1.2β-葡萄糖苷酶的制备
将黑布林籽去壳,研磨粉碎,洗涤脱脂后得到粗酶粉,过60目筛后经磷酸盐缓冲溶液抽提得到粗酶液,再经硫酸铵分级沉淀、柱层析分离纯化,得到β-葡萄糖苷酶。
1.3β-葡萄糖苷酶CLEAs制备
取适量处理后的酶液,加入预冷后的沉降剂,温和搅拌10 min,加入适量的交联剂戊二醛,交联一定的时间后,用适量缓冲溶液淬灭反应,在低温下离心、洗涤沉淀,制得CLEAs。
在施工安装过程中,闸首卧倒门支铰座螺栓联结采用A2-70-M36螺栓,预紧力矩为1 233 N·m[11]。根据T=K2FPd,取K2=0.2,则预紧力为171.25 kN。显然,该预紧力小于实际计算所需的预紧力,不能满足要求,这也是卧倒门支铰座螺栓联结松动的原因之一。
1.4β-葡萄糖苷酶酶活力测定方法
将一定量CLEAs置于2.9mL的50mM,pH7.0的柠檬酸-Na2HPO4缓冲液中,45℃下孵育3 min后向体系中加入15.0μL pNPG(pNPG溶解于DMSO中,浓度为200mM)启动反应,总的反应体积为3.0mL。反应5min后,加入1.0M的Na2CO3溶液3.0 mL终止反应,并立即读取反应液在405 nm的吸光值。1个酶活单位定义为:在上述测试条件下,1 min内β-葡萄糖苷酶水解释放1 μmol对硝基苯酚所需要的酶量。
1.5沉降剂对CLEAs的影响
按照β-葡萄糖苷酶CLEAs的制备方法,各取1.0 mL处理后的酶液,加入4.0 mL预冷后的不同种类的沉降剂(正丙醇、异丙醇、正丁醇、异戊醇、乙腈)交联后离心、洗涤。将沉淀重悬于1.0mL、50mM柠檬酸-Na2HPO4缓冲溶液中。以未被交联的酶液的酶活力作为对照,测定β-葡萄糖苷酶CLEAs的剩余活力。
1.6温度对酶活性的影响
将一定量的CLEAs加入到柠檬酸-Na2HPO4缓冲溶液(50mM,pH7.0)中,并分别于25-80℃的条件下孵育3min,加入底物pNPG启动反应,按照前述的酶活测定方法进行测定。
1.7温度对酶稳定性的影响
将一定量的CLEAs分别在45℃、50℃、55℃和60℃下进行孵育,在0-480min内间隔取样,按照前述的酶活测定方法测定CLEAs的残余活力,以未经孵育时的酶活作为对照,其活力定义为100%,其余的活力均采用相对活力表示。
1.8动力学参数及抑制常数的测定
在45℃条件下,以pNPG作为酶促水解反应的底物,其在50mM柠檬酸-Na2HPO4(pH7.0)缓冲液中的在浓度范围为0.33-8.61mM,Km和Vmax值通过双倒数作图法得到。葡萄糖在上述缓冲溶液中的浓度范围为48.7-496.7mM,在底物pNPG浓度分别为1.32mM和5.19mM的条件下测定该酶的活力大小,葡萄糖对β-葡萄糖苷酶活力的抑制作用通过测定抑制常数Ki进行表征,并通过Dixon法作图得到。
1.9金属离子及化学试剂对CLEAs活性的影响
将CLEAs与不同种类的金属阳离子于4℃条件下共同孵育1.0h后测定其残余活力;在含有CLEAs的反应体系中加入一定量的化学试剂后,直接测定酶的残余活力。以不添加任何金属离子及化学试剂时的酶活大小作为对照,其活力定义为100%,其余的活力值均采用相对活力给出。
2结果与分析
2.1沉降剂对酶活性的影响
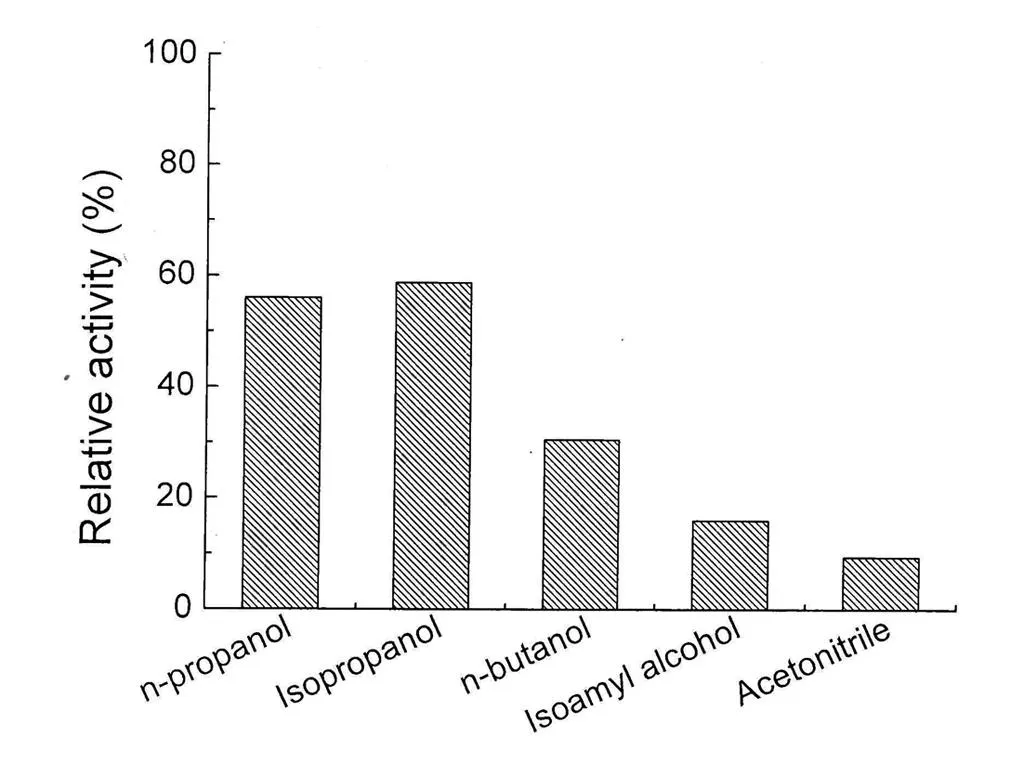
图1不同沉降剂对CLEAs的影响
沉淀剂的作用是使得溶液状态的酶形成物理聚集,以便从溶液中析出。水溶性的有机溶剂、盐类等常常可以作为沉淀剂使用[11]。良好的沉淀剂应该使溶液状态的酶完全析出,并且对酶的活性没有影响,因此选择合适的沉降剂对β-葡萄糖苷酶CLEAs的制备很重要。为了筛选到合适的沉降剂,选择了不同种类的沉降剂进行试验,交联酶聚合物制备完成后,测定其残余活力如图1所示。当乙腈作为沉降剂时,对酶的活力有严重的损伤,形成的β-葡萄糖苷酶CLEAs残余活力仅为9.5%,另外正丁醇和异戊醇作为沉淀剂时,酶活的回收率也不高分别为30.5%和16.0%。而当正丙醇和异丙醇作为沉降剂时,β-葡萄糖苷酶CLEAs的酶活回收率则达到56.1%和58.9%,表明这两种醇类沉降剂对酶活力的损伤相对较小,特别是异丙醇,适合作为沉降剂使用。
2.2温度对酶活性的影响
温度会显著影响酶的催化活性和酶促反应进程。在一定温度范围内,随着反应温度升高,分子热运动加剧,酶促反应速度会不断加快;当温度过高时,部分酶蛋白开始变性失活,导致酶的活性显著下降。由图2可知,随着温度的升高逐渐升至55℃,酶的活性不断增加,为CLEAs的最适反应温度;进一步增加反应温度,酶活性不断下降,当温度达到80℃,酶活性几乎完全丧失。同时,结果还表明,经固定化处理形成的β-葡萄糖苷酶CLEAs对温度具有较好的耐受性,在40-60℃的范围内保持了60%以上的相对酶活力。
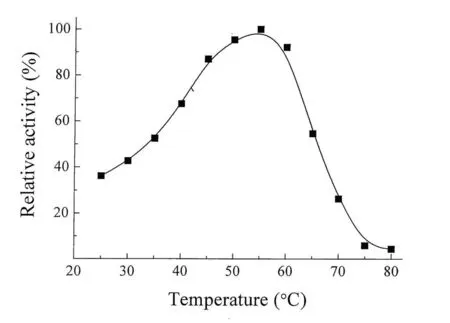
图2温度对CLEAs活性的影响

图3CLEAs的热稳定性
2.3CLEAs的热稳定性研究
酶的操作稳定性是固定化酶的重要特性之一,直接影响着连续化、自动化生产过程及生产成本。将β-葡萄糖苷酶CLEAs在不同温度下(45-60℃)进行孵育,并间隔一定时间取样测定其残余活性,以考察CLEAs的热稳定性。结果如图3所示。在温度为45、50和55℃时CLEAs的活性呈缓慢下降的趋势,8 h后残余活性分别约为55%、38%和25%;当温度达到60℃时,其活性迅速下降,3 h后活性几乎消失。这可能是温度破坏了CLEAs的交联结构,使酶蛋白的空间结构发生变化,从而导致酶活性的显著降低。
2.4动力学研究

图4CLEAs的动力学参数
β-葡萄糖苷酶通常具有水解pNPG的活性,通过测定CLEAs的Km和Vmax值,可表征该酶聚合物对pNPG的亲和力及催化效率。根据双倒数作图法,由图4可知,该酶促水解反应的Km和Vmax值分别为5.74 mM和203.4 μmol/(min·mg蛋白),与来源于碧桃叶的β-葡萄糖苷酶相比较[12],来源于黑布林β-葡萄糖苷酶的CLEAs具有更低的Km值及更高的Vmax值,显示出该酶聚合物优异的底物特异性。
2.5抑制常数
对于β-葡萄糖苷酶而言,葡萄糖是常见的竞争性抑制剂,在工业应用中,葡萄糖耐受度是重要的考察指标,其耐受度越高就越具有应用潜力。以pNPG为底物,在不同底物浓度下,测定不同葡萄糖浓度对酶活力的影响,通过Dixon作图法求得抑制常数Ki值。如图5所示,葡萄糖对来源于黑布林籽的β-葡萄糖苷酶的抑制常数为394.03 mM。与大多数来源于微生物的β-葡萄糖苷酶相比,该酶具有较高的葡萄糖耐受度,因此在工业生产上有着潜在的应用前景。
2.6金属离子及化学试剂对CLEAs活性的影响
β-葡萄糖苷酶CLEAs加入到不同的金属离子和化学试剂溶液中孵育并测定其残余活力。以不添加任何金属离子及化学试剂的CLEAs酶活大小作为对照,其活力定义为100%,其余的活力值均采用相对活力给出,结果如下表1所示。由表可知,经固定化处理后的CLEAs能在金属离子和化学试剂中更好地维持酶活性。除了Hg2+、Ag+对β-葡萄糖苷酶CLEAs的伤害较大,其余金属离子和化学试剂对β-葡萄糖苷酶CLEAs的活性影响都比较小,说明该β-葡萄糖苷酶CLEAs有着很好的金属离子及化学试剂耐受性。
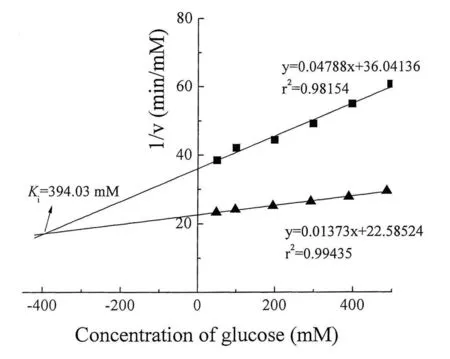
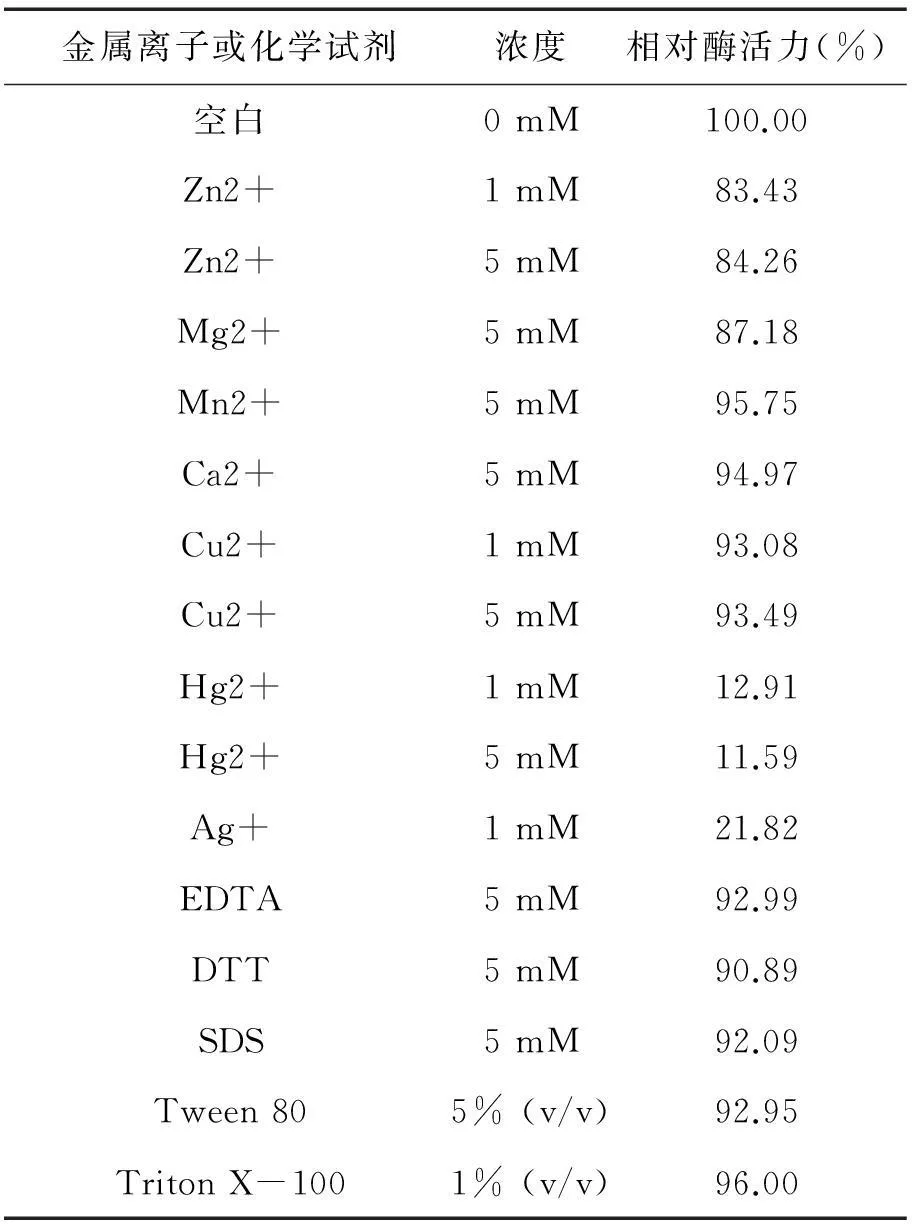
图5 CLEAs的抑制常数
3结论
来源于黑布林的β-葡萄糖苷酶经过沉降及戊二醛交联剂后制备了固定化的β-葡萄糖苷酶CLEAs。对其酶学性质的初步研究表明,CLEAs具有较宽的温度适应性及良好的热稳定性;酶促pNPG水解的动力学参数Km、Vmax及Ki及对金属离子的耐受性研究则展现了该酶聚合物更高的底物亲和性及更好的葡萄糖和金属离子耐受性,显示出该酶CLEAs良好的应用前景,也为β-葡萄糖苷酶的固定化应用提供了借鉴。
参考文献:
[1] Liebig J, Wohler F. Notiz über die bildung des bittermandelöls[J].Annalen der Pharmacie,1837(1):96-97.
[2] Ketudat Cairns J R, Esen A. β-Glucosidases[J].Cell. Mol. Life Sci.,2010(20):3389-3405.
[3] Zagrobelny M, Bak S, Mller B L. Cyanogenesis in plants and arthropods[J].Phytochemistry,2008(7):1457-1468.
[4] 张卓.荞麦中β-葡萄糖苷酶的分离提取及其酶促动力学的研究[D].吉林: 吉林农业大学, 2011.
[5] 刘泽玉, 苏柘僮, 杨明, 等. 马蓝叶中β-葡萄糖苷酶的提取及酶学性质的研究[J].中草药, 2010(9): 1461-1464.
[6] 张卓, 陈晓平. 荞麦中β-葡萄糖苷酶提取条件的研究[J].食品与发酵科技, 2010(6):19-21.
[7] Chen L, Li N, Zong M H. A glucose-tolerant β-glucosidase from Prunus domestica seeds: purification and characterization[J].Process Biochem., 2012(1):127-132.
[8] Hanefeld U, Cao L Q. Magner E.Enzyme immobilisation: fundamentals and application[J].Chem.Soc.Rev.,2013,42: 6211-6212.
[9] Cao L, Van rantwijk F., Sheldon R A. Cross-linked enzyme aggregates: a simple and effective method for the immobilization of penicillin acylase[J].Org. Lett.,2000(10):1361-1364.
[10] Sheldon R, Schoevaart R, Van langen L. Cross-linked enzyme aggregates (cleas): a novel and versatile method for enzyme immobilization (a review)[J].Biocatal. Biotransfor.,2005(3):141-147.
[11] Talekar S, Joshi A, Joshi G et al. Parameters in preparation and characterization of cross linked enzyme aggregates (CLEAs)[J]. RSC Adv., 2013(3): 12485-12511.
[12] 李志强, 廖祥儒, 陆芳. 碧桃(Prunus persica L.)叶中β-葡萄糖苷酶的分离纯化和某些特性分析[J]. 植物生理学通讯, 2007(2): 359-362.
(责任编辑:孙文彬)
β-Glucosidase CLEAs Preparation and its Enzymology Characteristics
ZHU Chun, CHENG Qian, DING Cheng-Xin, JIA Jian-Bo, WANG Zhao-Yu
(Faculty of Life Science and Food Engineering, Huaiyin Institute of Technology,Huai’an Jiangsu 223003, China)
Abstract:The cross-linked enzyme aggregates (CLEAs) were successful prepared based on the β-glucosidase form black plum seed and its enzymology characteristics were studied. The results revealed that the highest enzyme activity recovery of 58.9% was obtained when isopropyl alcohol was used as the sinking agent. The CLEAs displayed good thermal tolerance with the optimum temperature of 55℃. The Km, Vmax and Ki values of the CLEAs were 5.74 mM, 203.4 μmol/(min·mg protein) and 394.03 mM, respectively. Moreover, the influence of metal cations and reagents showed that Hg2+and Ag+ remarkably reduced the enzyme activity.
Key words:black plum; β-glucosidase; CLEAs; enzymology characteristics
中图分类号:TS201.2
文献标识码:A
文章编号:1009-7961(2016)01-0034-04
作者简介:朱春(1986-),男,江苏南京人,实验师,硕士,主要从事生物合成与生物转化的研究。
基金项目:国家自然科学基金(31501421);江苏省自然科学基金(BK2012243);江苏省生物质转化与过程集成工程实验室开放基金(JPELBCPL2013005)
收稿日期:2015-10-20

