阿托伐他汀对胰腺癌细胞PANC-1增殖、侵袭能力的影响及机制
李 晶,罗妙莎,秦 斌,王 琰,董 蕾
(西安交通大学第二附属医院消化内科,陕西西安 710004)
阿托伐他汀对胰腺癌细胞PANC-1增殖、侵袭能力的影响及机制
李 晶,罗妙莎,秦 斌,王 琰,董 蕾
(西安交通大学第二附属医院消化内科,陕西西安 710004)
目的 研究阿托伐他汀体外对胰腺癌细胞株PANC-1的影响及其机制。方法 不同浓度阿托伐他汀干预胰腺癌PANC-1细胞后,MTT法检测细胞的增殖、黏附作用,Transwell小室测定胰腺癌细胞的侵袭能力;RT-PCR方法测定MMP-2和VEGF的mRNA表达变化;Western blot方法检测ERK1/2的蛋白表达水平。结果 不同浓度阿托伐他汀干预胰腺癌PANC-1细胞后,细胞的增殖能力降低,并呈剂量时间依赖性。此外,阿托伐他汀可以抑制PANC-1细胞的黏附、侵袭能力,检测加药后PANC-1细胞内MMP-2、VEGF mRNA的相对表达量降低,与阴性对照组相比,差异有统计学意义(P=0.001 3,P=0.007),ERK1/2蛋白的相对表达量降低(P=0.001 5)。结论 在体外细胞培养实验中,阿托伐他汀能显著抑制胰腺癌PANC-1细胞的增殖、黏附、侵袭能力,其机制可能是通过调控MAPK/ERK1/2通路减少MMP-2及VEGF的表达而实现。
阿托伐他汀;胰腺癌;侵袭
胰腺癌是消化系统恶性程度最高的肿瘤之一,它具有发病隐匿、病程短、进展快、病死率高的特点,预后极差。因此,新的治疗研究方向对于胰腺癌的治疗及预后显得尤为重要。他汀类(statins)药物是20世纪80年代后期开发的羟甲戊二酰辅酶A(HMG-CoA)还原酶抑制剂,通过抑制羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶作用而影响细胞内许多重要生物学功能如:细胞膜构成、糖蛋白合成、细胞内信号转导、细胞周期进展等[1]。本研究通过MTT方法检测阿托伐他汀在胰腺癌细胞增殖及黏附中的作用,采用Transwell小室检测阿托伐他汀对胰腺癌细胞侵袭能力的影响,并采用Western blot和RT-RCR的方法探讨其可能机制。
1 材料与方法
1.1 实验材料
人胰腺癌细胞PANC-1购于美国ATCC;阿托伐他汀(ATV,南京德宝生化器材有限公司);吉西他滨(GEM,美国礼来公司);DMEM(高糖型,美国Hyclone公司);新生胎牛血清(杭州四季青生物技术公司);四甲基偶氮唑盐(MTT,美国Sigma公司);二甲基亚砜(DMSO,美国Sigma公司);Metrigel(美国BD公司);总RNA快速提取试剂盒(Fastgen200,西安沃尔森技术有限公司);逆转录试剂盒(美国Fermentas公司);ERK1/2抗体购自美国CST公司。
1.2 方法
1.2.1 细胞培养 人胰腺癌细胞PANC-1培养于含100 mL/L胎牛血清、100 U/mL 青霉素和100 mg/L链霉素的DMEM高糖培养液中,置于含50 mL/L CO2的37 ℃细胞培养箱中培养,2~3 d换液,细胞单层贴壁生长,至70%~80%融合时用胰蛋白酶消化传代使用。
1.2.2 MTT法检测细胞增殖 收集处于对数生长期的PANC-1细胞,以每孔5×103个细胞接种到96孔板,细胞贴壁后,加入不同浓度(100、10、1、0.1 μmol/L) 的阿托伐他汀分别培养12、24、48 h,对照组不加药,加入含等量DMSO的DMEM培养液。每个浓度设6个复孔,培养完毕后每孔加入MTT(5 mg/L)20 μL,继续培养4 h后弃去上清液,每孔加入DMSO 150 μL终止反应,以空白组调零,于波长490 nm处测定各孔吸光度值(A),实验重复3次。
1.2.3 细胞黏附实验 本实验采用无血清DMEM以1∶8稀释Metrigel基质胶,100 μL/孔加入96孔板包被基底膜,4 ℃过夜,过夜后吸出培养板内多余液体,每孔加入50 μL无血清冷DMEM,室温放置30 min,使基底膜水化。以不同浓度阿托伐他汀100、10、1、0 μmol/L,以及吉西他滨20 μmol/L干预PANC-1细胞24 h后,胰酶消化收集细胞,调整细胞浓度,以每孔5×103个细胞接种到水化基底膜后的96孔板,培养箱内培养3 h后取出,用PBS溶液冲洗两遍,每孔加入MTT(5 mg/L)20 μL,继续培养4 h后弃去上清液,最后每孔加入DMSO 150 μL终止反应,以空白组调零,于波长490 nm处测定各孔吸光度值(A),实验重复3次。
1.2.4 细胞侵袭实验 用100 μL稀释至5 mg/mL的Matrigel基质胶铺于24孔Transwell小室的上室中,重建基底膜。100、10、0 μmol/L阿托伐他汀及20 μmol/L吉西他滨干预PANC-1细胞24 h后收集,调整细胞密度为5×103/mL。Transwell小室上室每孔加入200 μL细胞悬液,下室中加入600 μL含100 mL/L FBS的DMEM培养液。培养箱内培养24 h,用结晶紫染色,倒置显微镜观察并计数。取5个视野(上、中、下、左、右),照相,计数取平均值。
1.2.5 RT-PCR检测MMP-2及VEGF基因的表达 阿托伐他汀10 μmol/L及吉西他滨20 μmol/L作用PANC-1细胞24 h后收集,试剂盒提取细胞的总RNA,按照操作说明应用逆转录试剂盒合成cDNA,以β-actin作为内参,Geneamp9600型PCR仪进行扩增,β-actin引物上游序列为5′-ATCGTGCGTGACATTAAGGAGAAG-3′,下游序列为5′-AGGAAG-GAAGGCTGGAAGAGTG-3′,目的产物长度为179 bp;VEGF引物上游序列为5′-CGGCGAAGAGAAGA-GACACATTG-3′,下游序列为5′-CGGGAAGGGAAGGGAAGGAC-3′,目的产物长度224 bp;MMP-2引物上游5′-TTGGTGGGAACTCAGAA-GG-3′,下游5′-CTTGCGGTCATCATCGTA-3′,目的产物长度140 bp。MMP-2与β-actin反应条件为:94 ℃预变性2 min,94 ℃变性60 s,退火54 ℃ 45 s,72 ℃延伸60 s,共30个循环;VEGF反应条件为94 ℃预变性2 min,94 ℃变性60 s,退火60 ℃ 45 s,72 ℃延伸60 s,共30个循环。PCR产物于10 g/L琼脂糖凝胶电泳检测,MMP-2和VEGF的基因表达水平以目的基因与内参β-actin吸光度的比值表示,并进行校正。
1.2.6 Western blot蛋白印迹分析 阿托伐他汀10 μmol/L及吉西他滨20 μmol/L干预PANC-1细胞24 h后收集,裂解细胞提取总蛋白,用BCA法测定总蛋白浓度,分别取等量蛋白加上样缓冲液于沸水中煮5 min,以100 mL/L SDS聚丙烯酰胺凝胶进行电泳分离,电泳完毕后将凝胶上的蛋白经湿转转膜仪以恒压100 V转至PVDF膜上,用含50 g/L脱脂奶粉的TBST溶液(137 mmol/L NaCl,2.7 mmol/L KCl,25 mmol/L Tris,1 mL/L Tween20,pH 7.4)封闭1~2 h,分别加入ERK1/2抗体及β-actin抗体,室温孵育2~3 h或4 ℃孵育过夜,TBST洗膜后再用辣根过氧化物酶标记的二抗室温孵育2 h,TBST洗膜后ECL化学发光系统显色,以β-actin蛋白水平作为内对照,最后对结果利用Image J测量灰度值进行分析。
1.3 统计学分析
2 结 果
2.1 阿托伐他汀对胰腺癌PANC-1细胞的增殖能力具有抑制作用
我们首先观察阿托伐他汀对人胰腺癌细胞PANC-1增殖能力的影响,以不同浓度阿托伐他汀作用于PANC-1细胞,在不同孵育时间点收集细胞,采用MTT法检测阿托伐他汀对胰腺癌细胞增殖能力的影响(图1)。阿托伐他汀诱导胰腺癌细胞死亡呈剂量和时间依赖性关系,在48 h时间点不同浓度之间进行t检验分析,差异有统计学意义(P<0.05)。

图1 MTT法检测ATV对胰腺癌PANC-1细胞增殖的影响
Fig.1 The effect of ATV on the proliferation of PANC-1 cells determined by MTT assay
2.2 阿托伐他汀对胰腺癌细胞与基底膜的黏附能力的影响
肿瘤细胞与基底膜的黏附性与肿瘤的侵袭
及远处转移密切相关。本研究采用不同浓度阿托伐他汀干预后收集细胞,接种于含Matrigel的96孔板,MTT法检测黏附于基底膜上细胞的吸光度(图2)。与对照组相比,ATV干预组黏附于基底膜上的细胞减少,差异有统计学意义(P<0.05),ATV不同浓度组之间进行t检验分析,差异有统计学意义(P<0.05)。提示阿托伐他汀可以抑制胰腺癌PANC-1细胞与基底膜的黏附能力,并呈剂量依赖性。
图2 ATV对PANC-1细胞黏附能力的影响
Fig.2 The effect of ATV on the adhesion ability of PANC-1 cells
与对照组比较,*P<0.05,与对照组比较,**P<0.01。
2.3 阿托伐他汀可以抑制PANC-1细胞的侵袭能力
本实验采用Matrigel重建基底膜的Transwell小室检测PANC-1细胞的侵袭能力(图3)。不同浓度阿托伐他汀干预后,细胞的侵袭能力降低,与对照组相比,ATV干预后PANC-1细胞水解Matrigel穿过基底膜的数量明显减少,差异有统计学意义(P=0.001 3,0.000 3),提示阿托伐他汀可以抑制PANC-1细胞水解细胞外基质,运动穿过基底膜至下室的能力,两组不同浓度ATV干预结果之间进行t检验分析,随剂量增加,侵袭抑制效应增强(P=0.043,图4)。
图3 穿过基底膜到达下室的细胞
Fig.3 The pictures of cells that crossed the basement membrane (×100)
A:对照组;B:ATV 10 μmol/L;C:ATV 100 μmol/L;D:GEM 20 μmol/L。
图4 ATV干预可抑制PANC-1细胞的侵袭能力
Fig.4 The effect of ATV in inhibiting the invasion capability of PANC-1 cells
与阴性对照组比较,**P<0.01。
2.4 阿托伐他汀可以抑制PANC-1细胞MMP-2及VEGF mRNA的表达
通过前面的实验可以看出,阿托伐他汀可以抑制胰腺癌PANC-1细胞的增殖、黏附、侵袭能力。本实验进一步研究这些现象发生的分子机制,采用荧光定量PCR方法检测ATV干预后细胞内MMP-2及VEGF mRNA的表达(图5、图6):与对照组相比,ATV干预后,MMP-2及VEGF mRNA的表达均降低(P=0.001 3,0.007),MMP-2与VEGF的表达与肿瘤细胞侵袭与转移的发生密切相关,提示阿托伐他汀可能通过调控MMP-2及VEGF的表达而抑制胰腺癌PANC-1细胞的侵袭及转移能力。
2.5 阿托伐他汀干预后PANC-1细胞内ERK1/2蛋白的表达降低
ERK1/2蛋白是MAPK信号通路的重要转导因子之一,它的激活与细胞的增殖、分化密切相关。本实验采用Western blot方法检测ATV干预后胰腺癌PANC-1细胞ERK1/2蛋白的表达(图7)。与对照组相比,阿托伐他汀干预后ERK1/2蛋白的表达明显降低,差异具有统计学意义(P=0.001 5),提示阿托伐他汀可以抑制PANC-1细胞ERK1/2蛋白的表达,ATV可能具有抑制MAPK/ERK1/2通路的作用,这可能与本实验中ATV干预后PANC-1细胞的黏附、侵袭能力降低有关。
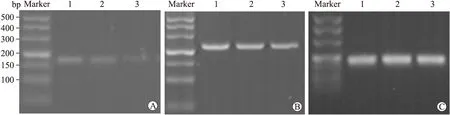
图5 RT-PCR检测PANC-1细胞MMP-2及VEGF mRNA的表达
Fig.5 MMP-2 and VEGF mRNA expressions of PANC-1 cells detected by RT-PCR assay
A:MMP-2 mRNA的表达;B:VEGF mRNA的表达;C:内参β-actin;1:对照组;2:GEM 20 μmol/L;3:ATV 10 μmol/L。
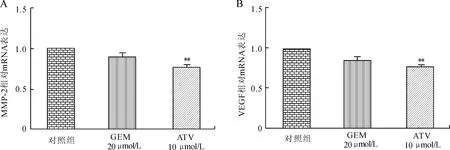
图6 胰腺癌PANC-1细胞MMP-2及VEGF mRNA相对表达的比较
Fig.6 Relative expressions of MMP-2 and VEGF mRNA of PANC-1 cells
A:MMP-2 mRNA相对表达量;B:VEGF mRNA相对表达量;与阴性对照组比较,**P<0.01。
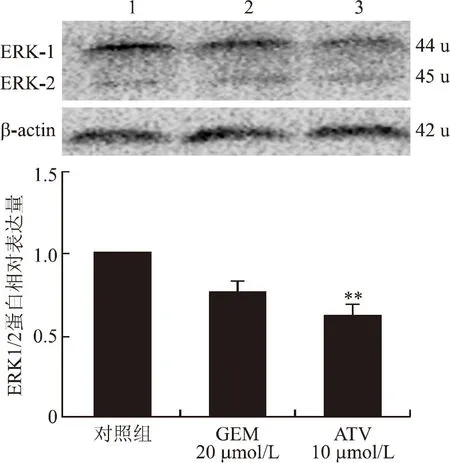
图7 胰腺癌PANC-1细胞ERK1/2蛋白相对表达量的比较
Fig.7 Comparison of the expression of ERK1/2 protein of PANC-1 cells
1:对照组;2:GEM 20 μmol/L;3:ATV 10 μmol/L;与阴性对照组比较,**P<0.01。
3 讨 论
胰腺癌是消化系统常见恶性肿瘤,是目前病死率最高的恶性肿瘤之一,肿瘤的复发转移是导致临床上胰腺癌患者死亡的主要原因。近来研究表明,他汀类作为羟甲基戊二酸单酰辅酶抑制剂,对很多肿瘤细胞具有抑制增殖、诱导分化或凋亡、抑制血管生成的作用[2-3]。在胰腺癌动物实验研究中,阿托伐他汀通过抑制Kras等蛋白的异戊烯化,抑制肿瘤的生长,增加存活率[4]。
本研究采用体外浸润模型模拟肿瘤细胞对周围相连组织的浸润特性,实验中铺于Transwell上室的Matrigel基质胶,其中含有LN、IV型胶原、接触蛋白和肝素硫酸多糖,可以模拟细胞外基质环境。细胞必须分泌水解酶,降解基质成分,通过变形运动才能穿过,这与体内侵袭迁移情况较为相似[5],阿托伐他汀干预后,能够水解细胞外基质并穿过基底膜的细胞数量减少,提示PANC-1细胞降解细胞外基质的侵袭能力明显下降。此外,铺有Matrigel的培养板可以检测胰腺癌细胞与细胞外基质的黏附能力,结果也显示阿托伐他汀可以降低PANC-1细胞与细胞外基质的黏附能力。本实验模拟肿瘤细胞转移过程中的增殖、黏附及侵袭步骤,提示阿托伐他汀有可能控制胰腺癌肿瘤细胞的生长并减少侵袭及转移的发生。
肿瘤细胞侵袭、转移的发生包含多种分子机制,过程非常复杂,其中组织基质金属蛋白酶(MMPs)可以通过蛋白分解途径水解细胞外基质及非蛋白分解途径参与肿瘤的侵袭及转移[6],MMP-2是MMPs家族中的重要成员之一。有研究发现,MMP-2在临床胰腺癌标本中的表达率可达到93%,而它几乎不表达于正常组织,胰腺癌组织中MMP-2的阳性表达率与淋巴结转移和向周围组织器官浸润有关[7],可见MMP-2对胰腺癌的发展具有重大影响,并与预后密切相关[8]。因此,MMPs的表达与肿瘤细胞侵袭、转移的发生密切相关。VEGF是目前所知主要的血管内皮生长因子,在胰腺癌研究中发现VEGF表达与肿瘤微血管密度有关,VEGF高表达以及肿瘤新生血管丰富的患者预后不良[9]。本研究在mRNA水平上研究阿托伐他汀干预PANC-1细胞后细胞内MMP-2及VEGF的变化,发现MMP-2与VEGF mRNA的表达降低,这恰好解释了阿托伐他汀的侵袭抑制作用,而对于VEGF表达的抑制,我们推测其可能抑制肿瘤的血管生成能力。
MAPK信号转导通路存在于大多数细胞内,被认为是许多信号通路的共同通路[10]。ERK1/2是MAPK信号通路的重要信号转导因子之一。有研究表明,抑制MAPK/ERK1/2细胞信号通路能够下调VEGF表达,进而抑制肿瘤新生血管的生成及浸润转移能力[11]。在体外动物实验中阿托伐他汀可以通过抑制ERK1/2的表达,抑制裸鼠胰腺癌移植瘤的生长[12],而MMPs的表达也受到多种细胞因子及生长因子的调节,这些因子常常可以通过激活细胞内的MAPK信号通路来发挥作用[13]。本实验进一步研究发现,阿托伐他汀干预后,PANC-1细胞内ERK1/2蛋白的表达降低,提示阿托伐他汀可以通过调控MAPK/ERK1/2通路抑制胰腺癌细胞PANC-1的生长、黏附、侵袭能力。有研究表明,ERK可通过活化核转录因子AP-1[14]或Ets[15]调节MMP-9的表达,并通过刺激核转录因子AP-2蛋白的表达[16]或活化核转录因子Sp1[17]调节MMP-2的表达。因此,推测阿托伐他汀可能通过抑制MAPK/ERK1/2通路而减少MMPs及VEGF的表达。由于体外细胞实验本身的局限性,也不排除其他信号传导通路的参与,其他可能参与的信号传导通路以及这些通路间是否相互影响仍有待探讨。
总之,本实验结果表明阿托伐他汀可以抑制胰腺癌PANC-1细胞的增殖、黏附、侵袭能力,其可能的机制是通过抑制MAPK/ERK1/2通路下调MMP-2及VEGF的表达,但具体机制尚需要进一步研究。胰腺癌的侵袭转移与预后密切相关,阿托伐他汀有可能成为抑制胰腺癌细胞侵袭、转移的发生,改善预后的治疗方案之一。
[1] AKIRA E. A historical perspective on the discovery of statins[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2010, 86(5):484.
[2] HINDLER K, CLELAND CS, RIVERA E, et al. The role of statins in cancer therapy[J]. Oncologist, 2006, 11(3):306-315.
[3] SASSANO A, PLATANIAS L C. Statins in tumor suppression [J]. Cancer Lett, 2008, 260(1):11-19.
[4] LIAO J, CHUNG YT, YANG AL, et al. Atorvastatin inhibits pancreatic carcinogenesis and increases survival in LSL-KrasG12D-LSL-Trp53R172H-Pdx1-Cre mice[J]. Mol Carcinog, 2013, 52(9):739-750.
[5] TOLBOOM TC, HUIZINGA TW.Invitromatrigel fibroblast invasion assay[J]. Methods Mol Med, 2007, 135:413-421.
[6] KESSENBROCK K, PLAKS V, WERB Z. Matrix metalloproteinases: regulators of the tumor microenvironment[J]. Cell, 2010, 141(1):52-67.
[7] 李月光,马波,李文林,等. 胰腺癌组织中胰腺星状细胞的活化和基质金属蛋白酶-2的表达[J]. 郑州大学学报(医学版), 2008, 43(1):134-136.
[8] SCHNEIDERHAN W, DIAZ F, FUNDEL M, et al. Pancreatic stellate cells are an important source of MMP-2 in human pancreatic cancer and accelerate tumor progression in a murine xenograft model and CAM assay[J]. J Cell Sci, 2007, 120(3): 512-519.
[9] NIEDERGETHMAN M, HILDENBRAND R, WOSTBROCK B, et al. High expression of vascular endothelial growth factor predicts early recurrence and poor prognosis after curative resection for ductal adenocarcinoma of the pancreas[J]. Pancreas, 2002, 25(2):122-129.
[10] CARGNELLO M, ROUX P. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases[J]. Microbiol Mol Biol Rev, 2011, 75(1):50-83.
[11] 张涓娟,蒲宇,李勇,等. PI3K/AKT和MAPK/ERK1/2信号通路对胰腺癌PANC-1细胞VEGF表达的影响[J]. 川北医学院学报, 2014, 29(1): 44-48.
[12] DING N, CUI X X, GAO Z, et al. A triple combination of atorvastatin, celecoxib and tipifarnib strongly inhibits pancreatic cancer cells and xenograft pancreatic tumors[J]. Int J Oncol, 2014, 44(6):2139-2145.
[13] CHEN WP, XIONG Y, HU PF, et al. Baicalein inhibits MMPs expression via a MAPK-dependent mechanism in chondrocytes[J]. Cell Physiol Biochem, 2015, 36(1):325-333.
[14] YANG CM, LEE IT, LIN CC, et al. c-Src-dependent MAPKs/AP-1 activation is involved in TNF-α-induced matrix metalloproteinase-9 expression in rat heart-derived H9C2 cells[J]. Biochem Pharmacol, 2013, 85(8):1115-1123.
[15] HAHNE JC, OKUDUCU AF, KAMINSKI A, et al. Ets-1 expression promotes epithelial cell transformation by inducing migration, invasion and anchorage-independent growth[J]. Oncogene, 2005, 24:5384-5388.
[16] GUAN H, CAI J, ZHANG N, et al. Sp1 is upregulated in human glioma, promotes MMP-2 mediated cell invasion and predicts poor clinical outcome[J]. Int J Cancer, 2012, 130(3):593-601.
[17] KUO LY, CHANG HC, LEU TH, et al. Src oncogene activates MMP-2 expression via the ERK/Sp1 pathway[J]. J Cell Physiol, 2006, 207(3):729-734.
(编辑 韩维栋)
Effects of atorvastatin on the proliferation and invasion of human pancreatic cancer cell PANC-1 and its mechanism study
LI Jing, LUO Miao-sha, QIN Bin, WANG Yan, DONG Lei
(Department of Gastroenterology, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004, China)
Objective To investigate the effects of atorvastatin on the invasion and proliferation abilities of pancreatic cancer cell PANC-1. Methods PANC-1 cells were exposed to different concentrations of atorvastatin. We used MTT assay to detect the proliferation and adhesion capabilities of PANC-1 cells. Transwell chamber was used to detect the invasion ability of PANC-1 cells. The expressions of MMP-2 and VEGF mRNA were assayed by RT-PCR while the expression of ERK1/2 protein was assayed by Western blot. Results Different concentrations of atorvastatin could inhibit the proliferation, adhesion and invasion abilities of PANC-1 cells in a dose-dependent manner. Atorvastatin of 10 μmol/L inhibited the expressions of MMP-2 (P=0.001 3), VEGF mRNA (P=0.007) and ERK1/2 protein (P=0.001 5) significantly. Conclusion Atorvastatin significantly inhibits the proliferation, adhesion and invasion capabilities of PANC-1 cellsinvitro. The mechanism may be related to inhibiting MAPK/ERK1/2 pathway and suppressing the expressions of MMP-2 and VEGF.
atorvastatin; pancreatic cancer; invasion
2015-05-27
2015-09-30
“十二五”农村领域国家科技计划课题(No.2012BAJ18B00) The planning subject ofthe Twelfth Five-year Planin National Science and Technology for Rural Development in China (No.2012BAJ18B00)
董蕾. E-mail: dong556@126.com
R737.33
A
10.7652/jdyxb201601006
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151209.1647.018.html(2015-12-09)

