超声波清洗中草药当归的研究
李芳蓉* ,刘凤霞,刘淑梅,陈军
(甘肃中医药大学定西校区 甘肃 定西,743000)
超声波清洗中草药当归的研究
李芳蓉* ,刘凤霞,刘淑梅,陈军
(甘肃中医药大学定西校区 甘肃 定西,743000)
在25℃的水中分别以频率为40kHz,功率为250W的超声波清洗干当归和普通水洗干当归。分别测定了清洗水中和清洗后的当归中当归粗多糖的含量,得到结论为:(1)当归很适合于超声波洗涤,不仅清洗洁净度高,而且省水省时耗能少。(2)超声波清洗和普通水洗当归后清洗水中当归多糖含量都很低且相差甚微,说明当归的清洗过程中当归多糖的损失量都很小。(3)超声波清洗和普通水洗后的当归中当归多糖的含量相差较小,其粗当归多糖的含量相对文献值较高,说明清洗过程中当归多糖的损失量很少,与清洗水中当归多糖的含量很低相一致。超声波清洗是理想的中药材当归清洗方法,具有相当的可行性和必要性,以及广泛的应用和推广价值。
当归;超声波清洗;超声功率;超声频率;水温;清洁度
1. 引言
当归药材为伞形科植物当归[Angelica sinensis (Oliv.)Diels]的干燥根。始载于《神农本草经》,属无毒上品药,素有“十方九归”之美誉。其味甘、辛、微苦,性温,归肝、心、脾经。有补血活血、调经止痛、润燥通便之功效。临床用含当归药物多达80余种[1],亦可作为滋补品食用[2]。主要化学成分有挥发油、有机酸类、多糖类、核苷类、氨基酸和微量元素等[3]。其中主要有效成分为当归多糖、阿魏酸、藁本内酯、丁烯基苯酞、丁苯酞和核苷等。可治疗血虚萎黄、眩晕心悸,月经不调、经闭痛经、肠燥便秘,虚寒腹痛,风湿痹痛,跌仆损伤,痈疽疮疡等症[4]。
当归多糖是当归的主要水溶性成分,具有促进造血、增强免疫功能[5]、抗肿瘤[6-7]、抗辐射损伤[8]、拮抗脾脏萎缩、镇痛及抗氧化、增强血清和脑组织SOD活力[9]等广泛的药理作用和生物活性。现已成为当归药效成分研究的热点之一。植物多糖的含量测定现多采用苯酚- 硫酸法[10]。
当归为典型的根类中草药,药食两用,根部可能带有大量泥土、病原生物及虫卵等,传统上深加工、贮藏和运销前必须用大量的人力进行刷洗,耗时费力;或用滚筒或高压水射流洗涤,药材损耗大、耗费大量水。且因干当归表面皱缩、不规整,污垢藏于缝隙或根叉深处而清洗不掉,净洗效果欠佳,直接影响其药用、加工和开发。洗涤后还需晾晒和硫黄熏蒸防腐、防虫蛀等。应用超声波辅助清洗中药材,既可降低劳动强度、节水,还可使附着在药材表面尤其是茎、根须间隙内的泥土、虫卵、病原体等杂物得到快速彻底的清洗,不留死角,且洁净度高。同时超声波的空化效应,对抑制虫卵与病原微生物、防止有效成分散失等方面更有效[11]。此外,应用超声波清洗实现遥控或自动化清洗更加容易。当归属于典型的根类中草药,很适合于超声波洗涤,不但清洗洁净度高[12]、杀毒灭菌效果好,防腐、防虫蛀,还可提高药效成分的利用率、减少有效成分散失,缩短晾晒时间,减少硫黄熏蒸等步骤。
本实验组在超声波清洗当归初步试验的基础上,以当归多糖为例,以硫酸-苯酚比色法[13,14]通过对普通水洗和超声波清洗水中当归多糖的测定、普通水洗和超声波清洗后当归中当归多糖的测定,进一步验证超声波清洗当归后有效成分散失与否、散失量高低。
2. 材料与方法
2.1 试验材料及仪器
2.1.1 药材来源
本实验所用当归由甘肃省岷县四族乡四族村药农提供,经甘肃中医药大学定西校区生化系张尚智教授鉴定,为伞形科植物当归的干燥根。
2.1.2 仪器
KQ-250DE型数控超声波清洗器,昆山市超声有限公司出品。TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)。旋转蒸发器(RE-30/50L,上海况胜实业发展有限公司)电子天平(精度0.0001g,上海海康电子仪器厂)。超帅智能高速中药粉碎机(CS-1000 1ADY2,武义海纳电器有限公司)。
2.1.2 试剂
实验用水为一次蒸馏水,主要试剂有葡萄糖对照品购于中国药品生物制品检定所(批号:0831-9606),苯酚(重蒸馏)、无水乙醇、浓硫酸均为分析纯。
2.2 当归的清洗
2.2.1 超声波清洗和普通水洗当归
分别称取相同量的两份当归,分别在25℃的等量的水中间歇性手工振摇水洗和超声波辅助清洗(250W、40kHz) 清洗60min,两种方法清洗后的当归都达到了表面清洁,无明显泥土或泥斑。清洗后的当归在40℃的烘箱中干燥2h,收集于塑料自封袋中备用。清洗后的水各取2000mL,用旋转蒸发仪在40℃温度下浓缩至500mL,收集于棕色试剂瓶中备用。
2.3 超声波清洗和普通水洗当归后当归及清洗后水中当归多糖的测定
2.3.1 溶液的配制
2.3.1.1 对照品溶液
精密称取105℃干燥至恒重的无水葡萄糖对照品0.1250g,置于250mL容量瓶中,加蒸馏水溶解并定容至刻度,配制成质量浓度为0.5000mg/mL的葡萄糖对照品溶液,备用。吸取该葡萄糖对照品溶液25mL,注入50mL容量瓶中,加蒸馏水定容至刻度,即得质量浓度为0.2500mg/mL的葡萄糖对照品溶液[ ],保存备用。
2.3.1.2 苯酚溶液的配制
精密称取苯酚12.5002g,置于250mL棕色容量瓶中,加适量蒸馏水溶解,定容至刻度,即得5%苯酚溶液,置于4℃的冰箱中,冷藏备用。该试剂宜现配现用。
2.3.1.3 供试品溶液的制备
精密称取当归样品粉末(已过 40目筛),5.0002g置圆底烧瓶中,加80%乙醇100mL加热回流2h,抽滤;取滤渣加水60mL加热回流2h,趁热过滤,将滤液定容至100mL容量瓶中,即得。
2.3.2 当归多糖的测定
2.3.2.1 标准曲线的绘制
精密移取质量浓度为0.25mg/mL葡萄糖对照品溶液各0.00, 0.50,0.75,1.00,1.25,1.50,1.75mL置于已编号为1~7的25mL干燥具塞刻度试管中,各加入17.50mL浓硫酸,新配制的5%的苯酚3.75mL,蒸馏水补齐至刻度,沸水浴10min后,立即置于冰水浴中冷却5min,以5号标准溶液做全波长(200~800nm)扫描,确定了λmax=484nm。在λmax=484nm下分别测定1~7号标准溶液的吸光度(A),以吸光度(A)为纵坐标,以葡萄糖对照品溶液质量浓度(C)为横坐标,求得回归方程,绘制标准Y=40.203X-0.075,R2=0.9997。葡萄糖对照品溶液标准曲线见图1。
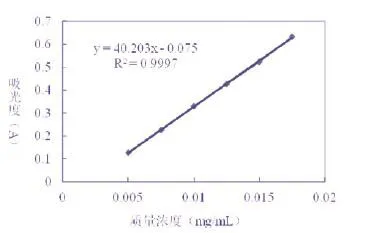
图1 葡萄糖对照品溶液标准曲线
2.3.2.2 超声波清洗和普通水洗当归后清洗水中当归多糖的测定
精密移取分别用普通水洗和超声波辅助清洗的已浓缩的清洗液1.25mL,与2.3.2.1绘制标准曲线的方法显色,测定各自溶液的吸光度,并计算当归粗多糖的含量。
2.3.2.2 超声波清洗和普通水洗当归中当归多糖的测定
精密移取普通水洗和超声波辅助清洗的当归供试品溶液各1.25mL,与2.3.2.1绘制标准曲线的方法显色,测定各自溶液的吸光度,均平行测定3次,并计算当归粗多糖的含量。
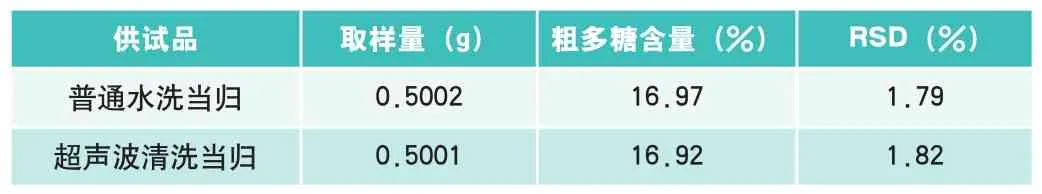
表1 当归粗多糖含量测定结果(n=3)
3. 结果与讨论
3.1 超声波清洗和普通水洗当归后清洗水中当归多糖含量很小且相差甚微
对分别用超声波辅助清洗和普通水洗的已浓缩的清洗液,与2.3.2.1绘制标准曲线的方法显色,测定各自溶液的吸光度,结果测得各自吸光度都较大(超过2.00000),因此又将溶液稀释10倍后进行了相同的测定,所得吸光度分别为0.22621和0.22742,计算得各自当归多糖的含量分别为0.007492mg/mL和0.007522mg/mL,折合成最初的未浓缩的清洗液浓度0.01873mg/mL和0.01881mg/mL,两者浓度相差不大且溶液中当归粗多糖的含量都很小,说明无论是普通水洗和超声波清洗当归,当归的有效成分之一当归多糖的损失量都很小。

3.2 超声波清洗和普通水洗当归中当归多糖的含量较高且相差较小
由实验数据可知,无论是超声波辅助还是普通水洗后的当归,其粗当归多糖的含量相对其他文献值[ , ]而言都比较高,说明清洗过程中当归多糖的损失量很少,与清洗水中当归多糖的含量很低相对应。
4. 结论
在25℃的等量的水中分别以频率为40kHz,功率为250W的超声波清洗和普通(间歇性手工振摇)水洗干当归,并分别测定了清洗水中和清洗后的当归中当归粗多糖的含量,得到以下结论:
(1)当归根部可能带有大量泥土、病原生物及虫卵等,普通水洗很难彻底清除干净,很适合于超声波洗涤,不仅清洗洁净度高、杀毒灭菌效果好,防腐、防虫蛀,还可缩短晾晒时间,减少硫黄熏蒸等步骤。
(2)超声波清洗和普通水洗当归后清洗水中当归多糖含量都很低且相差甚微,说明无论是普通水洗和超声波清洗当归,当归的有效成分之一当归多糖的损失量都很小。
(3)超声波清洗和普通水洗后的当归中当归多糖的含量相差较小,其粗当归多糖的含量相对文献值较高,说明清洗过程中当归多糖的损失量很少,与清洗水中当归多糖的含量很低相一致。
综上所述,超声波清洗当归既可保证当归中当归多糖等基本无流失,省时省水,而且清洁度高,耗能少,是理想的中药材清洗方法,具有相当的可行性和必要性,以及广泛的应用和推广价值。
[1] MA Jian-Ping, GUO Zhi-Bing, JIN Ling, et al.Phytochemical progress made in investigations of Angelica sinesis(Oliv.)Diels [J]. Chinese Journal of Natural Medicines, 2015(4): 241-249
[2] 曾东. 当归及其提取物化学成分红外光谱法分析[J]. 中国现代药物应用, 2016, 10(4): 287-288
[3] 康军. 当归化学成分及其药理作用研究进展[J]. 中医中药, 2005, 2(23): 120
[4] 中国药典委员会. 中国药典2015版(一部)[S]. 北京: 化学工业出版社, 2015 : 124-125
[5] 曹蔚, 李小强, 侯颖. 当归多糖-1cII的抗肿瘤活性研究[J].中国新药杂志, 2008, 17(12): 1018-1021
[6] 王瑾, 刘君炎, 夏丰年. 当归多糖促进瘤苗抗瘤作用初探[J].辽宁中医杂志, 1999, 26(1): 39-40.
[7] 吴素珍, 李加林, 陈水亲. 硫酸酯化当归多糖抗肿瘤实验研究[J]. 时珍国医国药, 2012, 23(2): 319-320
[8] 洪艳, 刘君炎, 张渝侯, 等. 当归多糖增强放射损伤小鼠胸腺细胞增殖及红细胞C3b受体黏附功能的实验研究[J]. 中国当代儿科杂, 2001, 3(3): 250-252
[9] 郑敏, 王亚平. 当归多糖对人髓系多向造血祖细胞增殖分化的影响及其机理研究[J]. 解剖学报, 2002, 25(2): 105-107
[10] 刘云. 当归多糖的提取及含量测定[J]. 现代中药研究与实践, 2003,17(1): 49-50
[11] 张明铎. 超声波清洗在替代ODS清洗工艺技术中的独特作用[J]. 声学技术, 2002, 4(21): 195-199
[12] 孙卓, 徐峰, 王蔚, 等. 中草药超声波清洗技术的理论分析[J]. 农业与技术, 2015, 35 (1): 72-73
[13] 张素斌, 吕嘉欣. 四种当归多糖提取方法的比较研究[J]. 天津农业科学, 2013(10): 33-36
[14] 王英, 张尚智, 朱田田, 等. 当归有效成分的提取与分析研究进展[J]. 中兽医医药杂志, 2016, 35 (2): 75-79
[15] 陈丽萍, 刘雄, 夏鹏飞, 等. 正交设计优化当归多糖的定量分析方法[J]. 解放军医药杂志, 2015, 27(10): 100-102
[16] 马毅, 晋玲, 王振恒, 等. 甘肃岷县不同海拔栽培当归多糖含量比较研究[J]. 中兽医医药杂志, 2013, 32 (2): 7-9
[17] 商澎, 杨铁虹, 贾敏, 等. 当归多糖的分离、纯化及分析鉴定[J]. 第四军医大学学报, 2001, 22(14): 1311-1314
2015A-180甘肃省高等学校科研项目 超声波清洗技术在根茎类中草药净洗中的应用研究。2015B-143年度甘肃省高等学校科研项目()
S631.2;S634.3
A

