注射用免疫核糖核酸II的免疫调节及对顺铂的增效减毒作用
霍小位,王灿红,马晓玲,高丽,张蕾蕾,张丽静,刘冬羽,韩嘉媛,李立勇,曹丽
注射用免疫核糖核酸II的免疫调节及对顺铂的增效减毒作用
霍小位,王灿红,马晓玲,高丽,张蕾蕾,张丽静,刘冬羽,韩嘉媛,李立勇,曹丽
【摘要】
目的探讨注射用免疫核糖核酸 II(BP 素)对顺铂(DDP)的增效减毒作用及对 S180 荷瘤小鼠的免疫调节作用。
方法建立小鼠 S180 皮下移植瘤模型,随机分组,采用腹腔注射给药,连续给药 10 d,通过白细胞(WBC)计数、骨髓有核细胞计数,取肿瘤、胸腺、脾脏称重,计算抑瘤率、胸腺指数、脾脏指数以及 MTT 法检测刀豆蛋白 A(ConA)诱导的小鼠脾脏 T 淋巴细胞增殖,观察 BP 素对顺铂的增效减毒作用。通过 ELISA 法检测血清中的 IL-1β、IL-6、TNF-α 水平,通过腹腔巨噬细胞对鸡红细胞吞噬率的测定评价 BP 素对 S180 荷瘤小鼠的免疫调节作用。
结果BP 素与 DDP 联合应用可显著提高 DDP 对 S180荷瘤小鼠的抗肿瘤作用(P < 0.01),明显改善 DDP 化疗所致的脾脏指数下降,外周血 WBC 数、骨髓有核细胞数的减少及脾脏 T 淋巴细胞增殖抑制等毒副作用(P < 0.01 或P < 0.05);单用 BP 素可显著降低荷瘤小鼠血清中的IL-1β、IL-6、TNF-α 水平(P < 0.01 或 P < 0.05),提高腹腔巨噬细胞吞噬鸡红细胞的吞噬率(P < 0.01)。
结论BP 素对 DDP 具有增效减毒作用,并对 S180 荷瘤小鼠具有免疫调节作用。
【关键词】肿瘤;顺铂;免疫调节;BP 素
www.cmbp.net.cn中国医药生物技术, 2016, 11(1):32-37
作者单位:100193 北京,中国医学科学院北京协和医学院药用植物研究所(霍小位、高丽、张蕾蕾、张丽静、刘冬羽、韩嘉媛、李立勇、曹丽);650500 昆明,云南中医学院(王灿红);830002 乌鲁木齐,新疆维吾尔自治区中药民族药研究所(马晓玲)
肿瘤的发生与机体的免疫功能密切相关,当机体免疫功能异常时,肿瘤的发病率上升。而肿瘤快速生长时,会进一步抑制机体的免疫功能。顺铂(cis-dichlorodiamineplatinum,DDP)作为临床常用的有效治疗多种实体瘤的一线化疗药物,对肿瘤细胞具有较好的杀伤作用,但很容易引起肝肾毒性、消化道反应及免疫功能抑制等毒副作用,严重影响其治疗效果及肿瘤患者的生存质量[1-2]。注射用免疫核糖核酸 II(商品名 BP 素)是使用现代化的工艺,从健康牛胰脏组织中提取的低分子 RNA[3]。临床上,BP 素作为肿瘤患者术后及放、化疗的辅助用药取得了较好的治疗效果[4]。在正常动物模型上也观察到 BP 素具有增强免疫功能的作用[5]。但 BP 素联合化疗的减毒增效作用以及对肿瘤模型动物的免疫功能是如何发挥的仍有必要进一步阐明。本研究通过建立小鼠 S180 皮下移植瘤模型,研究 BP 素对顺铂的增效减毒作用及对 S180荷瘤小鼠的免疫调节作用,为临床合理应用 BP 素提供参考。
1 材料与方法
1.1实验材料
1.1.1药品与试剂BP 素为吉林敖东药业集团延吉股份有限公司产品;注射用顺铂为齐鲁制药有限公司产品;胸腺五肽注射液为海南中和药业有限公司产品;RPMI Medium 1640 为美国 Gibco 公司产品;小鼠 IL-1β、IL-6、TNF-α ELISA 检测试剂盒为上海拜力生物科技有限公司产品;特级胎牛血清为北京元亨圣马生物技术研究所产品;四甲基噻唑蓝(MTT)为美国 Amresco 公司产品。
1.1.2仪器BCN-1360 生物洁净工作台购自北京东联哈尔仪器制造有限公司;5410 型二氧化碳培养箱购自美国 Napco 公司;MQX 200 型酶标仪购自美国 Bio-Tek 公司;CKX 41 荧光倒置显微镜购自日本 Olympus 公司;Labofuge 400R 离心机购自德国 Heraeus 公司;TT 快速细胞分析仪购自德国 Innovatis 公司。
1.1.3动物与瘤株雄性 ICR 小鼠,SPF 级,16 ~ 18 g,购自北京维通利华实验动物技术有限公司,许可证号 SCXK(京)2012-0001。按啮齿类动物饲养方法和条件饲养于 SPF 级动物房。S180瘤株由本实验室常规传代保存。羊血购自北京大学医学部动物中心;鸡血由中国农业大学动物医学院馈赠。
1.2方法
1.2.1小鼠 S180 皮下移植瘤模型的建立将冻存的 S180 瘤株复苏,体外培养,取对数生长期的S180 细胞用无菌生理盐水洗 3 次,调整浓度为2.5 × 106个/ml,小鼠腹腔注射 0.2 ml/只,连续传2 代。无菌条件下抽取生长良好的腹水瘤小鼠的腹水,用细胞分析仪计数活细胞数 ≥ 95%。用无菌生理盐水调整细胞浓度为 5.0 × 106个/ml,于小鼠右侧腋窝皮下接种,0.2 ml/只。
1.2.2BP 素对顺铂增效减毒作用
1.2.2.1分组及给药建立 S180 荷瘤小鼠模型,并随机分为模型组、DDP 组、BP 素低 + DDP组、BP 素中 + DDP 组、BP 素高 + DDP 组,每组 10 只,另设空白对照组。空白对照组、模型组小鼠腹腔注射生理盐水 10 ml/kg,1 次/d;DDP 组腹腔注射 DDP 2 mg/kg,1 次/2 d;BP 素低 + DDP组、BP 素中 + DDP 组、BP 素高 + DDP 组分别腹腔注射 BP 素 25、50、100 mg/kg,1 次/d,同时腹腔注射 DDP 2 mg/kg,1 次/2 d。以上各组连续给药 10 d。
1.2.2.2BP 素联合顺铂对 S180 荷瘤鼠抑瘤率及脏器指数的影响末次给药 24 h 后,称体重,摘眼球取血并颈椎脱臼处死小鼠,剥离瘤体、胸腺、脾脏,用电子天平精密称重,计算抑瘤率和脏器指数。抑瘤率 =(模型组平均瘤重 – 治疗组平均瘤重)/模型组平均瘤重 × 100%,脏器指数 = 免疫器官质量(mg)/体重(g)。
1.2.2.3BP 素联合顺铂对外周血 WBC 数的影响末次给药 1 h 后,小鼠尾尖取血 10 μl,加入到 190 μl 的 3% 稀醋酸中,轻弹 EP 管使红细胞充分裂解,在显微镜下计数。
1.2.2.4BP 素联合顺铂对骨髓有核细胞数的影响末次给药 24 h 后,剥离右侧股骨,用 1 ml 注射器吸取 0.3 ml Hank's 液通过针头反复冲洗骨髓,用 3% 稀醋酸稀释 10 倍后于血细胞计数板上计数骨髓有核细胞数。
1.2.2.5BP 素联合顺铂对刀豆蛋白 A(ConA)诱导的小鼠脾淋巴细胞增殖的影响末次给药 24 h后,无菌取脾,常规制备脾细胞悬液。用含 10%胎牛血清的 RPMI 1640 培养基将脾细胞浓度调整为 5 × 106个/ml。将脾细胞悬液加入 48 孔培养板中,每孔 300 μl。再加入 300 μl ConA 液(终浓度7.5 μg/ml),置 37 ℃、5% CO2孵箱中培养 68 h 后加入 MTT(5 mg/ml)30 μl/孔,继续培养 4 h。培养结束后,每孔小心吸取 240 μl 上清液弃去,然后加入 240 μl 细胞裂解液,置 37 ℃、5% CO2孵箱中过夜。在酶标仪上于 570 nm 波长处测定吸光度(A)。
1.2.3BP 素对 S180 荷瘤小鼠免疫调节作用
1.2.3.1分组及给药接种 S180 瘤株 24 h 后,将小鼠随机分为模型对照组、胸腺五肽注射液组、BP 素低剂量组、BP 素高剂量组,每组 10 只,另设正常对照组。正常组、模型组腹腔注射生理盐水10 ml/kg,1 次/d;胸腺五肽注射液组腹腔注射胸腺五肽 7.64 mg/kg,1 次/d;BP 素低剂量组腹腔注射BP 素 12.5 mg/kg,1 次/d;BP 素高剂量组腹腔注射 BP 素 50 mg/kg,1 次/d,以上各组连续给药 10 d。
1.2.3.2BP 素对 S180 荷瘤鼠血清中 IL-1β、IL-6、TNF-α 水平的影响末次给药 24 h 后,摘眼球取血,4 ℃ 放置约 1 h,使血清充分析出,3000 r/min 离心 10 min 分离血清,用 ELISA 试剂盒测定血清中的 IL-1β、IL-6、TNF-α 水平。
1.2.3.3BP 素对 S180 荷瘤小鼠腹腔巨噬细胞吞噬鸡红细胞的影响于给药第 7 天小鼠腹腔注射 2%(v/v)绵羊红细胞(SRBC)悬液 0.2 ml/只,免疫 4 d。于末次给药 24 h 后所有动物脱颈椎处死,于无菌条件下,腹腔注射含 5% FBS 的 Hank's 液 2 ml/只,轻揉腹腔 10 次并吸取腹腔洗液移至试管内。将 0.3 ml 腹腔洗液与 0.3 ml 1% 的鸡红细胞悬液混匀,滴于玻片上并轻轻推平,于 37 ℃ 孵育 30 min。30 min 后用生理盐水冲洗玻片,甲醇固定 1 min,吉姆萨染液染色 12 min。玻片用蒸馏水冲洗并晾干。油镜下观察吞噬情况,计数 100 个巨噬细胞中吞噬鸡红细胞的巨噬细胞数,用以下公式计算吞噬率。
吞噬率 =(吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞总数)× 100%
1.3统计学处理
采用统计软件 SPSS 17.0 进行单因素方差分析,比较组间差异性,实验数据用x±s表示,P < 0.05 认为差异有统计学意义。
2 结果
2.1BP 素联合顺铂给药对 S180 荷瘤小鼠抑瘤率的影响
各给药组均有明显的抑瘤作用,与模型组相比有显著性差异(P < 0.01)。BP 素中 + DDP 组、BP 素高 + DDP 组的瘤重明显低于单用 DDP 组(P < 0.01),抑瘤率分别为 63.25% 和 60.41%,表明 BP 素中、高剂量对 DDP 的抑瘤效果有显著的增效作用,见表1。
2.2BP 素联合顺铂给药对荷瘤小鼠免疫器官指数的影响
与空白对照组相比,模型组荷瘤小鼠的脾脏指数明显增大(P < 0.01)。DDP 组荷瘤小鼠脾脏指数显著降低,与模型组比较有显著性差异(P < 0.01)。BP 素中 + DDP 组、BP 素高 + DDP 组可明显逆转 DDP 引起的脾脏指数下降(P < 0.05)。小鼠接种 S180 后,模型组荷瘤小鼠的胸腺指数没有显著性变化。与模型组比较,DDP 组荷瘤小鼠的胸腺指数略有下降,但是没有显著性差异。BP 素低 + DDP 组、BP 素中 + DDP 组、BP 素高 + DDP组的胸腺指数与 DDP 组比较也没有显著性差异(表2)。
2.3BP 素联合顺铂给药对荷瘤小鼠外周血 WBC数、骨髓有核细胞数的影响
小鼠接种 S180 后,模型组荷瘤小鼠的外周血WBC 数显著增加(P < 0.01)。与模型组相比,单用 DDP 组荷瘤小鼠的外周血 WBC 数显著减少(P < 0.05)。BP 素高 + DDP 组结果显示 BP 素可明显改善单用 DDP 引起的外周血 WBC 数的减少(P < 0.01)。小鼠接种 S180 后,模型组荷瘤小鼠的骨髓有核细胞数略有下降,但无显著性差异。DDP 组小鼠的骨髓有核细胞数与模型组比较显著减少(P < 0.05),BP 素低 + DDP 组、BP 素中 + DDP 组可明显改善 DDP 引起的骨髓有核细胞数的减少(P < 0.05)(表3)。
2.4BP 素联合顺铂给药对荷瘤小鼠脾脏 T 淋巴细胞增殖的影响
小鼠接种 S180 后,模型组荷瘤小鼠脾脏 T 淋巴细胞的增殖没有显著性变化。单用 DDP 组荷瘤小鼠脾脏 T 淋巴细胞的增殖与模型组比较略有下降,无显著性差异,但显著低于正常组。与 DDP 组比较,BP 素低 + DDP组、BP 素中 + DDP 组、BP 素高 + DDP 组可显著提升脾脏 T 淋巴细胞的增殖(P < 0.01),见表4。

表1 BP 素联合顺铂给药对小鼠 S180 移植瘤的影响(x±s )Table 1 Inhibition of various treatments on S180 tumor (x±s )

表2 BP 素联合顺铂给药对胸腺指数、脾脏指数的影响(x±s )Table 2 Effect of various treatments on thymus index and spleen index (x±s )

表3 BP 素联合顺铂给药对外周血 WBC 数、骨髓有核细胞数的影响(x±s )Table 3 Effect of various treatments on peripheral white blood cells (WBC) and bone marrow nucleated cells (x±s )
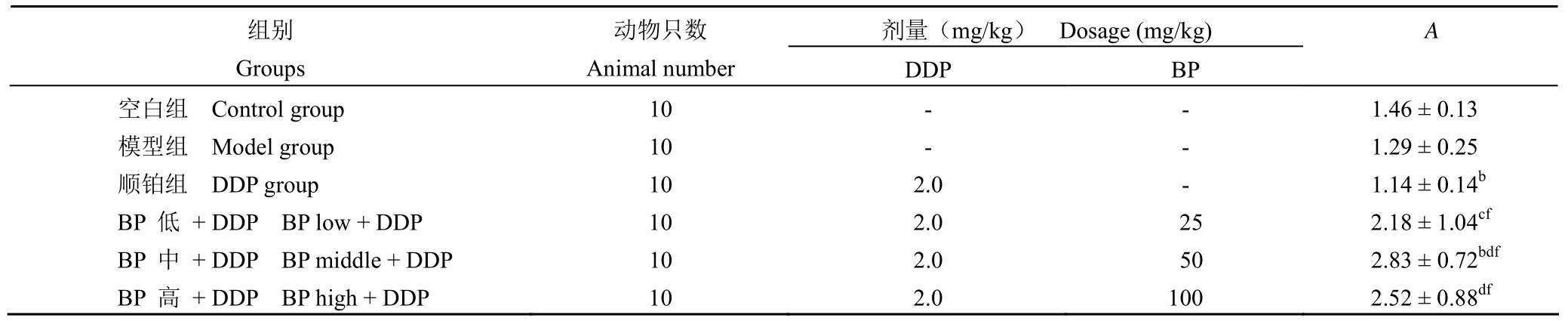
表4 BP 素联合顺铂给药对脾脏 T 淋巴细胞增殖的影响(x±s )Table 4 Effect of various treatments on T lymphocyte proliferation (x±s )
2.5BP 素对 S180 荷瘤鼠血清中 IL-1β、IL-6、TNF-α 水平的影响
与空白组比较,模型组小鼠血清中的 IL-1β、IL-6、TNF-α 水平显著升高(P < 0.01)。BP 素高、低剂量给药组及阳性药胸腺五肽注射液组小鼠血清中的 IL-1β、IL-6、TNF-α 水平与模型组相比均显著下降(P < 0.01,P < 0.05),见表5。
2.6BP 素对 S180 荷瘤小鼠腹腔巨噬细胞吞噬鸡红细胞的影响
与空白组相比,模型组小鼠腹腔巨噬细胞的吞噬率明显下降。BP 素高、低剂量给药组及阳性药胸腺五肽注射液组小鼠腹腔巨噬细胞的吞噬率与模型组比较显著升高(P < 0.01),见表6。
3 讨论
恶性肿瘤是严重威胁我国人民生命健康的疾病之一。包括顺铂在内的化疗药是治疗恶性肿瘤的常规方法之一,但大多数化疗药物缺乏肿瘤特异性,在杀伤肿瘤细胞的同时也对包括免疫细胞在内的分裂增殖旺盛的正常细胞具有杀伤作用,产生骨髓抑制,影响 T、B 淋巴细胞、巨噬细胞等免疫细胞正常的增殖活化,从而引起机体免疫功能的抑制,严重影响到恶性肿瘤的治疗[6]。因此,提高机体的免疫功能,增强化疗药物的疗效,降低其毒性,尤其是防治患者化疗后出现的免疫功能抑制,是有效治疗恶性肿瘤的关键。本实验采用小鼠的 S180皮下移植瘤模型,研究 BP 素对顺铂的增效减毒作用及其免疫调节作用。实验结果表明,在 S180 荷瘤小鼠中应用亚适剂量的 DDP(2 mg/kg),已具有明显的抑瘤效果,但同时引起了免疫器官指数,外周血 WBC 数、骨髓有核细胞数下降、T 淋巴细胞增殖抑制等免疫功能低下,与文献[7-9]报道一致。BP 素与 DDP 联合应用可显著提高 DDP 对小鼠S180 实体瘤的抑瘤作用,抑瘤率从单用 DDP 的35.82% 提高到 63.25%。同时,BP 素与 DDP 联合应用对 DDP 引起的脾脏指数、外周血 WBC数、骨髓有核细胞数下降及 T 淋巴细胞增殖抑制等免疫功能低下状态也具有一定的改善作用,进一步证实了临床观察到的 BP 素主要通过提高患者的免疫功能而发挥其抗肿瘤、改善患者生活质量的作用[3]。
细胞因子是参与肿瘤发病的短效可溶性介质[10]。这些因子的长期合成和释放会导致它们在血清中的浓度升高,可以作为反应机体免疫状态和肿瘤预后的标志物[11]。据报道,荷瘤动物中的 IL-1β、IL-6等炎性因子水平升高,对肿瘤的增殖、分化、侵袭、迁移以及黏附具有明显的促进作用。降低这些因子的水平对肿瘤的治疗具有积极的意义[12]。TNF-α 也是一种重要的促炎因子,它可以通过 TNF-α 受体以及通过激活包括 caspase-8 和 caspase-3 在内的细胞内信号级联反应来诱导凋亡[13]。但是,肿瘤患者血清中高水平的 TNF-α 与肿瘤的侵袭相关。阻断 TNF-α 成为肿瘤治疗的新策略[12]。小鼠接种S180 瘤株以后,会出现血清 IL-1β、IL-6、TNF-α 水平上升,腹腔巨噬细胞吞噬功能下降等免疫抑制状态,这与文献[14]报道基本一致。给予 BP 素治疗后,荷瘤小鼠血清中的 IL-1β、IL-6 水平明显降低,TNF-α 的水平也有所下降,腹腔巨噬细胞的吞噬能力显著增强。以上结果提示:BP 素对荷瘤小鼠的免疫功能具有一定的调节作用,并可对抗化疗药物DDP 所导致的机体免疫功能的抑制,使机体的免疫功能得到恢复,提高机体的抗肿瘤能力。
综上所述,BP 素在肿瘤化疗中具有增效减毒作用,并可调节机体的免疫功能,在肿瘤的治疗中具有积极意义。但对其作用的确切机制还有待深入研究。
参考文献
[1] Ma JH. Efficacy of lentinan combined with NP regimen in treatment of patients with advanced nonsmall-cell lung cancer and its effect on immunologic function. Chin J Biochem Pharm, 2014, 34(8):154-156. (in Chinese)
马金华. 香菇多糖联合NP方案对中晚期非小细胞肺癌患者的疗效及免疫功能的影响. 中国生化药物杂志, 2014, 34(8):154-156.
[2] Demkow U, Stelmaszczyk-Emmel A. Cardiotoxicity of cisplatin-based chemotherapy in advanced non-small cell lung cancer patients. Respir Physiol Neurobiol, 2013, 187(1):64-67.
[3] Li XZ, Piao HS. Clinical study on median advanced lung cancer, stomach cancer and liver cancer treated by BP. Guide China Med, 2013, 11(33):8-9. (in Chinese)
李学哲, 朴惠顺. BP素对中晚期肺癌、胃癌及肝癌的疗效观察. 中国医药指南, 2013, 11(33):8-9.
[4] Hu HP, Wang GY. Clinical observation on the treatment of malignant tumor with the use of RNA II injection combined with radiotherapy. Proc Clin Med, 2010, 19(2A):219. (in Chinese)
胡和平, 王国英. 注射用核糖核酸II配合放化疗治疗恶性肿瘤临床观察. 临床医药实践, 2010, 19(2A):219.
[5] Chen ZH. Effects of ribonucleic acid II on murine immune functions.
J Pharm Pract, 2008, 26(1):28-30. (in Chinese)
陈忠华. 注射用核糖核酸对小鼠免疫功能的影响. 药学实践杂志, 2008, 26(1):28-30.
[6] Rjiba-Touati K, Ayed-Boussema I, Skhiri H, et al. Induction of DNA fragmentation, chromosome aberrations and micronuclei by cisplatin in rat bone-marrow cells: protective effect of recombinant human erythropoietin. Mutat Res, 2012, 747(2):202-206.
[7] Chen Y, Mao LL, Hu BY, et al. Synergistic attenuated antitumor effect of Ginkgo biloba exocarpextracts combined with cis-dichlorodiamineplatinum in S180 tumor-bearing mice. Chin J New Drugs, 2014, 23(13):1569-1573. (in Chinese)
陈颖, 茅蕾蕾, 胡碧原, 等. 银杏外种皮提取物联合顺铂对S180荷瘤小鼠抗肿瘤增效减毒作用. 中国新药杂志, 2014, 23(13):1569-1573.
[8] Wu HB, Wu HJ, Zhang J, et al. Study on the clinical treatment of nonsmall cell lung cancer treated with the combination of five peptide nucleic acid and nucleic acid. Chin J Mod Drug Appl, 2015, 9(1):136-137. (in Chinese)
吴红波, 吴慧娟, 张静, 等. 注射用核糖核酸联合胸腺五肽在非小细胞肺癌临床治疗中的研究. 中国现代药物应用, 2015, 9(1):136-137.
[9] Niu XX, Jin LK. Clinical value of BP in tumor treatment. Med Recapitulate, 2012, 18(2):221-223. (in Chinese)牛晓晓, 金良昆. BP素在肿瘤治疗中的临床应用价值. 医学综述, 2012, 18(2):221-223.
[10] Guney N, Soydinc HO, Basaran M, et al. Serum levels of interleukin-6 and interleukin-10 in Turkish patients with aggressive non-Hodgkin’s lymphoma. Asian Pac J Cancer Prev, 2009, 10(4):669-674.
[11] Kozlowski L, Zakrzewska I, Tokajuk P, et al. Concentration of interleukin-6 (IL-6), interleukin-8 (IL-8) and interleukin-10 (IL-10) in blood serum of breast cancer patients. Rocz Akad Med Bialymst, 2003, 48:82-84.
[12] Rengarajan T, Nandakumar N, Rajendran P, et al. D-pinitol mitigates tumor growth by modulating interleukins and hormones and induces apoptosis in rat breast carcinogenesis through inhibition of NF-κB. J Physiol Biochem, 2015, 71(2):191-204.
[13] Leifeld L, Nattermann J, Fielenbach M, et al. Intrahepatic activation of caspases in human fulminant hepatic failure. Liver Int, 2006, 26(7): 872-879.
Author Affiliation: Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China (HUO Xiao-wei, GAO Li, ZHANG Lei-lei, ZHANG Li-jing, LIU Dong-yu, HAN Jia-yuan, LI Li-yong, CAO Li); Yunnan University of Traditional Chinese Medicine, Kunming 650500, China (WANG Can-hong); Xinjiang Institute of Chinese Materia Medica and Ethnodrug, Urumqi 830002, China (MA Xiao-ling)
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(1):32-37
·论著·
[14] Zhang Y, Wang S, Li Y, et al. Sophocarpine and matrine inhibit the production of TNF-alpha and IL-6 in murine macrophages and prevent cachexia-related symptoms induced by colon26 adenocarcinoma in mice. Int Immunopharmacol, 2008, 8(13-14):1767-1772.
Effects of BP on modulating sensitivity and toxicity of cisplatin and regulating immune function in S180 tumor-bearing mice
HUO Xiao-wei, WANG Can-hong, MA Xiao-ling, GAO Li, ZHANG Lei-lei, ZHANG Li-jing, LIU Dong-yu, HAN Jia-yuan, LI Li-yong, CAO Li
【Abstract】
ObjectiveTo investigate the effects of BP on modulating sensitivity and toxicity of cisplatin and regulating immune function in S180 tumor-bearing mice.
MethodThe S180 tumor-bearing mice model was established and consecutively administrated with BP alone (12.5, 50 mg/kg, i.p.), DDP alone (2 mg/kg, i.p.) or BP + DDP (25, 50, 100 mg/kg + 2 mg/kg) for 10 days. To evaluate the synergistic antitumor and attenuated effects of BP combined with DDP, peripheral white blood cells (WBC) and bone marrow nucleated cells were calculated. Also tumor, thymus and spleen were weighed and tumor inhibition rate, thymus and spleen index were measured, and ConA-induced T cells proliferation was also conducted by MTT assay. To evaluate the immune regulatory effect of BP, serum levels of IL-1β, IL-6 and TNF-α were detected by ELISA and phagocytic ratio of peritoneal macrophages was calculated.
ResultBP combined with DDP could significantly enhance the antitumor effect (P < 0.01). BP significantly reversed DDP-induced reduction of spleen index, WBC and bone marrow nucleated cells (P < 0.01 or P < 0.05). BP combined with DDP could also significantly improve T cells proliferation (P < 0.01 or P < 0.05). Moreover, BP could obviously decrease levels of IL-1β, IL-6 and TNF-α in serum (P < 0.01 or P < 0.05) and improve the phagocytic ratio (P < 0.01).
ConclusionBP combined with DDP has synergistic antitumor effect and attenuated DDP-induced toxic effects in S180 tumor-bearing mice. Moreover, BP has immunomodulatory effects in S180 tumor-bearing mice.
【Key words】Neoplasms;Cisplatin;Immunomodulation;BP
Corresponding Author:CAO Li, Email: lcao@implad.ac.cn
收稿日期:2015-10-19
通信作者:曹丽,Email:lcao@implad.ac.cn
基金项目:“重大新药创制”国家科技重大专项(2012ZX09301002-001-026)
DOI:10.3969/j.issn.1673-713X.2016.01.007

