芹菜素对A375黑色素瘤生长、迁移和血管生成的影响及其作用机制
徐红涛,韩中保,张慧丽,马林伟,王旻晨(.盐城卫生职业技术学院临床医学教研室,江苏盐城4005;.苏州大学医学院解剖系,江苏苏州53)
芹菜素对A375黑色素瘤生长、迁移和血管生成的影响及其作用机制
徐红涛1,韩中保1,张慧丽1,马林伟1,王旻晨2
(1.盐城卫生职业技术学院临床医学教研室,江苏盐城224005;2.苏州大学医学院解剖系,江苏苏州215123)
摘要:目的探讨芹菜素对A375黑色素瘤增殖、迁移和血管生成的影响及其作用机制。方法采用四唑氮化合物(MTS)法检测芹菜素对人黑色素瘤A375细胞增殖的影响;裸鼠皮下移植瘤模型考察芹菜素对体内黑色素瘤生长的影响;划痕实验检测芹菜素对细胞体外迁移的影响;小管形成实验检测芹菜素对人黑色素瘤血管生成的影响;Western blot检测芹菜素对A375细胞中调控增殖及血管生成相关蛋白表达的影响,如血管内皮生长因子(VEGF)、基质金属蛋白酶-9(MMP-9)、磷酸化P38(p-P38)、总蛋白P38(t-P38)、磷酸化Erk(p-Erk)、总蛋白Erk(t-Erk)。结果体外芹菜素处理A375细胞后,肿瘤细胞的体外增殖及体内生长较空白对照组明显受抑制;肿瘤细胞的迁移能力较溶剂对照组明显减弱;小管形成实验中,芹菜素能够抑制肿瘤细胞诱导的血管生成;分子机制研究发现,芹菜素能抑制血管生成相关蛋白VEGF及MMP-9的表达,同时芹菜素也能抑制调控肿瘤细胞增殖相关蛋白,如p-P38及p-Erk的表达。结论芹菜素能抑制A375黑色素瘤生长、迁移及血管生成,其机制可能与抑制调控肿瘤细胞增殖及血管生成相关蛋白的表达有关。
关键词:芹菜素;黑色素瘤;增殖;迁移;血管生成;分子机制
近年来,恶性黑色素瘤的发病率逐年升高,严重威胁人们的生活质量。恶性黑色素瘤是一种恶性程度很高的肿瘤,其具有病情进展快、预后较差的特点,目前已成为皮肤癌中致患者死亡的首要因素[1-2]。该病多发生于欧美国家及大洋洲的澳大利亚、奥克兰等地区[3]。研究证实,紫外线辐射是导致黑色素瘤发病的首要原因[4],其他诱发因素还包括大气污染、有机农药以及饮食习惯等。目前临床上,国内外对于黑色素瘤的治疗主要以手术切除为主,该方法对尚未发生转移的黑色素瘤效果较好,但对已经发生转移的黑色素瘤效果较差,且术后复发的风险较高[5];化疗对该病短时间内疗效明显,但长期用药后,药物的毒副作用较大,给患者带来很大痛苦[6];放疗虽然能将大部分肿瘤细胞杀死,但同时正常细胞也受到损伤,导致患者身体虚弱、免疫力下降[7];癌化学预防是近些年来国外新兴的治疗肿瘤的方法,主要基于黑色素瘤是一种不断进展的疾病,以及该病不同时期所对应的不同分子事件或通路可被合成的或天然来源的化合物靶向[8]。但是该方法到目前为止仍然没有很好地发展起来,其中一个主要原因是临床上与癌化学预防药物检测相关的逻辑及程序上的困难尚无法克服[9],使该方法用于黑色素瘤的治疗对科研界仍然是一个很大的挑战。近年来,饮食疗法在肿瘤的预防及治疗中愈来愈受到人们的重视[10],通过长期饮食实现对疾病的控制甚至达到治疗的效果。芹菜是目前世界上食用度很广的蔬菜之一[11],已被作为饮食疗法的一种食材。研究发现,芹菜中的主要活性成分为芹菜素[12]。其药理研究表明,芹菜素具有多种药理作用,如抗氧化[13]、抗炎[14]、调节免疫[15]及抗肿瘤等[16],尤其是抗肿瘤功效受到较多的关注。目前,研究证实芹菜素对头颈部细胞癌[17]、骨肉瘤[18]、肺癌[19]、前列腺癌[20]及结肠癌等[21]肿瘤细胞的增殖有抑制作用。但纵观国内外研究发现,有关芹菜素抗黑色素瘤的研究报道很少,且作用机制尚不清楚。本研究以A375黑色素瘤为研究对象,考察芹菜素对黑色素瘤增殖、迁移及血管生成的影响,并探讨其可能的作用机制,为芹菜素的临床应用提供相关实验依据。
1 材料与方法
1.1实验材料
人源性黑色素瘤细胞系A375和原代人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)(购自中国科学院上海细胞生物学研究所)。BALB/c裸鼠(雄性,6~8周龄,18~20 g),无特定病原体(specefic pathogen free,SPF)级,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2012-0001。芹菜素纯度为98%,购自美国Sigma-Aldrich公司。10%胎牛血清、无血清细胞冻存(dulbecco modified eagle medium,DMEM)培养基、0.25%胰蛋白酶购自美国Gibco公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(美国PIERCE公司Cat.No.23227),Ⅰ型鼠尾胶原蛋白(天津卫凯生物有限公司Cat.No.MAT1015 Lot.No.LQF20120221,包装规格:10 mg),MatrigelTM基底膜基质(美国BD公司Cat.No.356234 Lot.No.2342761包装规格:5 ml)。Western blot检测所涉及抗体:血管内皮生长因子(vascular endothelial growth factor,VEGF)(美国CST公司,Cat No:3852S),基质金属蛋白酶-9(matrix metalloproteinase,MMP-9)(CALBIO-CHEM,Cat No:IM51),总蛋白P38(total-P38,t-P38)/磷酸化P38(phosphorylation P38,p-P38)(1∶200,美国Abcam公司),总蛋白Erk(total-Erk,t-Erk)/磷酸化Erk(phosphorylation Erk,p-Erk)(1∶1 000,美国Cell Signaling Technology公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(美国Bioworld公司,Cat No:AP0063)。
1.2方法
1.2.1四唑氮化合物[3-(4,5-dimenthylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,MTS]法检测芹菜素对A375黑色素瘤细胞增殖的影响A375细胞用含10%胎牛血清的DMEM培养基于37℃、5%二氧化碳CO2培养箱中培养。取对数生长期的细胞,用胰酶消化后离心计数,用DMEM完全培养基调整细胞浓度为4.5×105个/ml,接种于96孔板,每孔200μl细胞悬液,常规培养至细胞增长至80%左右时,分别加1、2、4、8、16、32、64和128μmol芹菜素,与溶剂对照组[二甲基亚砜(dimethyl sulfoxide,DMSO)]孵育24 h。每孔加入MTS试剂20μl,继续培养3 h。培养结束后,在490nm波长下测定吸光度值(optical density,OD)。细胞增殖抑制率(%)=(1-实验组OD值/阴性对照组OD值)×100%。每个浓度设置6个复孔,实验重复3次。
1.2.2A375裸鼠皮下移植瘤模型检测芹菜素对肿瘤体内生长的影响①将购买的BALB/c裸鼠适应性饲养1周。根据体重随机分成两组,随机选择其中一组作为模型组(只接种肿瘤细胞,不接受任何药物处理);②常规培养A375黑色素瘤细胞,实验前4~5 d,按1∶8比例将细胞传代于75 cm2细胞培养瓶中,以免细胞生长过度而出现不完全融合。每个培养瓶大约含0.8×107~1.0×107个细胞,取对数生长期细胞,弃培养液,用磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗2遍。加入1 ml 0.25%胰酶-0.02%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),37℃消化1 min后,轻敲培养瓶使细胞脱落,加血清终止消化。转移至10 ml离心管中,常温1 000 r/min离心3 min,弃上清液。加PBS,吹打获得单细胞悬液。通过细胞计数将悬液浓度调节至1×107个/ml,放置冰上备用;③用浓度为75%的酒精消毒皮肤,1 ml注射器吸取0.2 ml(2×106个细胞)A375细胞悬液接种至裸鼠右后肢的背部皮下,每注射2只裸鼠,充分混匀细胞悬液后继续接种,接种完继续饲养,每天观察小鼠肿瘤的形成,测量肿瘤体积:用游标卡尺测量记录瘤径,长短径各测3次,求得长径均值a和短径均值b,肿瘤体积=1/2×a× b2。接种7 d后,选择造模成功的24只裸鼠,测定平均瘤体积和体重进行随机分组,分为模型组、芹菜素低剂量组(10 mg/kg)、芹菜素高剂量组(40 mg/kg),每组8只,给药21 d(药物用食用油溶解,灌胃给药;空白组与模型组给予不含药的食用油)。每隔3 d称取每只裸鼠的体重和瘤体积;④给药21 d后各组裸鼠颈椎脱臼处死,剪开皮肤,小心剥离整个瘤块,称重、拍照后用4%多聚甲醛液固定,备用。
1.2.3划痕实验检测芹菜素对A375黑色素瘤细胞迁移的影响A375细胞种至6孔板中,每孔加入浓度2×105个/ml细胞悬液2 ml,培养24 h后,细胞约长至80%~90%,吸弃上清,PBS洗1遍。用10μl枪头沿孔的中线垂直划痕,PBS洗2遍,加入含不同浓度对应药物的无血清培养基,设5个组:溶剂对照组、0μmol芹菜素组、1μmol芹菜素组、2μmol芹菜素组和4μmol芹菜素组,0和24 h分别在100倍镜下拍照。
1.2.4小管形成实验①将96孔板和无菌移液枪头置于-20℃冰箱中预冷过夜;将保存于-20℃冰箱中的MatrigelTM基底膜基质置于4℃冰箱中,缓慢解冻过夜待用;②将预冷的96孔板置于冰板上,每孔加入100μl MatrigelTM基底膜基质。将其置于4℃条件下10 min,再置于37℃、5%CO2及95%空气的细胞培养箱中30 min;③取指数生长期的HUVEC细胞(100 mm培养皿),弃培养液。加10 ml PBS洗涤1次,弃去PBS后,加入4 ml 0.25%胰蛋白酶-0.02% EDTA,37℃消化2 min后,向其加入5 ml完全培养基中和反应,吹打后将细胞转入15 ml离心管中,1 000 r/min离心3 min。配细胞悬液,用适量的基础培养基调整细胞浓度为1.5×105个/ml。96孔板,每孔缓慢加入100μl细胞混悬液;④除溶剂对照组,每孔加入等体积的A375细胞培养上清液0.2 ml进行培养。同时不同浓度的芹菜素(0~4μmol)作用24 h后,分别于显微镜下观察管腔形成并拍照记录。运用Image J软件分析管腔生成的长度。
1.2.5Western blot检测将约1×107个细胞加至蛋白裂解液,冰上静置30 min,低温12 000 r/min离心20 min,提取上清液。应用BCA定量法计算蛋白的浓度。取60μg总蛋白跑胶(恒压100μV),电转膜30 min。含5%脱脂奶粉的Tris缓冲盐和吐温20 (tris-buffered saline and tween 20,TBST)封闭1 h。一抗4℃冰箱过夜,二抗孵育1μh后显影。VEGF、表皮生长因子受体(epidermal growth factor receptor,EGFR)、MMP-9以及GAPDH抗体购自美国Cell Signaling公司。
1.3统计学方法
采用Graphpad 5.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用单因素方差分析和LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1芹菜素抑制A375细胞的体外增殖
体外不同浓度的芹菜素处理A375细胞24 h,结果表明,8μmol芹菜素初步抑制A375细胞的增殖,16和32μmol浓度时可以明显抑制肿瘤细胞的增殖,并且呈现一定的量-效关系(见图1)。本实验得出结论,在一定浓度范围内,芹菜素能浓度依赖性地抑制A375黑色素瘤细胞的增殖。
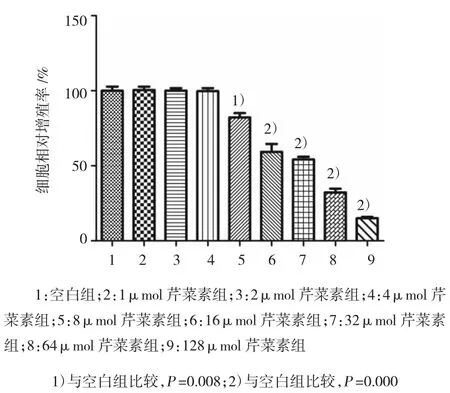
图1 芹菜素对A375黑色素瘤细胞增殖的影响
2.2芹菜素能抑制A375黑色素瘤的体内生长
裸鼠体内移植瘤实验结果发现,与模型组比较,芹菜素能明显减小A375黑色素瘤的体积和重量,且具有一定的剂量依赖性,表明芹菜素能抑制A375黑色素瘤的体内生长。见图2。
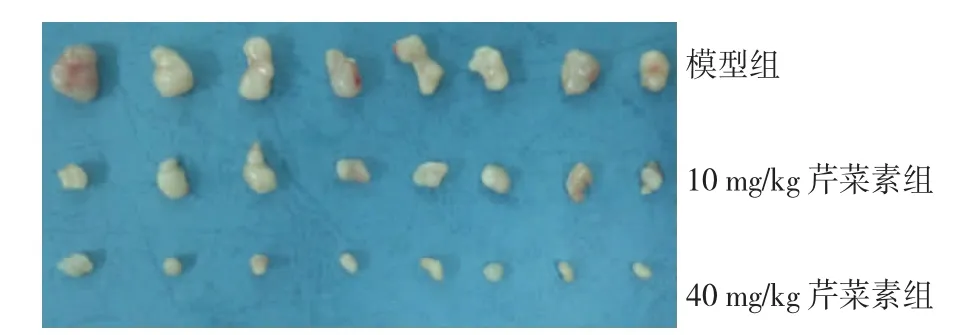
图2 芹菜素对裸鼠A375黑色素瘤皮下移植瘤体内生长的影响
2.3芹菜素能抑制A375黑色素瘤细胞的迁移
划痕实验中,选取对肿瘤细胞增殖无明显抑制作用的浓度:1、2和4μmol芹菜素处理A375细胞24 h,结果表明,1μmol芹菜素初步抑制A375细胞的迁移,2和4μmol可以明显抑制肿瘤细胞的迁移,并且具有一定的浓度依赖性(见图3)。本实验得出结论,芹菜素能抑制A375黑色素瘤细胞的迁移,且在一定浓度范围内,具有浓度依赖性。

图3 芹菜素对A375黑色素瘤细胞迁移的影响(×200)
2.4芹菜素能抑制黑色素瘤细胞条件培养下HUVEC形成小管的能力
小管形成实验中,选取4个不同浓度:0、1、2和4μmol芹菜素处理A375细胞24 h,结果表明,培养肿瘤细胞的上清液可以明显刺激小管形成。1μmol芹菜素对A375黑色素瘤细胞诱导的小管形成具有抑制作用,2和4μmol浓度可以显著抑制肿瘤细胞诱导的小管形成,并且具有一定的浓度依赖性(见图4)。本实验得出结论,芹菜素能抑制A375黑色素瘤细胞诱导的小管形成。
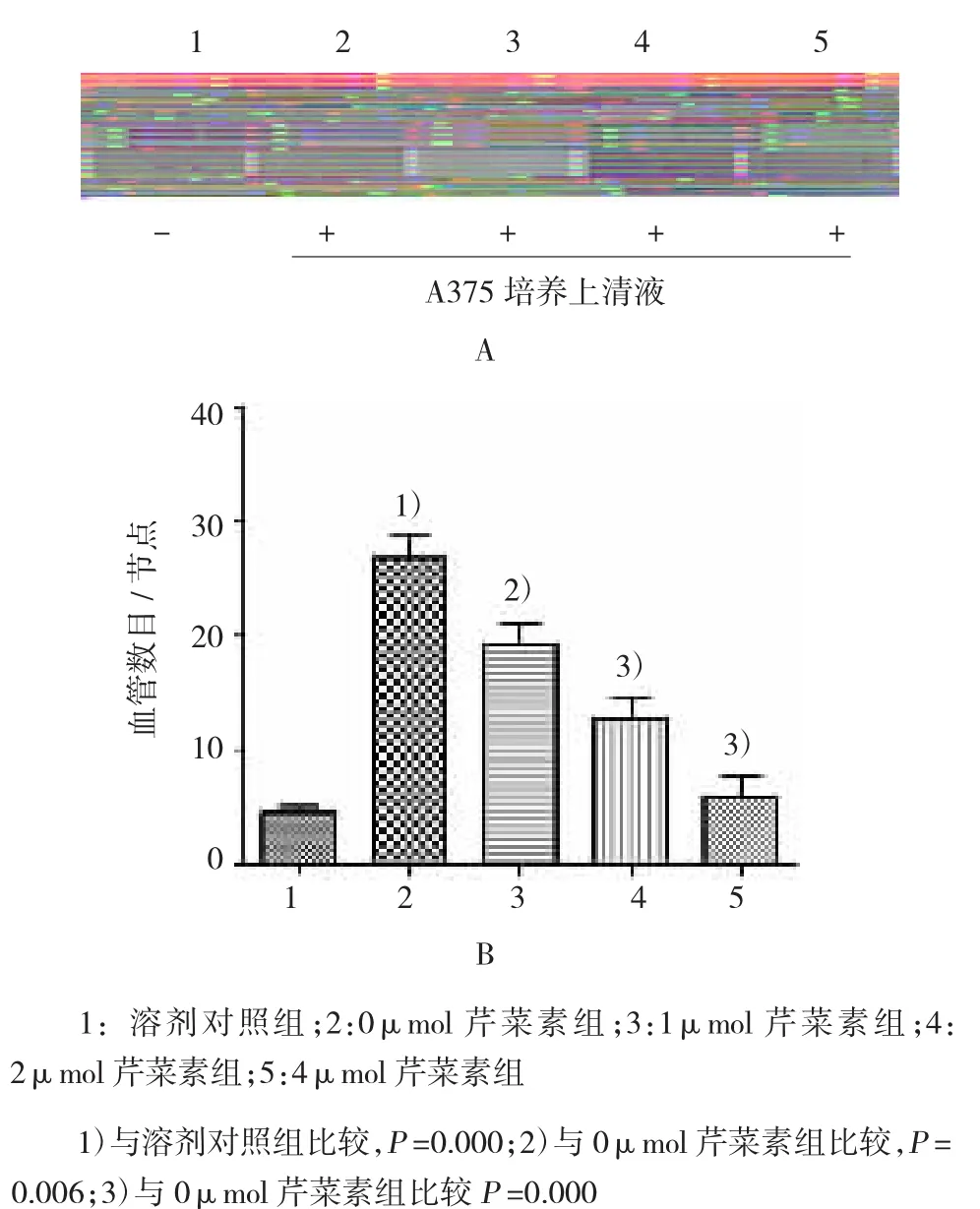
图4 芹菜素对肿瘤细胞诱导的小管形成的影响
2.5芹菜素能抑制VEGF、MMP-9、p-P38及p-Erk蛋白的表达
Western blot检测考察A375细胞中调控肿瘤细胞增殖及血管生成相关蛋白的表达,结果发现,芹菜素能显著降低VEGF、MMP-9、p-P38及p-Erk蛋白的表达,且具有浓度依赖性,但对t-P38及t-Erk蛋白表达无明显影响(见图5)。本实验得出结论,芹菜素能通过下调增殖及血管生成相关蛋白的表达,发挥抑制肿瘤增殖及血管生成的作用。
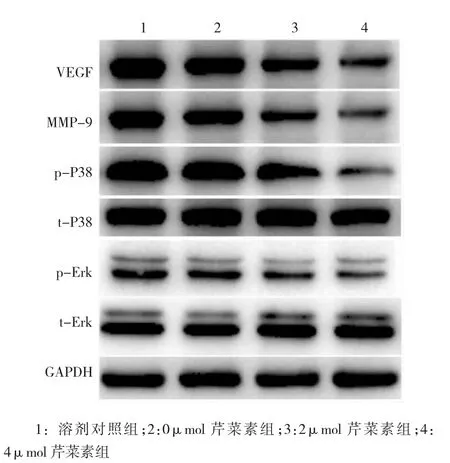
图5 芹菜素对A375肿瘤细胞调控增殖及血管生成相关蛋白表达的影响
3 讨论
大量研究表明,肿瘤的生长及转移与肿瘤血管生成密切相关[22-23],肿瘤血管的新生不仅能够为肿瘤细胞提供丰富的氧气和营养,同时还能将肿瘤细胞代谢产生的废物及时排出。芹菜是日常生活中经常食用的蔬菜之一。研究发现,芹菜的主要有效成分为芹菜素,而芹菜素具有多种药理作用。笔者研究的兴趣在于,对于经常食用芹菜的肿瘤患者来说,芹菜对其病情的进展究竟有何种作用。据此,本实验考察芹菜素对黑色素瘤相关生物学行为的影响,如增殖、迁移及血管生成等。同时本实验也从分子层面对芹菜素影响黑色素瘤相关生物学行为进行研究。诸多研究证实Ras/Raf信号通路,尤其是其下游蛋白P38及Erk在调控肿瘤细胞增殖的过程中发挥的关键作用[24],所以本实验考察这两种蛋白的表达以揭示芹菜素抑制黑色素瘤细胞增殖的可能机制。研究证实,VEGF是调控肿瘤血管生成最关键的调节因子[25],其水平的高低也反映血管生成的状况,因此本实验考察芹菜素对黑色素瘤细胞中VEGF蛋白的水平。MMP-9是调控肿瘤迁移及血管生成的重要因子之一,主要通过降解细胞外基质进而促进肿瘤细胞的迁移[26],因此本实验也考察芹菜素对黑色素瘤细胞中MMP-9蛋白表达的影响,结果发现,芹菜素能显著抑制A375黑色素瘤的体外增殖、迁移及体内肿瘤生长,同时芹菜素对A375黑色素瘤细胞诱导的血管生成具有明显抑制作用。芹菜素可能通过抑制肿瘤的血管生成,发挥抑制肿瘤增殖及生长的作用。机制研究部分发现,芹菜素能显著抑制Erk及P38蛋白表达,同时芹菜素对调控血管生成的VEGF及调控肿瘤细胞迁移的MMP-9蛋白具有显著抑制作用。本文不足之处在于,只在细胞水平对相关蛋白进行考察,缺乏对体内组织水平的蛋白考察,同时缺乏人黑色素瘤临床样本的相关研究,因此后期的研究重点会放在对黑色素瘤临床样本的考察上。
综上所述,芹菜素能够抑制A375黑色素瘤的生长、迁移及血管生成,芹菜素具有潜在临床应用价值。
参考文献:
[1] Swett er SM, Geller AC.Perspective: catch melanoma early [J].Nature, 2014, 515(7527): 117.
[2] Lo JA, Fisher DE.The melanoma revolution: from UV carcino genesis to a new era in therapeutics[J].Science, 2014, 346(6212): 945-949.
[3] Mun GH.Management of malignant melanoma [J].Arch Plast Surg, 2012, 39(5): 565-574.
[4] Choi YS, Fisher DE.UV and melanoma: the TP53 link[J].Cell Res, 2014, 24(10): 1157-1158.
[5] Akman T, Oztop I, Unek IT, et al.Long-term outcomes and prognostic factors of high-risk malignant melanoma patients after surgery and adjuvant high-dose Interferon treatment: a single-center experience[J].Chemotherapy, 2014, 60(4): 228-238.
[6] Cui C, Tang B, Guo J.Chemotherapy, biochemotherapy and anti-VEGF therapy in metastatic mucosal melanoma[J].Chin Clin Oncol, 2014, 3(3): 36.
[7] Ridolfi L, De Rosa F, Ridolfi R, et al.Radiotherapy as an immunological booster in patients with metastatic melanoma or renal cell carcinoma treated with high-dose interleukin-2: evaluation of biomarkers of immunologic and therapeutic response[J].J Transl Med, 2014, 12: 262.
[8] Demierre MF, Nathanson L.Chemoprevention of melanoma: an unexplored strategy[J].J Clin Oncol, 2003, 21(1): 158-165.
[9] Madhunapantula SV, Robertson GP.Chemoprevention of melanoma[J].Adv Pharmacol, 2012, 65: 361-398.
[10] Lapik IA, Sharafetdinov KHKH, Plotnikova OA, et al.Influence of dietotherapy on body composition in patients with obesity and diabetes mellitus type 2[J].Vopr Pitan, 2013, 82(1): 53-58.
[11] Sowbhagya HB.Chemistry, technology, and nutraceutical functions of celery (Apium graveolens L.): an overview[J].Crit Rev Food Sci Nutr, 2014, 54(3): 389-398.
[12] Saeed M, Kadioglu O, Khalid H, et al.Activity of the dietary flavonoid, apigenin, against multidrug-resistant tumor cells as determined by pharmacogenomics and molecular docking[J].J Nutr Biochem, 2015, 26(1): 44-56.
[13] Wang H, Yang L, Zu Y, et al.Microwave-assisted simultaneous extraction of luteolin and apigenin from tree peony pod and evaluation of its antioxidant activity[J].Scientific World Journal, 2014, 2014:Doi.org/10.1155/2014/506971.
[14] Li RR, Pang LL, Du Q, et al.Apigenin inhibits allergen-induced airway inflammation and switches immune response in a murine model of asthma[J].Immunopharmcol Immunotoxicol, 2010, 32(3): 364-370.
[15] Ginwala R, Mctish E, Raman C, et al.Apigenin, a natural flavonoid, attenuates EAE severity through the modulation of dendritic cell and other immune cell functions[J].J Neuroimmune Pharmacol, 2015, DOI: 10.1007/s11481-015-9617-x.
[16] Mafuvadze B, Cook M, Xu Z, et al.Effects of dietary apigenin on tumor latency, incidence and multiplicity in a medroxyprogesterone acetate-accelerated 7, 12-dimethylbenz (a) anthraceneinduced breast cancer model [J].Nutr Cancer, 2013, 65 (8): 1184-1191.
[17] Chan LP, Chou TH, Ding HY, et al.Apigenin induces apoptosis via tumor necrosis factor receptor and Bcl-2-mediated pathway and enhances susceptibility of head and neck squamous cell carcinoma to 5-fluorouracil and cisplatin[J].Biochim Biophys Acta, 2012, 1820(7): 1081-1091.
[18] Lin CC, Chuang YJ, Yu CC, et al.Apigenin induces apoptosis through mitochondrial dysfunction in U-2 OS human osteosarcoma cells and inhibits osteosarcoma xenograft tumor growth in vivo[J].J Agric Food Chem, 2012, 60(45): 11395-11402.
[19] Lu HF, Chie YJ, Yang MS, et al.Apigenin induces apoptosis in human lung cancer H460 cells through caspase and mitochondria-dependent pathways[J].Hum Exp Toxicol, 2011, 30(8): 1053-1061.
[20] Shukla S, Bhaskaran N, Babcook MA, et al.Apigenin inhibits prostate cancer progression in TRAMP mice via targeting PI3K/Akt/FoxO pathway[J].Carcinogenesis, 2014, 35(2): 452-460.[21] Lee Y, Sung B, Kang YJ, et al.Apigenin-induced apoptosis is enhanced by inhibition of autophagy formation in HCT116 human colon cancer cells[J].Int J Oncol, 2014, 44(5): 1599-1606.[22] Yang JH, Hu J, Wan L, et al.Barbigerone inhibits tumor angiogenesis, growth and metastasis in melanoma[J].Asian Pac J Cancer Prev, 2014, 15(1): 167-174.
[23] Dong Y, Zhang T, Li J, et al.Oridonin inhibits tumor growth and metastasis through anti-angiogenesis by blocking the notch signaling[J].PLoS One, 2014, 9(12): DOI: 10.1371/journal.pone.0113830.
[24] Liu Z, Zhu P, Tao Y, et al.Cancer-promoting effect of capsaicin on DMBA/TPA-induced skin tumorigenesis by modulating inflammation, Erk and p38 in mice [J].Food Chem Toxicol, 2015, 81: 1-8.
[25] Fantozzi A, Gruber DC, Pisarsky L, et al.VEGF-mediated angiogenesis links EMT-induced cancer stemness to tumor initiation[J].Cancer Res, 2014, 74(5): 1566-1575.
[26] Deryugina EI, Zajac E, Juncker-Jensen A, et al.Tissue-infiltrating neutrophils constitute the major in vivo source of angiogenesis-inducing MMP-9 in the tumor microenvironment [J].Neoplasia, 2014, 16(10): 771-788.
(童颖丹编辑)
临床论著
Effects of apigenin on growth, migration and angiogenesis of melanoma A375 cells and the mechanism
Hong-tao Xu1, Zhong-bao Han1, Hui-li Zhang1, Lin-wei Ma1, Min-chen Wang2
(1.Department of Clinical Medicine, Yancheng Institute of Health Sciences, Yancheng, Jiangsu 224005, China; 2.Department of Anatomy, Medical College, Soochow University, Suzhou, Jiangsu 215123, China)
Abstract:Objective To study the effects of apigenin on proliferation, migration and angiogenesis of human melanoma A375 cells and the mechanism of action.Methods The effects of apigenin on the proliferation of A375 cells were evaluated by the MTS method, and those on the in vivo growth of melanoma were assessed by establishing a subcutaneous xenograft model of nude mice.The influence of apigenin on in vitro cell migration was detected using the scratch assay, and that on the angiogenesis of human melanoma was detected by the tube formation assay.The regulatory effects of apigenin on the expressions of proliferationand angiogenesis-related proteins such as vascular endothelial growth factor (VEGF), matrix metalloproteinase-9 (MMP-9), phosphorylated p38 (p-p38), t-p38, phosphorylated ERK (p-ERK) and t-ERK were detected by Western blot.Results After in vitro treatment of A375 cells with apigenin, their in vitro proliferation and in vivo growth were significantly inhibited compared with those of the control group, and the migration capacity was also significantly lowered.Apigenin inhibited tumor cell-induced angiogenesis in the tube formation assay.Molecular mechanism study showed that apigenin inhibited the protein expressions of angiogenesis -related VEGF and MMP-9 as well as proliferation-related p-p38 and p-ERK.Conclusions Apigenin can inhibit thebook=1,ebook=52growth, migration and angiogenesis of melanoma A375 cells, probably by suppressing the expressions of proliferation- and angiogenesis-related proteins.
Keywords:apigenin; melanoma; proliferation; migration; tumor angiogensis; molecular mechanism
收稿日期:2015-09-09
文章编号:1005-8982(2016)01-0046-06
中图分类号:R739.5
文献标识码:A

