种植体周围龈沟液中IL- 8水平的研究进展
雷泽茹 焦艳军.山西医科大学口腔医学系,山西太原 03000;2.山西医科大学第一医院口腔科,山西太原 03000
种植体周围龈沟液中IL- 8水平的研究进展
雷泽茹1焦艳军2▲
1.山西医科大学口腔医学系,山西太原030001;2.山西医科大学第一医院口腔科,山西太原030001
[摘要]种植体周围龈沟液与天然牙龈沟液的生物学特性相似,当种植体周围出现炎症时龈沟液量增多,其中多种炎性介质也相应增加,IL-8作为趋化因子家族中的成员,对炎症和免疫过程有重要的调节作用。本文就种植体周围龈沟液中IL-8水平的研究进展做一综述。
[关键词]种植体周围龈沟液;IL-8;种植体周围炎;牙周炎
种植体周围炎(peri-implantitis)是指已获得骨整合的种植体周围的黏膜出现炎症和牙槽骨发生骨吸收。其临床表现为边缘龈的充血、红肿、探诊出血、溢脓、进展性的骨吸收,X线牙片显示可见近远中有V型的低密度透影区[1]。种植体周围炎是引起种植体失败的重要原因之一。
目前临床上检测种植体周围炎症的发展情况基于患者的主诉及探诊检查和影像学检查,而该疾病早期并无明显自觉症状,很难判断疾病的发展情况。龈沟液(gingival crevicular fluid,GCF)是龈沟内上皮和结合上皮从牙龈结缔组织渗入到龈沟内的液体,由血清、邻近的牙周组织(上皮、结缔组织)及细菌等成分组成[2]。与天然牙一样,种植体周围也有龈沟液(peri-implant crevicular fluid,PICF),两者生物学特性相似,PICF在种植体周组织的防御体系中起着重要作用,研究其龈沟液的量及其中成分的变化,对了解种植体周疾病有重要意义。
1 龈沟液的成分及意义
血清作为龈沟液中其他物质的载体,是由牙龈结缔组织毛细血管在一定渗透梯度下通过沟内上皮、结合上皮渗出形成,牙周组织及细菌释放的物质融入其中,形成成分多样的龈沟液。因其内容物主要由牙周组织释放,对牙周疾病具有重要指导意义。Goodson[3]研究发现牙龈健康者的龈沟液流速率约为(3~8)μL/h,中度牙周病患者的牙周袋中龈沟液流速率约为20 μL/h,而在侵袭性牙周病患者相关位点的龈沟液流速率高达137 μL/h。随着牙周炎症加重,龈沟液量增加,其冲洗沟内外来物质的作用越明显。另外,大量文献提示,牙周及种植体周炎症程度与龈沟液中相关成分的含量呈正相关,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、前列腺素E2(prostaglandin E2,PGE2)、白细胞介素类(interleukin,IL)、基质金属蛋白酶(matrix metalloproteinase,MMP)等。细胞因子及酶类维持在正常水平有助于牙周组织的健康,起到一定的防御及维护作用;当水平升高后,细胞因子及酶类的致炎作用显现,导致牙周组织毛细血管扩张、中性粒细胞增多、骨及胶原纤维吸收等。
2 IL-8相关特性
IL-8作为趋化因子家族的成员,是体内炎性反应应答的主要介质之一,感染或伴有中性粒细胞增多或浸润的炎性反应,如溃疡性肠炎、动脉粥样硬化、急性呼吸窘迫综合征[4]、类风湿关节炎、肾盂肾炎等,均有研究证明与IL-8水平升高相关。
早期发现IL-8主要由单核细胞产生,脂多糖(lipopolysaccharide,LPS)刺激单核细胞3 h后开始产生IL-8,并在12 h产生达到高峰。后来大量研究发现间质细胞、内皮细胞、巨噬细胞、成纤维细胞、角质细胞、淋巴细胞、中性粒细胞、多种肿瘤细胞等亦能产生IL-8,这些细胞类型在TNF-α、IL-1β的诱导下能产生大量IL-8[5,6]。Mosher等[7]发现在子宫平滑肌细胞中IL-1β可使IL-8的含量升高。植物血凝素(plant hemoagglutinin,PHA)、热休克蛋白60(heat shock protein 60)[8]、粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor,GM-CSF)、细菌、病毒等均能诱导IL-8的产生。
IL-8属于趋化因子CXC家族,基因定位于4号染色体的q13~q21部位,全长3211 bp,包括4个外显子和3个内含子,分子量8.3kDa[5],在α亚族中,IL-8与生长相关癌基因-α(growth related oncogene-α,GRO-α)、GRO-β、GRO-γ、中性粒细胞激活肽-78 (epithelial neutrophil activatingprotein-78,ENA-78)和中性粒细胞激活肽-2(neutrophilactivating peptide-2,NAP-2)相对有较高同源性。
IL-8对中性粒细胞具有趋化作用,并促使其脱颗粒,产生呼吸爆发,启动超氧化物(O2-、H2O2)和溶酶体酶等释放,促进中性粒细胞吞噬,导致机体局部炎症反应。IL-8还可上调Macl抗原(CD11b/CD18)的表达,促进中性粒细胞粘附到内皮细胞和内皮细胞下的基质蛋白[9]。IL-8还可趋化嗜碱性粒细胞,并刺激其释放组织胺,可能与速发型超敏反应的发生有关。此外,还可刺激GM-CSF或IL-5预先处理的嗜酸性粒细胞的脱颗粒作用。IL-8可趋化IL-2活化的NK细胞。在单核细胞存在的条件下,IL-8可趋化部分静止的CD4+或CD8+T细胞。
3 IL-8的信号转导通路
IL-8受体有两种,分别为CXCR-1和CXCR-2,IL-8与受体结合后,信号因受体结构变化传导至细胞内,同时活化Gαβγ。活化的Gαβγ可激活RasGTPRat-Mek-Erkl复合体[10]、PLC-IP3/DAG-PKC信号通路以及PI-3K信号通路等。这些信号传导通路可启动钙动员,促进蛋白质的翻译和调节缺氧诱导因子-l (hypoxia-induciblefactor-1,HIF-1)、激活蛋白-l(activator protein-,AP-1)、信号转导子与转录激活子基因(signal transducers and activatorsoftranscription 3,STAT3)、β-连环蛋白(β-catenin)以及核因子-κB(nuclear factor-kappa B,NF-κB)等一系列转录因子的活性。NF-κB与多种细胞因子基因活化有关,它能调节多种炎症因子的转录水平,以调节破骨细胞分化成熟或程序性死亡[11],抑制NF-κB能显著减少IL-8的表达[12]。
另外,IL-8与CXCR2结合后可在内皮细胞中刺激产生血管内皮生长因子(VEGF),以自分泌的方式促进VEGF受体的活化[13],对新生血管形成具有重要作用。Joh T等[14]研究发现IL-8与表皮生长因子受体(epidermal growth factor receptor,EGFR)的相互作用可激活整合素和金属蛋白酶,活化受体从而促进细胞增殖。
4 IL-8与牙周炎
牙周炎是导致牙齿支持组织破坏的细菌感染性疾病。牙周病原菌多为革兰阴性的兼性厌氧菌和专性厌氧菌,如伴放线放线杆菌(Aa)、牙龈卟啉单胞菌(Pg)等,能够释放LPS,在LPS的刺激下,牙周膜细胞、牙龈成纤维细胞中均有IL-8的表达。IL-8可以趋化中性粒细胞等多种炎性细胞转移至牙周组织[15],从而在牙周炎的发生发展过程中起到重要作用。
黄亚莉等[16]研究发现牙周炎患者血清中IL-8含量与正常组无显著差异,而龈沟液中IL-8含量高于正常组9倍之多。Gamonal等[17]研究发现牙周炎患者牙龈中IL-8水平较健康者升高,但经过牙周治疗后显著下降,提示IL-8参与牙周炎的炎症过程。张雪飞等[18]通过对40位伴冠心病的慢性中、重度牙周炎患者内科维护治疗合并牙周基础治疗前后血脂指标及血清中IL-8水平进行检测,结果在治疗后2个月患者的血脂指标中部分显著改善,血清IL-8水平明显降低,牙周检查指标均有好转,认为牙周基础治疗可以改善牙周炎症,并降低血清中IL-8的水平。Ertugrul 等[19]对人健康组、牙龈炎组、慢性牙周炎组及侵袭性牙周炎组龈沟液中CCL28、IL-8、IL-1β和TNF-α进行ELISA检测,认为可将这些因子作为牙周组织炎症活动标记物。Millhouse等[20]在体外培养口腔上皮细胞并在其中建立多菌种菌斑生物膜模型,与细胞对照组相比,上皮细胞和生物膜共同培养组IL-8的蛋白水平在4 h及24 h显著升高,使用RT2 Profiler比较IL-8基因在4 h后两组的表达情况,发现IL-8较对照组增加249.8倍,在24 h后使用荧光定量PCR测得IL-8较对照组含量升高,差异有统计学意义(P<0.05)。
Guo等[21]通过使用集成微阵列分析,发现包括IL-8、IL-1β、ICAM-1等生物标记的基因为枢纽基因(hub-genes),其中IL-8基因在蛋白质间相互作用网络(protein-protein interaction networks)中的程度最高。
5 IL-8与种植体周围炎
种植体周围软组织中沟内上皮、结合上皮在外形和功能上与天然牙牙周软组织结构相似,在临床与组织学上有许多共性,但也有一些重要差异,虽然健康的种植体周围黏膜与牙龈在外形上无明显差异,但是与天然牙牙周组织不同,与种植体相邻接的结缔组织细胞、血管成分少,含有丰富的胶原和很少的细胞基质,在组织学上类似于瘢痕组织,种植体周围牙槽骨上方的结缔组织没有牙周膜和龈牙纤维束,因此,与天然牙相比,种植体周围组织的防御及修复能力较弱,一旦细菌突破上皮组织,可直达骨面,进展迅速。
Zhuang等[22]使用实时定量聚合酶链反应对22例中国患者健康牙周、种植体周及炎症组6种牙周病原菌进行检测及定量,研究发现各组均可检出牙周病原菌,且检出率差异无统计学意义。种植体周围炎与牙周炎相似,从病因、发病机制、风险评估、诊断及治疗上没有本质的区别[23]。
Pietruski等[24]观察发现种植体植入24 h后龈沟液中IL-8水平明显升高,因此说明术后当天存在局部炎症,手术创伤必然带来局部机体组织的再生与修复,IL-8水平在术后4个月下降。邹德荣等[25]研究发现种植体周围炎患者龈沟液中IL-8的水平高于健康种植体组。Recker等[26]采用多重蛋白质免疫组学分析方法对73位患者PICF(种植体负载≥6个月)及对侧健康牙GCF中IL-1β、IL-6、IL-8等进行检测,结果显示IL-1β、IL-8与种植体周探针深度呈显著正相关。Bordin等[27]在一项体外研究中发现牙周炎及种植体周围炎的炎性位点的成纤维细胞较正常牙龈成纤维细胞中的IL-6、IL-8多,表现出显著的促炎症反应。但Severino等[28]研究发现虽然IL-6、IL-8与种植体周围炎存在显著正相关,但其与健康组无显著差异。
6 结语
综上所述,大量研究文献提示IL-8在牙周炎及种植体周围炎的发生发展中起到重要作用:细菌释放LPS刺激单核细胞、牙周组织细胞等产生IL-1β、IL-6、 IL-8、TNF-α等细胞因子,①IL-8通过自分泌/旁分泌的方式使其水平增高,与受体结合开放各种下游效应分子,激活相关信号通路,作用于牙周;②募集外周血中性粒细胞至炎症位点,发挥其生物特性,释放超氧化物及溶酶体酶杀灭细菌,但随着中性粒细胞的增多,牙周组织亦受到重创:胶原纤维基质降解、刺激破骨细胞导致骨吸收;③IL-8通过刺激内皮细胞产生VEGF,促进血管生成,导致周围渗透液量增加;④随着IL-8水平的升高,IL-8可逆行进入外周血,对宿主其他器官的炎症区域起到致炎作用,如冠状动脉硬化斑块、肾炎、支气管哮喘等。
随着牙种植技术的不断发展,因其舒适美观、接近天然牙的形态及功能,逐渐成为患者修复缺牙的最佳方法,成功率的增高亦伴随着一些并发症。未来,种植体周围炎将成为广大口腔医师必须面对的一大难题,而IL-8在其中的重要作用不言而喻,其在种植体周围炎中的作用机制尚未完全明确,需进一步研究,为该疾病的监测及治疗提供帮助。
[参考文献]
[1]林野.口腔种植学[M].北京:北京大学医学出版社,2014:379-380.
[2]孟焕新.牙周病学[M].第3版.北京:人民卫生出版社,2008:62-63.
[3] Goodson J Max. Gingival crevice fluid flow[J]. Periodontology,2003,31:43-54.
[4] Timothy Craig Allen,Anna Kurdowska. Interleukin 8 and acute lung injury[J]. Archives of Pathology&Laboratory Medicine,2014,(138):266-269.
[5]王茸,张森.支气管哮喘患儿血清中IL-8,SIL-2R水平变化及意义[J].当代医学,2010,16(9):47.
[6] Giovanna E Carpagnano,Grazia P Palladino,Donato Lacedonia1,et al. Neutrophilic airways inflammation in lung cancer:The role of exhaled LTB-4 and IL-8[J]. BMC Cancer,2011,11:226.
[7] Mosher Andrea A,Rainey Kelly J,Giembycz Mark A,et al. Prostaglandin E2 represses interleukin 1 beta -induced inflammatory mediator output from pregnant humanmy ometrial cells through the EP2 and EP4 receptors[J]. Biol Reprod,2012,87(1):1-10.
[8] Lin CS,He PJ,Hsu WT,et al. Helicobacter pyloriderived heat shock protein 60 enhances angiogenesis via a CXCR2-mediated signaling pathway[J]. Biochem Biophys ResCommun,2010,397:283-289.
[9]姚俊,赵霞. IL-8与哮喘气道炎症关系及中医药对其拮抗作用的研究进展[J].上海中医药杂志,2014,48(12):94-96.
[10] Choi EY,Park ZY,Choi EJ,et al. Transcriptional regulation of IL-8 byironchelator in human epithelial cells is independent from NF-κBbut involves ERK1/2 and p38 kinase-dependent activation of AP-1[J]. Cell Biochem,2007,102(6):1442-1457.
[11]孟庆阳,郑嵘,朱阳,等.破骨细胞分化因子及其信号转导通路[J].国际口腔医学杂志,2015,42(2):189-192.
[12] BischoffDS,Zhu JH,Makhijani NS,et al. Acidic pH stimulates the production of the angiogenic CXC chemokine,CXCL8(interleukin-8),inhuman adult mesenchymal stemcells via the extracellular signal-regulated kinase,p38 mitogen -activated proteinkinase,and NF -κBpathways[J]. Cell Biochem,2008,104(4):1378-1392.
[13] Martin D,Galisteo R,Gutkind JS. CXCL8/IL8 stimulates vascular endothelial growth factor(VEGF)expressionand the autocrine activation of VEGFR2 in endothelial cells by activating NFkappaB through the CBM(Carma3/Bcl10/ Malt1)complex[J]. Biol Chem,2009,284:6038-6042.
[14] Joh T,Kataoka H,Tanida S,et al. Helicobacter pyloristimulated interleukin-8(IL-8)promotes cell proliferation through transactivation of epidermal growth factor receptor(EGFR)by disintegrin and metalloproteinase (ADAM)activation[J]. Dig Dis Sci,2005,50:2081-2089.
[15] Yamamoto T,KitaM,Kimura I,et al. Mechanical stress induces expression of cytokinesin human periodontal ligament cells[J]. Oral Dis,2006,12(2):171-175.
[16]黄亚莉,陈曦,张苏丽,等.牙龈炎、牙周炎患者龈沟液和血清中白细胞介素-8的含量及其与牙周指数的相关性[J].西安交通大学学报(医学版),2007,28(3):328-330.
[17] Gamonal J,Acevedo A,BasconesA,et al. Characterizationof cellularinfiltrate,detectionof chemokine receptor CCR5 and interleukin -8 and RANTES chemokines in adult periodontitis[J]. Periodontol Res,2001,36(3):194-203.
[18]张雪飞,潘亚萍,常春荣.牙周基础治疗对伴发冠心病的慢性牙周炎患者血清IL-8及血脂水平的影响[J].中国实用口腔科杂志,2014,7(6):360-362.
[19] Ertugrul AS,Sahin H,Dikilitas A,et al. Comparison of CCL28,interleukin-8,interleukin-1β and tumor necrosis factor -alpha in subjects with gingivitis,chronic periodontitis and generalized aggressive periodontitis[J]. Periodontal Res,2013,48(1):44-51.
[20] Millhouse Emma,Jose Anto,Sherry Leighann,et al. Development of an in vitro periodontal biofilm model for assessing antimicrobial and host modulatory effects of bioactive molecules[J]. BMC Oral Health,2014,14:80.
[21] Guo XX,Wang YL,Wang CL,et al. Identification of several hub-genes associated with periodontitis using integrated microarray analysis[J]. Molecular Medicine Reports,2015,11:2541-2547.
[22] Zhuang LF,Watt RM,Mattheos N,et al. Periodontal and peri-implant microbiota in patients with healthy and inflamed periodontal and peri-implant tissues[J]. Clin Oral Implants Res,2014,14:1-9.
[23] Lisa JA,Heitz-Mayfield,Niklaus P Lang. Comparative biology of chronic and aggressive periodontitisvs. Peri-implantitis[J]. Periodontology,2010,53(1):167-181.
[24] Pietruski JK,Pietruska MD,Stokowska W,et al. Serum levels of interleukin-1(IL-1),interleukin-6(IL-6)and interleukin-8(IL-8)in patients treated with dental implants[J]. Rocz Akad Med Bialymst,2001,46:28-37.
[25]邹德荣,朱红,瞿晓辉.种植体周围龈沟液中白细胞介素-8含量的测定[J].华西口腔医学杂志,2005,23(4):292-294.
[26] Recker Erica N,Gustavo Avila-Ortiz,Fischer Carol L,et al. A cross-sectional assessment of biomarker levels around implants versus natural teeth in periodontal maintenance patients[J]. Periodontol,2015,86(2):264-272.
[27] Bordin S,Flemmig TF,Verardi S. Role of fibroblast populations in peri-implantitis[J]. Oral Maxillofac Implants,2009,24:197-204.
[28] Severino VO,Napimoga MH,de Lima PereiraSA. Expression of IL-6,IL-10,IL-17 and IL-8 in the peri-implant crevicular fluid of patients with peri-implantitis[J]. Oral Biol,2011,56(8):823-828.

图1 BALF中TGF-β1水平与BA发作程度相关性(见内文第18页)

图2 鱼刺(见内文第62页)

图3 竹签(见内文第62页)

图4 该X线片患者为男性,45岁,拍摄部位骶髂、髋关节,从图中可见双侧骶髂关节面欠光整,关节面增白,关节间隙变窄,诊断为Ⅲ级AS(见内文第123页)

图5 该CT患者同上述患者,拍摄部位骶髂关节,从图中可见双侧骶髂关节面毛糙,关节间隙变窄,诊断为骶髂关节CT的Ⅲ级病变(见内文第123页)

图6 该MRI患者为男性,22岁,拍摄部位骶髂关节,从图中可见左侧骶髂关节面局部不光滑,髂骨面下见斑片状异常信号影,考虑炎性病变,诊断骶髂关节MRI的Ⅱ级损害(见内文第123页)

图7 甲状腺腺瘤,形态规则,可见侧壁声影(见内文第127页)

图8 甲状腺囊腺瘤,包膜完整、内部絮状回声(见内文第127页)
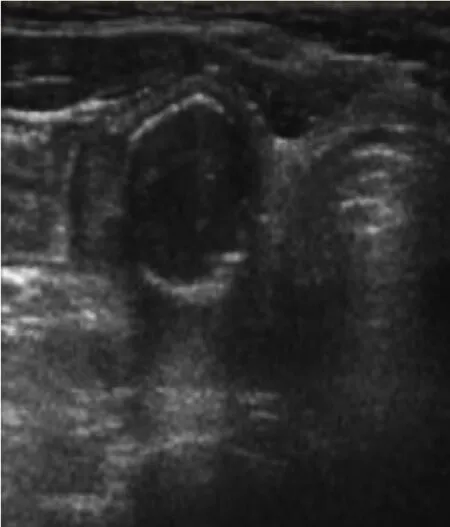
图9 甲状腺腺瘤周边环状钙化(见内文第127页)
The advancement of the level of IL-8 in the peri-implant crevicular fluid
LEI Zeru1JIAO Yanjun2
1.Stomatological Department of Shanxi Medical University, Taiyuan 030001, China; 2.Department of Stomatology, the First Hospital of Shanxi Medical University, Taiyuan 030001, China
[Abstract]The biological characteristic of the peri-implant crevicular fluid(PICF)is similar to the natural gingival crevicular fluid(GCF), and with the amount of PICF increased, the inflammatory mediators content in it increased as well. As a member of the family of chemokines, interleukin-8(IL-8)plays an important role in the regulation of inflammation and immunity. In this paper, the research progress of the level of IL-8 in PICF is reviewd.
[Key words]Peri-implant crevicular fluid; Interleukin-8; Peri-implantitis; Periodontitis
收稿日期:(2015-10-12)
通讯作者▲
[基金项目]山西省科技攻关项目(20140313014-8)
[中图分类号]R783
[文献标识码]A
[文章编号]1673-9701(2016)01-0165-04

