不同时间头针对MCAO大鼠脑皮质JAK2/STAT5信号通路的影响*
梁 超,陈邦国,王静芝,姜 涛
(1.海口市中医医院,海南海口 570216;2.湖北中医药大学针灸骨伤学院,武汉 430000)
不同时间头针对MCAO大鼠脑皮质JAK2/STAT5信号通路的影响*
梁 超1,陈邦国2,王静芝2,姜 涛1
(1.海口市中医医院,海南海口 570216;2.湖北中医药大学针灸骨伤学院,武汉 430000)
目的:观察不同时间头针对MCAO大鼠脑皮质JAK2/STAT5信号通路的影响。方法:将100只SD大鼠按随机数字表法分为正常对照组和假手术组各10只,模型组和头针组各40只,采用大脑中动脉线栓法(MCAO)制备模型,电针头穴“顶颞前斜线”、“顶颞后斜线”进行治疗。HE染色观察脑皮质病理形态,ELISA检测IL-6含量,Western Blotting法检测脑皮质P-JAK2、PSTAT5蛋白含量。结果:HE染色后见神经元和胶质细胞肿胀、缩小、变形,胞浆嗜伊红浓染,胞质疏松,微血管损伤,头针后损伤明显减轻;除IR 24 h外,头针组IL-6含量均多于模型组,特别是IR 48 h差异最明显;IR 12 h和IR 72 h,头针组P-JAK2蛋白含量较模型组明显增多;头针后MCAO大鼠P-STAT5蛋白表达较模型组增加明显。结论:头针能有效减轻脑缺血再灌注大鼠缺血局部脑皮质的早期炎症反应,这可能与其促进JAK2/STAT5信号通路磷酸化有关。
MACO大鼠;头针;IL-6;P-JAK2;P-STAT5
JAK-STAT信号途径是一条多种细胞因子共用作用的传导通路,大脑缺血缺氧后参与细胞的增殖、分化、凋亡以及免疫调节等生物学过程[1-2]。通过调控JAK2/STAT5信号通路可以影响神经元、胶质细胞、血管内皮细胞等凋亡、增殖和分化,由此保护神经元,减轻炎症反应,促进神经功能重塑,以修复缺血脑组织的损伤[3]。本实验以此理论为基础,观察头针治疗后缺血脑皮质中 IL-6含量变化和JAK2/STAT5信号通路的激活情况,探讨头针疗法减轻脑缺血再灌注损伤可能的作用机制。
1 材料与方法
1.1 动物
健康成年清洁级SD大鼠100只(华中科技大学同济医学院实验动物中心提供,许可证号SCXK (鄂)2014-0009),雌雄不拘,体质量(200±20)g。于实验前1周一次性购进,饲养于安静、温暖且避强光的环境中,室温(20±2)℃,自由饮水饮食。
1.2 主要试剂与仪器
1.2.1 试剂 P-JAK2兔抗大鼠多克隆抗体、P-STAT5兔抗大鼠多克隆抗体、HRP标记山羊抗兔抗体(以上抗体均购自KPL公司),SDS-PAGE凝胶制备试剂盒、蛋白抽提试剂盒、Bradford蛋白浓度测定试剂盒、PMSF(苯甲基磺酸氟100 mM)、磷酸化蛋白酶抑制剂、丽春红染液、考马斯亮蓝G250染液、抗体洗脱液、显影定影液(均购自谷歌生物),超敏ECL化学发光试剂盒BeyoECL Plus(碧云天生物技术研究所),牛血清白蛋白(Roche,北京索莱宝科技有限公司),蛋白Marker(10-170 kDa,Fermentas),白细胞介素-6(IL-6)双抗体夹心酶联免疫吸附法(ELISA)试剂盒(美国Sigma公司)。
1.2.2 主要仪器 电泳仪(北京市六一仪器厂,型号DYY-6C)、转移电泳仪槽(北京市六一仪器厂,型号DYCZ-400D)、垂直电泳槽(北京市六一仪器厂,型号DYCZ-24DN)、台式离心机(上海安亭科学仪器厂,型号TGL-16c)、磁力搅拌棒(常州澳华仪器有限公司,型号79-1)、脱色摇床(北京六一仪器厂,型号WD-9405A)、水浴锅(姜堰市天力医疗器械厂有限公司,型号TL-420D)、暗匣(广东粤华医疗器械厂有限公司,型号AX-Ⅱ)。
1.3 分组
100只SD大鼠按随机数字表法分为模型组(按缺血再灌注12 h、24 h、48 h、72 h分4个亚组)、头针组(按以上缺血再灌注时间分别加头针刺激,分4个亚组),每个亚组10只,假手术组和正常对照组各10只。
1.4 模型制备方法
参照Longa[4]线栓法加以改进,制备MCAO模型。大鼠造模前禁食不禁水24 h,称重,以10%水合氯醛0.3 ml/100 g腹腔注射麻醉;仰卧固定于手术台,常规备皮消毒,颈部正中切口,钝性分离皮下筋膜和肌肉,暴露并分离出右侧颈总动脉(Common carotid arternal,CCA)、颈内动脉(Internal carotid artery,ICA)、颈外动脉(External carotid artery,ECA)。电凝ECA的分支,结扎游离ECA主干,分离ICA主干至翼腭动脉(Pterygo palatine artery,PPA),并在其起始部和CCA的近心端各置一动脉夹。将ECA残端轻拉向下剪0.2 mm小口,轻推尼龙线尾端经CCA分叉部沿ICA入颅至大脑中动脉(Middle cerebral artery,MCA),在线栓经 MCA和PPA分叉处时用玻璃分针调整方向,以便线栓顺利进入MCA。尼龙线插入深度由CCA分叉部计约18 mm。栓塞60 min拉出尼龙线,使血流再灌。缝合切口,切口处涂洒青霉素粉并用碘酒消毒。手术后大鼠室温下禁食给水喂养,苏醒后进行神经功能障碍评分以判断是否造模成功。只有神经功能障碍在1级以上的大鼠保留。
1.5 治疗方法
根据中国针灸学会制定的《头皮针穴名国际标准化方案》,选取双侧顶颞前斜线、顶颞后斜线,并结合《实验针灸学》大鼠穴位图谱模拟人体经穴定位。顶颞后斜线:“百会”(顶骨正中点)至“曲鬓”(为耳缘直上与耳尖水平线的交点);顶颞前斜线:顶颞后斜线向前平移0.1寸。针刺方法:选用30号1寸一次性无菌针灸针,分别从顶骨中点向耳根前与头皮呈15°夹角透刺0.5~0.8寸,快速捻转至针下沉涩感后,同侧头穴为一对,接LH202H型韩氏穴位神经刺激仪,采用疏密波,频率2 Hz/100 Hz,强度1 mA,每次持续刺激30 min。头针IR12组的治疗在大鼠手术苏醒后12 h进行,以后的治疗每隔24 h进行1次,并于取材前2 h行最后1次治疗。正常对照组、假手术组和模型组按治疗时间同样抓取,不进行任何治疗。连续观察10 d,详细观测、记录各组大鼠的一般情况、体质量和血压。
1.6 观察指标及检测方法
1.6.1 HE染色法观察缺血局部脑皮质病理形态变化 大鼠灌注后迅速取脑,剥离脑膜除去嗅球、延髓和小脑,在视交叉平面前后2 mm处将脑冠状切开,所取组织置于固定液中进行脱水、包埋、切片,用二甲苯和无水乙醇进行切片脱蜡,放入Harris苏木素染3~8 min,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗;再入伊红染液中染色1~3 min;将切片依次放入95%酒精I 5 min-95%酒精II 5 min-无水乙醇Ⅰ5 min-无水乙醇Ⅱ5 min-二甲苯Ⅰ5 min-二甲苯Ⅱ5 min中脱水至透明后晾干,中性树胶封片。
1.6.2 IL-6含量测定 采用酶联免疫吸附法检测,具体操作按试剂盒说明书进行。
1.6.3 P-JAK2、P-STAT5蛋白含量测定 颈椎脱臼法处死大鼠,冰上剥取脑皮质充分匀浆(在碎冰块中进行),振荡并冰浴30 min,12000 g离心5 min,收集上清为总白蛋白液,-80℃保存备用;采用Bradford方法测定蛋白浓度,在40 μg蛋白标本中加入适当体积的5×蛋白上样缓冲液,95~100℃处理5 min;根据蛋白质20KD相对分子量选用对应浓度的分离胶,按浓缩胶75 V、分离胶120 V进行恒压电泳,至溴酚蓝刚出胶;以200 mA/h为条件进行转膜;脱色摇床上用5%的脱脂牛奶(0.5%TBST配)封闭30 min;用TBST溶解的5%脱脂牛奶稀释一抗,4℃过夜;室温下脱色摇床上洗3次,每次5 min;将辣根过氧化物酶标记的山羊抗兔抗体,用TBST稀释3000倍,室温下孵育30 min;用TBST在室温下脱色摇床上洗3次,每次5 min,最后进行显影和定影,Alpha软件处理系统分析目标带的吸光度值。以β-actin为内参,计算 P-JAK2/β-actin、P-STAT5/ β-actin吸光度比值,反映P-JAK2和P-STAT5相对含量变化。
1.7 统计学方法
采用SPSS 19.0统计软件进行统计分析,以均数±标准差(±s)表示,组间比较采用单因素方差分析和q检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同时间脑皮质病理形态
HE染色后光镜下观察发现,正常组和假手术组大鼠脑皮质形态正常,染色均匀,组织结构清晰致密,细胞质淡红色,胞核蓝染,轮廓清楚;假手术组仅见极少量炎性细胞。造模后大鼠局部脑皮质可见神经细胞减少,胞浆疏松,胞体缩小、变形,染色变浅;间质水肿,炎性细胞增多,微血管内皮水肿明显甚至脱落,管腔变形;微血管周围间隙增宽,周围结构不清。头针治疗后,其组织结构紊乱及间质水肿明显减轻。
2.2 大鼠脑皮质IL-6含量比较
表1显示,假手术组IL-6含量与正常对照组比较差异无统计学意义(P>0.05);造模后IL-6明显增多,除IR 24 h外,头针组IL-6含量均少于模型组(P<0.05),特别是在IR 48 h时差异最明显(P<0.01)。
表1 各组大鼠脑皮质IL-6含量比较(±s,pg/mg)

表1 各组大鼠脑皮质IL-6含量比较(±s,pg/mg)
注:与同时间正常对照组比较:△△P<0.01;与同时间模型组比较:#P<0.05,##P<0.01
12 h 24 h 48 h 72 h正常对照组组别 例数10 2.87±0.63 2.87±0.63 2.87±0.63 2.87±0.63假 手 术 组 10 2.92±1.01 2.92±1.01 2.92±1.01 2.92±1.01模 型 组 40 8.92±0.39△△ 10.57±0.68△△ 12.39±0.54△△ 11.83±0.83△△头 针 组 40 7.59±0.92△△# 10.21±0.71△△ 10.77±1.14△△## 10.01±0.76△△#
2.3 大鼠脑皮质P-JAK2蛋白含量比较
表2和图1显示,假手术组P-JAK2蛋白含量与正常对照组比较差异无统计学意义(P>0.05);IR 12 h和IR 72 h头针组P-JAK2蛋白含量较模型组多(P<0.05),而IR 24 h和48 h电针组P-JAK2蛋白含量与同时间模型组比较,2组间比较差异无统计学意义(P>0.05)。
表2 各组大鼠脑皮质P-JAK2蛋白含量比较(±s)
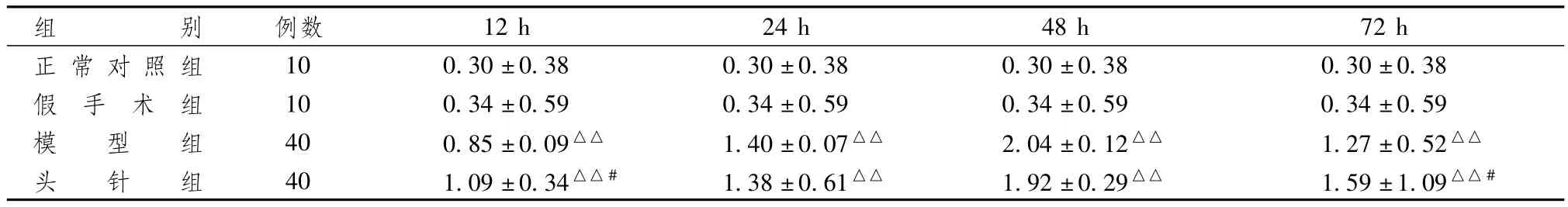
表2 各组大鼠脑皮质P-JAK2蛋白含量比较(±s)
注:与同时间正常对照组比较:△△P<0.01;与同时间模型组比较:#P<0.05
组别 例数12 h 24 h 48 h 72 h正常对照组10 0.30±0.38 0.30±0.38 0.30±0.38 0.30±0.38假 手 术 组 10 0.34±0.59 0.34±0.59 0.34±0.59 0.34±0.59模 型 组 40 0.85±0.09△△ 1.40±0.07△△ 2.04±0.12△△ 1.27±0.52△△头 针 组 40 1.09±0.34△△# 1.38±0.61△△ 1.92±0.29△△ 1.59±1.09△△#

图1 各组大鼠脑皮质P-JAK2蛋白电泳检测结果
2.4 大鼠脑皮质P-STAT5蛋白含量比较
假手术组P-STAT5蛋白含量与正常对照组比较差异无统计学意义(P>0.05);不同缺血再灌注时间电针组比模型组P-STAT5蛋白含量表达均多,差异有统计学意义(P<0.05,P<0.01)。
表3 各组大鼠脑皮质P-STAT5蛋白含量比较(±s)

表3 各组大鼠脑皮质P-STAT5蛋白含量比较(±s)
注:与同时间正常对照组比较:△△P<0.01;与同时间模型组比较:#P<0.05,##P<0.01
组别 例数12 h 24 h 48 h 72 h正 常对照 组10 0.10±0.38 0.10±0.38 0.10±0.38 0.10±0.38假 手 术 组 10 0.09±0.59 0.09±0.59 0.09±0.59 0.09±0.59模 型 组 40 0.29±2.21△△ 0.57±1.57△△ 0.86±0.92△△ 0.70±3.43△△头 针 组 40 0.69±1.54△△# 1.12±1.16△△## 1.47±2.59△△## 1.25±1.05△△##

图2 各组大鼠脑皮质P-STAT5蛋白电泳检测结果
3 讨论
头针是一种临床治疗脑血管病常见、简便、有效的中医外治方法,起源于《黄帝内经》。《灵枢·五乱》明确记载:“乱于头,则为厥逆,头重眩仆……气在于头者,取之天柱大杼。”头为诸阳之会,气血聚集之要,“病变在脑、首选督脉”为历代医家的共识[5-6]。本实验选用的头针刺“顶颞前斜线、顶颞后斜线”主要治疗中枢性肢体瘫和肢体感觉障碍,为改善中风后神经行为学障碍的首选[7],在改善脑电活动、缩小梗死体积、抑制神经元凋亡等方面疗效独特[8-9]。
中风导致神经元坏死并产生局部脑组织的炎症反应,IL-6作为一种多功能单链糖蛋白细胞因子,其表达水平的高低是反映缺血再灌注炎症损伤的重要指标[10-11]。在本实验中随着缺血再灌注时间的延长,IL-6的含量相应增加,与以往结论相似。但细胞因子的这一炎症效应可以向有益的方向转变,取决于其在脑组织中的浓度、缺血再灌注时间和非常复杂的细胞内信号网络的激活[12]。通过病理形态学观察发现,IR 12 h和IR 24 h脑皮质损伤的速度虽快,但基本形态还算完整,但到后期随着IL-6含量的不断增加,局部神经元变形坏死、微血管内皮脱落、胞质疏松、水肿明显,头针干预后能明显降低皮质中IL-6的表达速度,以减轻炎症反应的程度。另一方面,缺血后JAK2在局部组织的异常激活和过度表达会增加炎症反应[12]。本研究也发现,造模后随着时间的延长,脑皮质中P-JAK2含量不断上升,特别是在IR 48 h表达最多,此时IL-6的含量也最高,组织结构损伤最严重;对MCAO大鼠给予头针治疗后,虽然在IR 72 h P-JAK2蛋白含量较同时间模型组的含量多,但高浓度的P-JAK2并没有引起进一步脑损伤,反而受损的神经元和微血管开始修复。这可能与头针的作用有关,说明头针干预IL-6的分泌可能是通过调控P-JAK2表达来实现的,因为JAK2能激活IL-2、IL-6、EPO、INF-γ等相关炎症因子受体[14]。
早在2006年,有学者[15]就检测到JAK蛋白在SD大鼠脑内有广泛表达,并与STAT协同作用来影响脑缺血后神经元的凋亡;JAK2的磷酸化可激活下游分子 STAT5,提高缺血区神经元耐缺氧能力[16-17]。通过对P-STAT5蛋白印迹检测发现,急性脑缺血后局部脑皮质P-STAT5蛋白含量在IR 12 h就开始增加,48 h表达到峰值,且 P-JAK2与 PSTAT5的表达水平保持一致。虽然IR 24 h和IR 48 h头针组P-JAK2减少,但在IR12 h和72 h头针对P-JAK2蛋白表达又有促进作用;且头针组P-STAT5蛋白含量一直多于模型组,进一步说明头针对MCAO大鼠局部脑皮质中的JAK2/STAT5信号通路的激活有促进作用。
综上所述,头针能有效激活急性脑缺血再灌注后局部脑皮质中JAK2/STAT5分子信号通路,促进该通路中JAK2、STAT5蛋白分子的磷酸化。在缺血再灌注早期,头针可能通过降低P-JAK2含量以调控IL-6的表达来减轻局部皮质的炎症反应;在缺血再灌注中后期,可能通过增加P-JAK2蛋白含量促进其下游P-STAT5蛋白表达,以改善受损脑皮质的病理形态。但急性脑缺血后血流再灌注引起的炎症反应涉及多个分子信号传导通路,因此头针治疗的作用机制仍需进一步的研究和探讨。
[1]Clifford Liongue,Ward Alister C.Evolution of the JAK-STAT pathway[J].JAK-STAT,2013,2(1):e22756.
[2]杨磊,韩曜平,顾志良.Stat5及JAK-Stat5通路[J].生命科学,2012,24(7):680-685.
[3]谢惠芳,徐如祥,魏继鹏,等.大鼠脑缺血再灌注损伤后磷酸化JAK2、STAT3蛋白表达及细胞凋亡[J].南方医科大学报,2007,27(7):208-218.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5]吴晓毅.试述督脉与脑的关系[J].光明中医,2010,25(6): 944-945.
[6]朱永磊,黄川,邢甲进.“从督论治”针刺法治疗脑卒中后认知功能障碍40例[J].安徽中医药大学学报,2014,33(2): 50-52.
[7]项小林,杨婷婷.双侧头皮透刺电针疗法结合穴位注射治疗中风后遗症疗效观察[J].中国全科医学,2011,14(23): 2701-2703.
[8]张红星,王琼,周利,等.头针抗大鼠急性脑缺血再灌注炎症损伤的作用机制[J].中西医结合学报,2009,7(8):769-774.
[9]任素莲,王东吉,武凡,等.头针疗法对脑缺血-再灌注损伤大鼠胞浆型磷脂酶A-2的影响[J].光明中医,2012,27(2): 314-316.
[10]Gaire BP,Kwon OW,Park SH,et al.Neuroprotective Effect of 6-Paradol in Focal Cerebral Ischemia Involves the Attenuation of Neuro inflammatory Responses in Activated Microglia[J].PLoS ONE,2015,10(3):e0120203.
[11]李沙,黄艳秋,游红琴,等.脑缺血再灌注损伤模型大鼠炎性反应相关信号研究[J].中国神经免疫学和神经病学杂志,2012,19(6):453-461
[12]Jang S,Jung JC,Kim DH,et al.The neuroprotective effects of benzyliden-eacetophenone derivativeson excitotoxicity and inflam-mation via phosphorylated Janus tyrosine kinase 2/phosphory-lated signal transducer and activator of transcription 3 and mitogen-activated protein K pathways[J].J Pharmacol Exp Ther,2009,328(2):435-447
[13]韩德雄,张莺,林咸明,等.JAK/STAT通路与脑缺血再灌注损伤细胞凋亡及电针干预作用[J].中华中医药杂志,2013,28 (6):1839-1841.
[14]S.J.LI,W.LIU,J.L.WANG,et al.The role of TNF-α,IL-6,IL-10,and GDNF in neuronal apoptosis in neonatal rat with hypoxic ischemic encephalopathy[J].European Review for Medical and Pharmacological Sciences,2014,18:905-909.
[15]Satriotomo I,Bowen KK,Vemuganti R.JAK2andSTATS activation contributes to neuronal damage following transient focal cerebral ischemia[J].Neurochem,2006,98:1353-1368.
[16]Kosan C,Ginter T,Heinzel T,et al.STAT5 acetylation: Mechanisms and consequences for immunological control and leukemogenesis[J].JAK-STAT,2013,2(4):26102-26113.
[17]于涛,许能贵,符文彬,等.电针对局灶性脑缺血模型大鼠脑内STAT5阳性神经元的影响[J].中国中医基础医学杂志,2011,17(4):425-426.
欢迎订阅《中医杂志》
《中医杂志》(ISSN 1001-1668,CN 11-2166/R)是由中华中医药学会和中国中医科学院主办的全国性中医药综合性学术期刊。1955年创刊以来始终坚持“以提高为主,兼顾普及”的办刊方针,是我国中医药界创刊早、发行量大、具有较高权威性和学术影响力的国家级中医药期刊之一,是中国中文核心期刊和科技核心期刊、中国精品科技期刊、首届国家期刊奖获得者和中国期刊方阵双奖期刊、新中国60年有影响力的期刊、中国百强科技期刊、中国百种杰出学术期刊,荣获第二届、第三届新闻出版政府奖期刊奖提名奖。
《中医杂志》主要栏目中当代名医和临证心得分别介绍名老中医和临床医生辨证用药治疗疑难病的经验;临床研究介绍中医药治疗的新方法、新成果;学术探讨、思路与方法、专家论坛、病例讨论、综述、百家园等栏目,提供最新学术观点、研究成果与治疗方法,成为学习中医药、研究中医药,不断提高临床及研究水平的良师益友。
《中医杂志》为半月刊,每月2日和17日出版,每期定价15.00元,全年360元。读者可以到全国各地邮局办理订阅手续(邮发代号:2-698),也可以与本刊读者服务部联系邮购,邮购免邮费。电话:010-64035632,010-64089195。国外发行:中国国际图书贸易总公司(北京399信箱,邮编:100044,代号:M140)。
本社地址:北京市东城区东直门内南小街16号,邮政编码:100700。网址:http://zzyz.chinajournal.net.cn。
R245.32+1
:B
:1006-3250(2016)08-1084-04
2016-01-04
海南省自然科学基金资助项目(20158371)-不同时间头针对MCAO大鼠缺血局部脑皮质微血管新生的影响研究
梁 超(1984-),女,湖北武汉人,主治医师,医学博士,从事针灸治疗神经系统疾病的临床与实验研究。
△通讯作者:姜 涛(1982-),男,辽宁沈阳人,主治医师,医学学士,从事针灸治疗神经系统疾病的临床与研究,Tel: 15348880418,E-mail:17664226@qq.com。

