青钱柳多糖对H4IIE肝细胞胰岛素信号传递的影响*
许光远,孙 文,郭 璇,候 丹,吴丽丽,张 岩,张 茁,张 露,秦灵灵,李 博,李伟笠,刘铜华
(1. 北京中医药大学附属东方医院 北京 100078;2. 北京中医药大学中医养生学研究所 北京 100029;
3. 陕西中医药大学第一临床医学院 咸阳 712046;4.北京中医药大学科技处 北京 100029;
5. 北京中医药大学中药学院 北京 100029;712046;6. 北京中医药大学东直门医院 北京 100700;7. 北京中医药大学研究生院 北京 100078)
青钱柳多糖对H4IIE肝细胞胰岛素信号传递的影响*
许光远1,孙 文2,郭 璇1,候 丹3,吴丽丽2,张 岩1,张 茁3,张 露1,秦灵灵4,李 博5,李伟笠6,刘铜华7**
(1. 北京中医药大学附属东方医院 北京 100078;2. 北京中医药大学中医养生学研究所 北京 100029;
3. 陕西中医药大学第一临床医学院 咸阳 712046;4.北京中医药大学科技处 北京 100029;
5. 北京中医药大学中药学院 北京 100029;712046;6. 北京中医药大学东直门医院 北京 100700;7. 北京中医药大学研究生院 北京 100078)
目的:观察青钱柳多糖对肝细胞胰岛素信号传导通路关键靶点基因、蛋白表达的影响。方法:以H4IIE大鼠肝细胞为模型,培养72 h后,采用Neutral Red法检测青钱柳多糖(50、100、200、400 μg·mL-1)对细胞活性的影响;根据细胞活性检测结果分为正常对照组(Control组)、胰岛素组(Insulin组)、青钱柳多糖低剂量组(LCP组)和高剂量组(HCP组);药物干预2 h后RT-PCR检测肝细胞相应基因表达,药物干预30 min后,利用Western blot法检测肝细胞相应蛋白磷酸化水平。结果:与Control组比较,100、200、400 μg·mL-1青钱柳多糖干预后肝细胞活性显著升高(P<0.01);干预2 h后,LCP组InsR、IRS-2基因表达显著升高(P<0.05),Insulin组和HCP组InsR、IRS-2基因表达极显著升高(P<0.01);干预30 min后,Insulin组、HCP组InsR β、IRS-2、Akt蛋白磷酸化水平显著升高(P<0.01)。结论:青钱柳多糖具有增加肝细胞活性作用,其上调肝细胞胰岛素信号通路关键靶点InsR、IRS-2基因表达,以及InsR β、IRS-2、Akt蛋白磷酸化水平可能是其发挥降糖作用的机制。
青钱柳多糖 H4IIE肝细胞 胰岛素信号传导通路
随着生活方式的改善,2型糖尿病已成为目前严重危害人类健康的慢性疾病之一。据统计,2011年中国糖尿病人数增长速率达到9.7%,居世界首位,远高于世界平均增长水平6.4%[1]。最新研究数据显示,中国糖尿病患者中95%以上为2型糖尿病[2],因此,中国在2型糖尿病防治中面临巨大压力。
青钱柳Cyclocarya paliurus(Batal)Ijinskaja系胡桃科青钱柳属落叶乔木,是中国特有树种,其叶具有生津止渴、清热解毒的功效,被称为“甜茶”,民间多用于防治糖尿病[3]。现代药理研究表明,青钱柳含有降糖、降压、降脂等多种活性物质[4],其中多糖类在降糖方面功效尤为突出[5],但作用机制尚不明确。本实验以H4IIE大鼠肝细胞为模型,观察青钱柳多糖对其胰岛素信号传导通路关键靶点基因、蛋白的影响,以探讨青钱柳多糖的降糖机制。
1 材料
1.1 细胞
大鼠肝癌细胞(H4IIE细胞),由日本武库川女子大学东洋医药研究室赠予。常规复苏细胞,养于含10%FBS、1%青-链霉素的DMEM(1g·L-1葡萄糖)培养基,放入37℃ 5% CO2培养箱中培养。
1.2 仪器
酶标仪GLOMA MULTI DETECTION SYSTEM(美国Promega公司);PCR扩增仪(ABI Prism 7500);光学显微镜(日本OLYMPUS公司,BX53型);垂直电泳仪、转移槽(美国BIO-RAD公司);凝胶成像系统(美国BIO-RAD公司,ChemiDocTMXRS+with Image LabTMSoftware)细胞培养箱(美国Thermo公司,HERA CELL 150i CO2incubator)。
1.3 试药与药材
青钱柳叶采自江西修水地区,青钱柳多糖(协和药物研究所提供,含量约为8.11%,总糖部位多糖含量为75.34%);FBS胎牛血清(美国gibco公司,批号:1744349);DMEM培养基(日本京都Nacalai Tesque公司,批号:L4R2552);诺和灵R生物合成人胰岛素注射液(德国诺和诺德公司,批号:批号:国药准字J20100117);p-InsRβ、t-InsRβ、p-IRS-2、t-IRS-2、p-Akt、t-Akt、β-actin抗体(美国Cell Signaling Technology公司,批号:0011、0008、0005、0003、0014、0020、0013);Block one(日本京都Nacalai Tesque公司,批号:L4E0085);Block one-P(日本Nacalai Tesque公司,批号:L5G4440);THUNDERBIRD SYBR qPCR Mix(日本TOYOBO公司);RNA引物由上海生工生物工程股份有限公司合成。
2 方法
2.1 药物提取
干燥的青钱柳叶粉碎成粗粉,用8倍量85%乙醇加热回流提取3次,每次2 h,合并提取液,减压浓缩得醇提浸膏。将醇提浸膏混悬分散于40 L水中,用石油醚以1:1的体积比萃取3次,进行脱脂处理。脱脂处理后,水部分减压浓缩后进行冷冻干燥得到该部位的干燥粉末。
2.2 H4IIE细胞活性检测
采用Neutral Red法检测H4IIE细胞活性。H4IIE细胞培养72 h后(培养基:DMEM+10%FBS+ 1%青-链霉素),待细胞长至70%-80%,消化,稀释为5×104cells·mL-1的细胞悬液,每孔1 mL加入12孔板,按加入不同浓度(50、100、200、400 μg·mL-1)的青钱柳多糖,37℃ 5% CO2培养箱中培养24 h,PBS洗1次,加入50 μg·mL-1中性红溶液培养3 h,PBS洗1次,加入中性红溶解剂,540 nm测定OD,计算存活率:存活率=给药组OD/对照组OD×100%。
2.3 细胞分组与给药
H4IIE细胞以5×104cell·mL-1浓度接种于12孔板,37℃ 5% CO2培养箱中培养72 h,分为4组,每组3个样本,分组如下:正常对照组(Control组):含5%FBS的DMEM;胰岛素组(Insulin组):100 nmol·L-1胰岛素+含5%FBS的DMEM;青钱柳多糖低剂量组(LCP组):200 μg·mL-1CP+含5%FBS的DMEM;青钱柳多糖高剂量组(HCP组)=400 μg·mL-1CP+含5%FBS的DMEM,按实验需要进行培养。
2.4 H4IIE细胞RT-PCR检测
给药干预2 h后H4IIE细胞,PBS洗1次,按照RNA提取试剂盒提取RNA;其次,反转录,GoScript™Reverse Transcription System试剂盒进行反转录,退火25℃ 5 min,延伸42℃ 1 h,灭活70℃ 15 min,得到cDNA。20 μL反应体系,2 μL cDNA稀释液加入10 μLGoTaq反应液、7.2 μL Nuclease-Free Water和0.8 μL引物混合物,置于Applied Biosystems 7 500 Real Time PCR System进行反应,反应条件:95℃ 10 min;95℃ 15 s,60℃1 min(共 40 次循环);95℃15 s,60℃15 s溶解。引物如下:GAPDH上游引物5’- TGAAGCAGGCATCTGAGGG-3’,下游引物5’-CGAAGGTGGAAGAGTGGGAG-3’;InsR上游引物5’- TTTGTCATGGATGGAGGCTA -3’,下游引物5’- CCTCATCTTGGGGTTGAACT -3’;IRS-2上游引物5’- TCCTATCCCGAAGAGGGTCT -3’,下游引物5’- TGGGCATATAGCCATCATCA -3’。
2.5 H4IIE细胞Western blot检测
按分组给药处理30 min后,以Homoginized Buffer提取总蛋白,加2倍量的上样缓冲液,100℃5 min 蛋白变性,上样量每孔20 μg,100 V 2 h电泳,预处理PVDF膜及滤纸,半干法凝胶转膜,100 A 1 h,膜在TBS溶液中室温下摇床洗15 min;Blocking one/ Blocking one-P封闭30 min,分别以p-InsRβ、t-InsRβ、p-IRS-2、t-IRS-2、p-Akt、t-Akt、β-actin等抗体(1:1 000稀释)孵育,4℃过夜,洗膜后二抗(1:10 000)孵育,室温1 h。洗膜后加ECL发光液,室温反应1 min,凝胶成像系统成像,蛋白条带用Image J 7.0图像分析。
2.6 统计学方法
采用SPSS 19.0软件处理数据,数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-Way ANOVA)方法;两组间比较,满足方差齐性时用 LSD-t 检验,不满足方差齐性时用非参数检验;P< 0.05 表示有显著性差异,P<0.01 表示有极显著性差异。
3 结果
3.1 不同浓度青钱柳多糖对H4IIE细胞活性的影响
H4IIE肝细胞长至80%-90%,给予不同浓度的青钱柳多糖干预24 h,观察细胞活性。结果显示,实验所选用浓度中,青钱柳多糖无细胞毒作用,并表现出随浓度升高活性增强的趋势(P<0.01)。因此,选择作用于H4IIE 细胞活性最强的两个浓度(200、400 μg·mL-1),进行下一步实验(表1)。
3.2 青钱柳多糖对H4IIE细胞 InsR、IRS-2 mRNA表达的影响
80%-90%H4IIE肝细胞按照分组给药干预2 h,RT-PCR检测青钱柳多糖对H4IIE肝细胞InsR、IRS-2 mRNA表达的影响。与Control组相比,Insulin组InsR、IRS-2 mRNA表达显著上调(P<0.01),而LCP、HCP组也均显著上调InsR、IRS-2 mRNA的表达(P<0.05,P<0.01),并呈现剂量依赖性升,提示青钱柳多糖能够上调胰岛素信号传导通路关键靶点基因表达(表2)。
3.3 青钱柳多糖对H4IIE细胞InsRβ、IRS-2、Akt蛋白磷酸化的影响
胰岛素信号传导通路是调节糖代谢的重要途径,其中InsRβ、IRS-2、Akt是该通路中关键靶点蛋白,其磷酸化是该通路发挥作用的重要标志。H4IIE肝细胞按照分组给药干预30 min后,检测青钱柳多糖对p-InsRβ、t-InsRβ、p-IRS-2、t-IRS-2、p-Akt、t-Akt 蛋白表达的影响。与Control组相比,insulin组InsRβ、IRS-2、Akt蛋白磷酸化水平显著升高(P< 0.05);LCP、HCP组也显著上调InsRβ、IRS-2、Akt蛋白磷酸化水平(P<0.05,P<0.01),提示青钱柳多糖能够提高胰岛素信号传导通路靶点蛋白磷酸化水平(表3、图1)。
4 讨论
青钱柳多糖是青钱柳叶水提物中的一类重要生物活性物质,其中含有多种成分,主要包括鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖以及半乳糖[6],此外还含有Ca、Al、Mg、K、Fe、Mn、P、Zn、Na、Se、Cr、Pb、Cu等多种微量元素[7]。研究发现,青钱柳多糖具有明确降糖作用[8],能显著增加IR-HepG2细胞的糖耗量,改善IR[9];增加糖尿病小鼠肝糖原合成,抑制糖异生[10]。Kurihara H等[11]通过水煎、冷冻减压得到青钱柳水提物,以表儿茶素(Epicatechin)作对照,发现其可能通过抑制α-葡萄糖苷酶活性发挥降糖作用。还有研究发现,青钱柳多糖对四氧嘧啶建立的糖尿病小鼠模型胰岛细胞具有保护作用[12]。因此,青钱柳多糖具有多途径降糖作用,但其具体分子作用机制尚不明确。
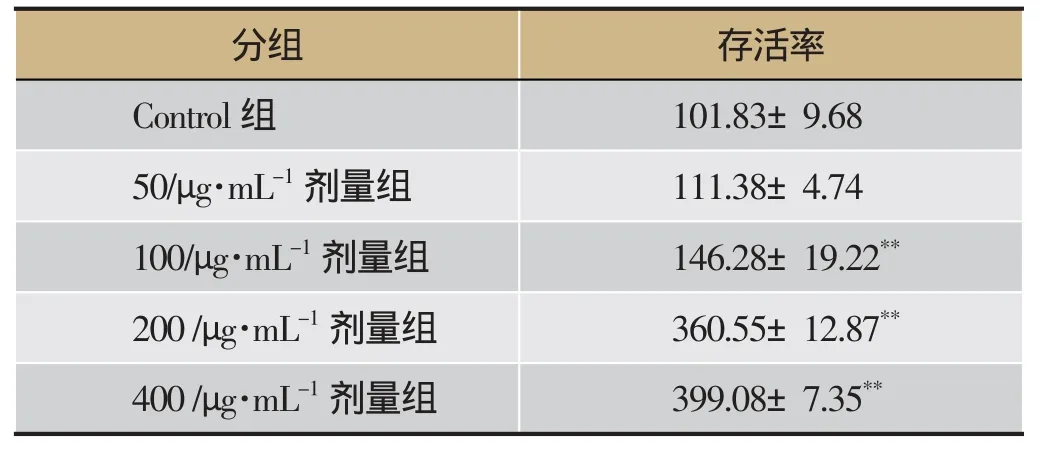
表1 青钱柳多糖对H4IIE细胞活性的影响(·x ± s,n=5)

表2 青钱柳多糖对H4IIE细胞InsR、IRS-2mRNA表达的影响(·x ± s,n=3)
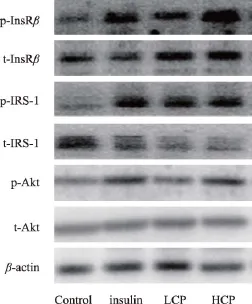
图1 青钱柳多糖对H4IIE细胞InsRβ、IRS-2、Akt蛋白磷酸化的影响

表3 青钱柳多糖对H4IIE细胞InsRβ、IRS-2、Akt蛋白磷酸化的影响(·x ± s,n=3)
胰岛素信号传导通路是胰岛素在调节糖代谢中发挥作用的重要途径,其信号传递减弱或障碍导致胰岛素抵抗(Insulin Resistance,IR)发生,血糖升高。肝脏是胰岛素作用的主要靶器官之一,肝细胞中胰岛素信号传导的异常对糖代谢产生重要影响。胰岛素受体(Insulin Receptor,InsR)包括α和β两个亚基,胰岛素与α亚单位结合后使β亚基构象改变而发生酪氨酸残基磷酸化,激活InsR[13]。研究发现,抑制InsR的磷酸化,导致IR发生[14]。IRS是胰岛素受体底物家族,包括IRS-1、IRS-2、 IRS-3、IRS-4等众多亚型,其中IRS-2主要在肝脏表达[15]。IRS-2接受激活的InsR刺激后酪氨酸残基发生磷酸化[16],从而活化下游分子PI3K、Akt,调节细胞对葡萄糖的摄取以及糖原合成。在胰岛素信号传导通路中InsR、IRS-2、Akt等分子的磷酸化是其活化发挥作用的主要标志,因此,其活化程度反映了胰岛素信号的传递情况。本研究发现,在青钱柳多糖干预H4IIE细胞24 h后,InsR、IRS-2基因表达较对照组明显上调;而在青钱柳多糖干预H4IIE细胞30 min后检测InsRβ、IRS-2、Akt磷酸化水平发现青钱柳多糖高、低剂量组InsRβ、IRS-2、Akt磷酸化水平较对照组明显上调;这提示青钱柳多糖能够上调胰岛素信号通路上关键靶点的基因表达及磷酸化水平,可能是其发挥降糖作用的机制。
综上所述,青钱柳是民间常用降糖药物,其多糖成分在既往动物实验中具有明确的降糖效果,本实验发现其能够上调体外培养大鼠肝细胞胰岛素信号传导通路上InsR、IRS-2基因表达和InsRβ、IRS-2、Akt蛋白磷酸化水平,可能是青钱柳多糖的降糖作用机制,为进一步动物实验提供依据。
1 Whiting D R, Guariguata L, Weil C, et al. IDF diabetes atlas:global estimates of the prevalence of diabetes for 2011 and 2030. Diabetes Res Clin Pract, 2011, 94(3): 311-321.
2 Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults. JAMA, 2013, 310(9): 948-959.
3 王晓红,孔登,李万忠. 青钱柳水提物对糖尿病肾病大鼠血脂、血凝和脂质过氧化的影响. 现代食品科技, 2016, 32(6): 1-7.
4 范冰舵,魏颖,李沧海,等. 青钱柳化学成分及降血糖活性研究概况. 中国实验方剂学杂志, 2014, 20(13): 239-242.
5 李楠,赵静,吴茹,等. 青钱柳多糖对高脂血症大鼠脂代谢及对PPARα、FAS、GLUT4基因mRNA表达的影响. 现代食品科技, 2015, 31(4): 29-35.
6 Xie J H, Liu X, Shen M Y, et al. Purification, physicochemical characterisation and anticancer activity of a polysaccharide from Cyclocarya paliurus leaves. Food Chem, 2013, 36 (3-4): 1453-1460.
7 Xie J H, Shen M Y, Nie S P, et al. Simultaneous analysis of 18 mineral elements in Cyclocarya paliurus polysaccharide by ICP-AES. Carbohydr Polym, 2013, 94(1): 216-220.
8 徐明生,沈勇根,吴海龙,等. 青钱柳水提物降血糖作用的研究.营养学报, 2004, 26(3): 230-231, 234.
9 潘慧敏,许利嘉,彭勇, 等. 青钱柳改善HepG2细胞胰岛素抵抗作用的研究. 世界临床药物, 2015, 36(7): 447-451.
10 李婷婷,吴彩娥,方升佐, 等. 青钱柳冲剂对糖尿病小鼠的降血糖功效. 食品科学, 2012, 33(15): 287-290.
11 Kurihara H, Fukami H, Kusumoto A, et al. Hypoglycemic action of cyclocarya paliurus (Batal.) iljinskaja in normal and diabetic mice. Biosci Biotechnol Biochem, 2003, 67(4): 877-880.
12 张小芳,段小群,卢曦,等. 青钱柳多糖对糖尿病小鼠血糖水平和胰腺组织形态的影响.华夏医学, 2010, 23(1): 15-17.
13 Onoue T, Goto M, Tominaga T, et al. Reactive oxygen species mediate insulin signal transduction in mouse hypothalamus. Neurosci Lett 2016, 619: 1-7.
14 Sun J, Fu X, Liu Y, et al. Hypoglycemic effect and mechanism of honokiol on type 2 diabetic mice. Drug Des Devel Ther, 2015, 9: 6327-6342.
15 Baquedano E, Burgos-Ramos E, Canelles S, et al. Increased oxidative stress and apoptosis in the hypothalamus of diabetic male mice in the insulin receptor substrate-2 knockout model. Dis Model Mech, 2016, 9(5): 573-583.
16 杜华,薛耀明,朱波.六味地黄丸改善OLETF鼠肝脏胰岛素抵抗的实验研究.南方医科大学学报, 2012, 32(12): 1824-7827.
Impacts of Cyclocarya Paliurus Polysaccharide on Insulin Signaling Pathway in H4IIE Liver Cells
Xu Guangyuan1, Sun Wen2, Guo Xuan1, Hou Dan3, Wu Lili2, Zhang Yan1, Zhang Zhuo3, Zhang Lu1, Qin Lingling4, Li Bo5, Li Weili6, Liu Tonghua7
(1. Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100029, China;
2. Health-Cultivation Laboratory of the Ministry of Education, Beijing University of Chinese Medicine, Beijing 100029,China;
3. College of Clinical Medical, Shaanxi University of Chinese Medicine, Xianyang 100029, China;
4. Department of Science and Technology, Beijing University of Chinese Medicine, Beijing 100028, China;
5. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China;
6. Dongzhimen Hospital, Beijing University of Chinese Medicine, Beijing 100700, China;
7. School of Graduates, Beijing University of Chinese Medicine, Beijing 100029, China)
This study aimed to explore the impacts of Cyclocarya paliurus polysaccharide (CP) on insulin signal pathway in liver cells. H4IIE liver cells of rat that cultivated for 72 h were made up for the model group. H4IIE cells at 70%-80% confluence were exposed to various concentrations of CP, including 50, 100, 200 and 400 μg·mL-1, for measuring cell viability using Neutral Red. Based on the results of cell viability, H4IIE cells were divided into the control group, the insulin group (100 nmol·L-1), the low dose CP group (the LCP group, 200 μg·mL-1) and the high dose CP group (the HCP group, 400 μg·mL-1). After the cultivation of cells for 2 h, mRNA levels were measured by real-time RT-PCR, while phosphorylation levels of target proteins were detected by western blot after the treatment for 30 min. It was found that the cell viability indexes in the cells administered by 100, 200 and 400 μg·mL-1CP increased significantly compared with the control group (P<0.01). After the administration for 2 h, InsR and IRS-2 mRNA expressions in the insulin group, the LCP group and the HCP group increased (P<0.05 or P<0.01). After the administration for 30 min, phosphorylation levels of InsRβ, IRS-2 and Akt in the insulin group were higher than those in the HCP group (P<0.01). In conclusion, CP probably increased the cell viability of H4IIE cells, and improved the blood glucose index through enhancing the mRNA expressions of InsR and IRS-2 and the phosphorylation levels of InsRβ, IRS-2 and Akt in the liver.
Kyclocarya paliurus polysaccharide, H4IIE liver cell, insulin signaling pathway
(责任编辑:马雅静,责任译审:朱黎婷)
10.11842/wst.2016.07.0010
R587.1
A
2016-07-01
修回日期:2016-07-13
* 北京市教育委员会科学研究与研究生培养共建项目-科研项目:中药干预胰岛素抵抗技术平台建设与方药筛选研究,负责人:刘铜华。
** 通讯作者:刘铜华,本刊编委,教授,博士生导师,主要研究方向:中医药防治糖尿病及其并发症的临床和基础研究。
——访北京中医药大学东直门医院大内科副主任、中医内科教研室主任赵进喜教授

