糖耐康改善ZDF大鼠胰岛β细胞凋亡的作用机制研究*
吴莉娟,孙 文,刘铜华,吴丽丽,秦灵灵
(1.成都中医药大学临床医学院 成都 610075;2.北京中医药大学中医养生学重点实验室 北京 100029;3.北京中医药大学研究生院 北京 100029;4. 北京中医药大学科技处 北京 100029)
糖耐康改善ZDF大鼠胰岛β细胞凋亡的作用机制研究*
吴莉娟1,孙 文2,刘铜华3**,吴丽丽2,秦灵灵4
(1.成都中医药大学临床医学院 成都 610075;2.北京中医药大学中医养生学重点实验室 北京 100029;3.北京中医药大学研究生院 北京 100029;4. 北京中医药大学科技处 北京 100029)
目的:探讨糖耐康干预2型糖尿病大鼠(ZDF)胰岛β细胞凋亡的作用及机制。方法:6只雄性ZDF(fa/+)大鼠设为正常对照组,雄性ZDF(fa/fa)大鼠30只设为2型糖尿病成模组。根据体质量及随机血糖将成模组大鼠随机分为5组,即模型组、二甲双胍组、糖耐康高、中、低剂量组。给药前测大鼠空腹血糖值及血清胰岛素值;给药6周再次检测大鼠空腹血糖值及血清胰岛素值并进行比较。采用HE染色观察胰岛形态结构的改变;采用TUNEL法检测各组大鼠胰腺组织中胰岛β细胞凋亡情况;免疫组织法观察细胞死亡信号转导效应酶Caspase-3在胰岛中表达情况。结果:给药6周后,糖耐康高、中、低剂量组均可显著改善ZDF大鼠空腹血糖(P<0.01);糖耐康高、中、低剂量组血清胰岛素值较模型组均有所升高,其中,高、低剂量组有显著性差异(P<0.05);给药组胰岛素抵抗指数较模型组均有所下降,其中,糖耐康高剂量组及二甲双胍组有极显著性差异(P<0.01)。HE染色显示给药组的胰岛细胞形态、结构较模型组有所改善。TUNEL结果显示ZDF(fa/fa)大鼠胰腺组织内均可见胰岛细胞凋亡改变,与模型比,给药组TUNEL阳性表达率均显著性减少(P<0.05)。免疫组化结果显示给药组Caspase-3蛋白表达下降(P<0.05)。结论:糖耐康能有效降低ZDF大鼠胰岛β细胞的凋亡,即对胰岛β细胞有一定的保护作用。
糖耐康 胰岛β细胞 ZDF大鼠 苏木精-伊红染色法 原位末端转移酶标记技术 半胱氨酸天冬氨酸蛋白酶-3
糖尿病作为威胁人类生命的重要疾病之一,其发病率逐年上升。2型糖尿病(Type 2 Diabetes,T2DM)的发生,占整个糖尿病的90%以上,其发病机制主要是胰岛素分泌功能受损和胰岛素抵抗。胰岛素抵抗是胰岛素作用的靶器官对胰岛素作用的敏感性减低。而胰岛素分泌功能受损主要表现在胰岛β细胞的分泌功能下降及其凋亡所造成的β细胞数量的减少[1]。研究证实在T2DM发病过程中,胰岛β细胞数量呈进行性减少[2]。动物实验和人类尸检研究显示,T2DM发病过程中胰岛β细胞的数量减少可达到60%-80%,而正常人切除50%胰腺,其胰岛素分泌功能就会出现异常[3,4]。另一研究发现T2DM患者因胰岛素抵抗,会发生脂质长期过载于细胞内而引起氧化应激导致胰岛β细胞的功能衰退[5]。在发病初期,胰岛素抵抗及β细胞分泌功能上的改变极为重要,而凋亡所致的β细胞数量减少却在整个T2DM发病过程中起着关键作用。因此,保护胰岛β细胞、预防并延缓β细胞凋亡及进程、阻止其功能衰退成为治疗T2DM整个发病过程的关键[6]。
刘铜华教授在治疗糖尿病过程中,根据中医理论结合多年临床经验及现代药理研究成果研制出中药复方——糖耐康,既往动物和临床试验均表明其能有效调节血糖、血脂,改善胰岛素抵抗[7,8]。本研究旨在观察糖耐康对自发性2型糖尿病大鼠模型——ZDF大鼠胰岛β细胞是否存在保护作用,以进一步探讨其作用机制。
1 材料及方法
1.1 材料
1.1.1 实验动物
雄性ZDF(fa/fa)大鼠35只及ZDF(fa/+)大鼠6只(购自北京维通利华实验技术有限公司,许可证号:SCXK京2012-0001),6-7周龄,体质量200±20 g。大鼠在SPF级条件下饲养,由中国中医科学院中医基础理论研究所实验动物中心饲养(实验动物使用许可证:SYXK京2010-0032),标准屏障系统。饲养条件:温度21±2℃、湿度60±10%,12 h/ 12 h光照黑暗循环,自由摄食饮水。
1.1.2 仪器及试剂
BX53F型光学显微镜及其成像系统(日本奥林巴斯公司)、ZDP-A2080A恒温箱(上海智城公司)、高速低温离心机(美国Sigma公司,型号/货号/批号: 3K15/10797/9001678)、小型染色缸、湿盒、吸管、各种规格的加样器及枪头等。TUNEL试剂盒(美国Roche公司,批号:11684817910)、Caspase-3兔抗大鼠抗体(活化半胱氨酸蛋白酶蛋白-3抗体,北京博奥森公司,批号:bs-0081R)、山羊血清及羊抗兔二抗(北京博奥森公司,批号:SP-0023)、胰岛素放免试剂盒(北京中生北控科技股份有限公司,批号:HY-10069)、葡萄糖测试盒(北京中生北控科技股份有限公司,批号:SHPTT60110)、糖耐康(3g/袋,北京中医药大学药厂制备,组方由人参、女贞子、夏枯草、三白草、番石榴叶组成。每克颗粒相当于3.61 g生药。实验前用蒸馏水配制后超声半小时,4℃保存)、盐酸二甲双胍片(0.5g/片,中美上海施贵宝,批号:国药准字H20023370)、DAB工作液(北京博奥森公司,批号:AE111701/ C-0010)、Proteinase K工作液(德国默克公司,批号:1245680100)、苏木素(北京索莱宝公司,批号:G1140)、伊红(北京索莱宝公司,批号:G1100)、PBS、双蒸水、二甲苯、梯度乙醇(100%、95%、90%、80%、70%)等。
1.2 方法
1.2.1 动物造模及分组
将大鼠适应性喂养1周后,雄性ZDF(fa/+)大鼠作为正常组,给予普通饲料喂养;雄性ZDF(fa/fa)大鼠给予上海介宏贸易有限公司生产的PMI Labdiet 5008饲料诱导4周,选不同日两次随机血糖水平均值≥11.1 mmol·L-1者,为成模大鼠,共30只。按体质量及随机血糖分层随机分为5组:二甲双胍组(6只,二甲双胍片0.18 g·kg-1),糖耐康低剂量组(6只,糖耐康0.81 g·kg-1),糖耐康中剂量组(6只,糖耐康1.62 g·kg-1),糖耐康高剂量组(6只,糖耐康3.24 g·kg-1)。给药组均按每天0.01 mL·g-1的体质量标准灌胃给药1次,正常组和模型组则给予相同剂量的生理盐水灌胃,连续6周。各组大鼠均自由取食、饮水。
1.2.2 血糖及胰岛素监测
给药前,禁食不禁水10 h后,目内眦取血测空腹血糖(Fasting Plasma Glucose,FPG)及血清胰岛素值(Serum Insulin,INS)。
1.2.3 胰岛素抵抗指数(HOMA-IR)
给药前及给药后,禁食不禁水10小时,大鼠目内眦取血,所测得FPG及空腹血清胰岛素(Fasting Serum Insulin,FINS)。胰岛素抵抗指数=空腹血糖值(FPG)×空腹胰岛素值(FINS)/22.5。
1.2.4 取材
第6周,末次给药后禁食不禁水10 h,予1%戊巴比妥钠(0.04 mL·kg-1)麻醉成功后,腹主动脉取血,静置3 h后3 500 r·min-1分离血清,-80℃保存,测FPG。分离胰腺,部分组织置于4%多聚甲醛固定24 h,制备石蜡切片。
1.2.5 HE染色
常规石蜡切片经过二甲苯脱蜡、梯度乙醇脱水,苏木素、伊红染色,脱水、二甲苯透明后,中性树胶封片。光学显微镜下观察。
1.2.6 TUNEL
常规石蜡切片先经二甲苯脱蜡、梯度乙醇脱水,随后给予Proteinase K工作液进行细胞通透,在恒温箱孵育30 min后加TUNEL反应液(处理组用50 μL 1号液+450 μL 2号液的混匀液;而阴性对照组仅加50 μL 2号液,阳性对照组先加入100 μL DNase 1 50 μL 1号液+450 μL 2号液的混匀液),期间予以PBS反复冲洗,加converter-POD,与底物DAB反应显色,梯度乙醇脱水、二甲苯透明后,中性树胶封片。计算各组细胞凋亡指数(AI)[9]的值:每只大鼠取胰组织切片5张,每张切片在光镜下随机观察5个胰岛,计数每个胰岛中的凋亡细胞(呈棕黄色)及正常细胞。按以下公式计算:细胞凋亡指数(AI)=凋亡细胞数/(凋亡细胞数+正常细胞数)。
1.2.7 免疫组化
常规石蜡切片经过二甲苯脱蜡、梯度乙醇脱水,Triton细胞通透后,微波炉加热抗原修复,滴加正常山羊血清封闭液,加入一抗Caspase-3(活化)(1:100稀释)后,置于4度冰箱过夜。第2天,经PBS冲洗后,加入羊抗兔二抗(生物素标记二抗工作液),DAB显色后,苏木素复染,自来水冲洗,梯度乙醇脱水、二甲苯透明后,中性树胶封片。各组胰岛细胞浆中具有活性的Caspase-3表达率的计算是每只大鼠取胰腺组织切片5张,每张切片在光镜下随机观察5个胰岛,使用Image-Pro Plus 6.0图像处理软件,计算平均光密度值公式:平均光密度值=光密度值/胰岛总面积。
1.2.8 统计学方法
本实验所得数据均以SPSS 17.0统计软件处理,各组数据以均数±标准差(±s)形式表示;组间比较用单因素方差分析,以P<0.05为有显著统计学差异。
2 结果
2.1 糖耐康对大鼠FPG的影响
给药前及给药6周后,各组大鼠取血测FPG。给药前,模型组及各给药组大鼠与正常组大鼠相比,FPG值显著升高(P<0.01);各给药组大鼠与模型组相比,FPG值无显著差异(P>0.05)。给药后,模型组及各给药组大鼠与正常组大鼠相比,FPG值显著升高(P<0.01);各给药组大鼠与模型组相比,FPG值均显著下降(P<0.01)。结果见表1。
2.2 糖耐康对大鼠INS的影响
给药前及给药6周后,各组大鼠取血测INS。给药前,模型组及各给药组大鼠与正常组大鼠相比,INS值有极显著差异(P<0.01);各给药组大鼠与模型组相比,INS值无显著差异(P>0.05)。给药后,模型组及各给药组大鼠与正常组大鼠相比,INS值显著升高(P<0.01);给药组与模型组相比,二甲双胍组、糖耐康高剂量组及低剂量组INS值均显著升高(P<0.05),糖耐康中剂量组大鼠INS值有所升高(P>0.05),但无统计学差异。结果见表2。
2.3 糖耐康对HOMA-IR的影响
给药前及给药6周后,计算各组大鼠HOMAIR。给药前,模型组及各给药组大鼠与正常组大鼠相比,HOMA-IR有极显著差异(P<0.01);各给药组大鼠与模型组相比,HOMA-IR无显著差异(P>0.05)。给药后,模型组及各给药组大鼠与正常组大鼠相比,HOMA-IR显著升高(P<0.01);给药组与模型组相比,二甲双胍组、糖耐康高剂量组HOMA-IR均极显著降低(P<0.01),糖耐康中、低剂量组大鼠HOMAIR有所降低(P>0.05),但无统计学差异。结果见表3。
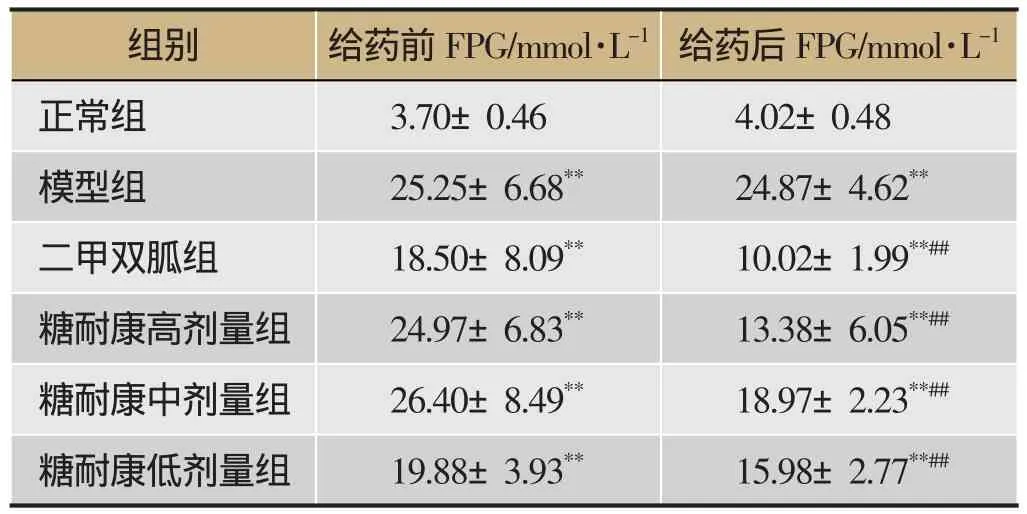
表1 ZDF大鼠FPG值测定结果

表2 ZDF大鼠INS值测定结果

表3 ZDF大鼠HOMA-IR结果
2.4 大鼠胰腺组织HE染色结果
正常组胰岛细胞,边界整齐,胰岛β细胞聚集分布;模型组胰岛细胞边界不整齐,胰岛β细胞肿胀,大小不等,排列紊乱,胰岛细胞内结构模糊(图1)。

图1 镜下观察ZDF大鼠胰岛细胞形态结构(HE染色×400)
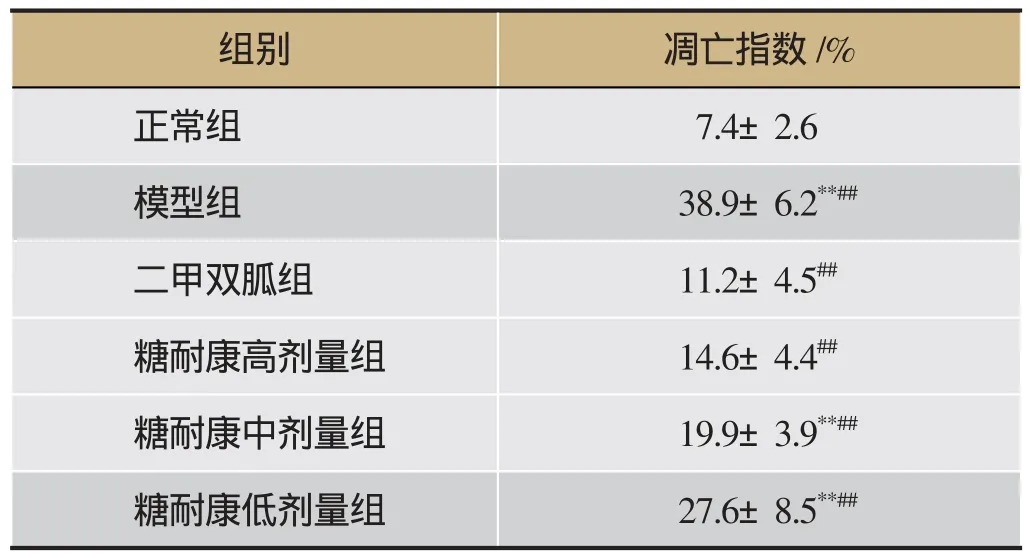
表4 各组大鼠胰岛细胞AI值(n=6)
2.5 大鼠胰腺组织TUNEL检测结果
正常组大鼠胰岛边界清楚,胰岛β细胞分布正常,几乎未见棕黄色的阳性细胞;模型组胰岛边界模糊,胰岛β细胞分布异常,可见大量的棕黄色阳性细胞。统计结果显示,与正常组相比,糖耐康中、低剂量组及模型组可见棕黄色阳性细胞显著增多(P<0.01),糖耐康高剂量组及二甲双胍组均无显著性差异(P>0.05);与模型组相比,各给药组棕黄色阳性细胞显著减少(P<0.01)均有统计学意义(P<0.01)。与二甲双胍组相比,糖耐康高剂量组无统计学差异(P>0.05),糖耐康中剂量组(P<0.05)及糖耐康低剂量组(P<0.001)均显著增多(P<0.05)。结果见表4、图2。
2.6 大鼠胰腺组织Caspase-3蛋白表达结果
正常组大鼠胰岛边界清楚,胰岛β细胞分布正常,细胞浆内Caspase-3蛋白阳性表达(棕黄色着色区)较少;模型组胰岛内可见大量的棕黄色Caspase-3蛋白表达。与正常组比,各给药组及模型组棕黄色阳性蛋白表达显著增多(P<0.01);与模型组相比,给药组棕黄色阳性蛋白表达显著减少(P<0.01)。与二甲双胍组比,糖耐康高剂量组无统计学差异(P>0.05),糖耐康中剂量组(P<0.001)及糖耐康低剂量组(P<0.001)显著增多(P<0.01)。结果见图3、表5。

图2 镜下观察ZDF大鼠胰腺组织TUNEL染色情况(TUNEL×400)

图3 镜下观察ZDF大鼠胰岛Caspase-3表达情况(免疫组化×400)
3 讨论
细胞凋亡(Apoptosis)概念于1972年由Kerr等首次提出,是由基因控制的细胞的自然死亡过程,现在普遍认为细胞的凋亡也可能是由半胱氨酸蛋白酶Caspase级联反应调控的结果。Caspase-3是半胱氨酸蛋白酶家族中重要的一员,最初从人类的Jurkat-T淋巴细胞中克隆出。作为细胞凋亡中的关键蛋白酶,其以酶原形式存在,是整个凋亡级联反应的关键调节点。正常情况下,Caspase-3以休眠的酶原形式存在,在T2DM的发展过程的早期,胰岛β细胞具有一定的代偿能力,发挥分泌胰岛素的正常功能;当其失代偿时,胰岛素分泌减少,则会表现出空腹血糖升高,未加控制则见糖毒性、脂毒性。长期的高糖或游离脂肪酸等的增高、氧化应激的自由基产生增加,胞内细胞色素C(Cyt-C)会从线粒体内膜分离下来释放到胞浆中,从而激活Caspase路径;Caspase-3活化后,导致细胞凋亡级联反应的发生,胰岛β细胞损害、衰竭,甚至凋亡,以致胰岛β细胞的胰岛素分泌彻底消失[10-12]。
实验采用的ZDF大鼠,是从具有“肥胖基因”并出现糖尿病表型的大鼠中筛选出的高胰岛素血症肥胖模型,表现为糖耐量异常、高胰岛素血症、高脂血症和胰岛素抵抗[13],与人的非胰岛素依赖型糖尿病具有相似改变等特点。该大鼠由于瘦素受体突变使得瘦素对食欲控制及产热作用受损,最终导致多食、明显肥胖、血糖、血脂异常,其病情发展复制了人类糖尿病的进程[14,15]。以往研究发现,在T2DM自发型动物模型ZDF(fa/fa)大鼠体内,胰岛β细胞数量明显减少,提示胰岛β细胞的凋亡有可能参与T2DM的发病过程。因此,本实验选用此糖尿病大鼠模型[16]。

表5 各组大鼠胰岛细胞Caspase-3平均光密度值(n=6)
糖耐康主要由人参、女贞子、夏枯草、三白草、番石榴叶组成,具有清热生津、益气养阴的功效,既往研究显示其可有效调控T2DM动物或患者的血糖。据现代药理学研究显示,方中的人参皂苷也具有明显地阻止胰岛β细胞凋亡的功能[17]。本实验中模型组INS值较给药前明显下降,提示该组胰岛β细胞不断凋亡,胰岛素的分泌下降;糖耐康高、中剂量组、二甲双胍组血清胰岛素值有所上升,糖耐康低剂量组INS值稍有下降,提示糖耐康可改善胰岛β细胞凋亡,使得胰岛素分泌恢复正常。给药后ZDF大鼠的FPG值较给药前明显下降,可能是由于糖耐康改善胰岛β细胞凋亡情况,胰岛素正常分泌以降低体内葡萄糖浓度。结合给药后,给药组HOMA-IR均有所降低,可见其能改善胰岛素抵抗;其中,血清胰岛素本应在胰岛素抵抗改善后降低,而本实验中给药组血清胰岛素却有所升高。在T2DM过程中,同时存在胰岛素抵抗及胰岛β细胞凋亡,实验中HOMAIR降低的同时血清胰岛素却有所升高这可能提示糖耐康在改善胰岛素抵抗的同时减少胰岛β细胞的凋亡,使胰岛素得以正常分泌。TUNEL实验观察糖耐康干预ZDF大鼠胰岛β细胞凋亡情况,发现糖耐康给药组的胰岛β细胞凋亡水平均明显下降;免疫组化结果显示,糖耐康给药组均可下凋亡相关基因Caspase-3蛋白表达水平,抑制整个凋亡级联反应的下调,从而减少胰岛β细胞凋亡,恢复分泌胰岛素的功能有关。
由此可见,糖耐康调节2型糖尿病大鼠血糖作用,可能与其改善胰岛素抵抗的同时通过调控Caspase-3,抑制凋亡级联反应,减少胰岛β细胞的凋亡相关。而从整个实验结果来看,糖耐康各组与西药二甲双胍对胰岛β细胞凋亡的干预作用结果一致,究其具体机制我们将做进一步的蛋白及基因水平研究以验证。
1 Butler A E, Janson J, Bonner-Weir S, et al. β-cell deficit and increased β-cell apoptosis in humans with type 2 diabetes. Diabetes, 2003, 52(1): 102-110.
2 Clark A, Wells C A , Buley I D, et al. Islet amyloid, increased A-cells, reduced B-cells and exocrine fibrosis: quantitative changes in the pancreas in type 2 diabetes. Diabetes Res, 1988, 9(4): 151-159.
3 朱波,薛耀明.胰岛β细胞凋亡在2型糖尿病中的作用研究进展.广东医学, 2005, 26(5): 709-711.
4 乌海飞,尹红燕,刘帅,等.胰岛β细胞的分子核医学显像进展.国际放射医学核医学杂志, 2010, 34(4): 203-205.
5 Maedler K,Spinas G A,Dynfar D, et al. Distinct effects of saturated and monounsaturated fatty acids on beta-cell turnover and function. Diabetes, 2001, 50(1): 69-76.
6 Johnson, J D, Luciani, D S. Mechanisms of pancreatic beta-cell apoptosis in diabetes and its therapies. Adv Exp Med Biol, 2010, 654: 447-462.
7 郭翔宇,段颖,刘铜华,等.糖耐康对肥胖Zucker大鼠血糖的影响及其机制.中西医结合学报. 2010, 8(6): 535-537.
8 闫小光.糖耐康干预糖耐量异常的临床研究和部分作用机制探讨.北京:北京中医药大学博士学位论文, 2013: 32.
9 Dworakowska D, Jassem E, Jassem J, et al. Clinical signi fi cance of apoptotic index in non-small cell lung cancer:correlation with p53, mdm2, pRb and p21WAF1/CIP1 protein expression. J Cancer Res Clin Oncol, 2005, 131(9): 617-623.
10 惠晓丽. β细胞凋亡与2型糖尿病.国外医学内分泌学分册, 2005, 25(1): 22-24.
11 Hayden M R, Sowers J R. Isletopathy in Type 2 diabetes mellitus:implications of islet RAS, islet fibrosis, islet amyloid, remodeling, and oxidative stress. Antioxid Redox Signal, 2007, 9(7): 891-910.
12 李娟,陈庄. Caspase家族与2型糖尿病胰岛β细胞凋亡的关系.中外医学研究, 2016, 14(4): 154-155.
13 陈华.医学实验动物学.北京:军事医学科学出版社, 2013, 8: 257.
14 Peterson R G, Shaw W N, Neel M, et al. Zucker diabetic fatty rat as a model for noninsul independent diabetes mellitus. ILAR News, 1990, 32: 16-19.
15 Pickavance L, Widdowson P S, King P, et al. The development of overt diabetes in young Zucker Diabetic Fatty (ZDF) rats and the effect of chronic MCC-555 treatment. Br J Pharmacol, 1998, 125(4): 767-770.
16 Butler A E, Jang J, Gurlo T, et al. Diabetes due to a progressive defect in beta-cell mass in rats transgenic for human islet amyloid polypeptide (HIP Rat): a new model for type 2 diabetes. Diabetes, 2004, 53(6): 1509-1516.
17 陈斌,钱骅,赵伯涛,等.人参和西洋参对糖尿病作用的研究进展.人参研究, 2011, 1: 33-35.
The Mechanism Behind the Anti-Apoptotic Effects of TNK on Islet β Cell in Type 2 Diabetic ZDF Rats
Wu Lijuan1, Sun Wen2, Liu Tonghua3, Wu Lili2, Qin Lingling4
(1. School of Clinical Medicine, Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China;
2. Health-Cultivation Laboratory of the Ministry of Education, Beijing University of Chinese Medcine, Beijing 100029, China
3. School of Graduates, Beijing University of Chinese Medcine, Beijing 100029, China;
4. Department of Science and Technology, Beijing University of Chinese Medcine, Beijing 100029, China)
This study aimed to investigate the anti-apoptotic effects of Tangnaikang (TNK) on islet β cells in Zucker diabetic fatty (ZDF) rats. Six male fa/+ ZDF rats were took as the control group, while other thirty male fa/ fa ZDF rats were divided into five groups at random: the model group, the metformin group, the high-, mediumand low-dose TNK groups, depending on their body weight and random blood glucose. Prior to the administration, fasting blood glucose and fasting insulin were measured by drawing blood with inner canthusl. Materials were prepared when administered for six weeks. Fasting blood glucose and fasting insulin were detected again. When the sections of the rat pancreatic tissue were embedded, the morphological changes of the islet were observed via HE staining, and the apoptosis of islet β cell were observed using TUNEL. Positive expression of Caspase-3, the transduction enzyme of cell death signal, was tested by immunohistochemical method. It was found that the fasting blood glucose of the (fa/fa) ZDF rats in the high-, medium- and low-dose TNK group was significantly improved after administration (P < 0.01). The serum insulin of rats in the high-, medium- and low-dose TNK group arised compared with the model group, while the high- and low-dose TNK group showed differences in a statistical sense. Compared with the model group, the HOMA-IR of all the treatment group decreased, while significant difference was presented between the high-dose TNK group and the metformin group. HE staining showed that the morphology of the islet β cell of the rats in all the treatment group was improved. The results of TUNEL showed significantly apoptotic changes on islet β cell of the fa/fa ZDF rats. Compared with the model group, the positive expression of TUNEL in the metformin group and the high-dose TNK group were significantly reduced (P < 0.05). The result of immunohistochemistry method showed that the protein levels of Caspase-3 in the metformin group and the high-dose TNK group decreased (P < 0.05). In conclusion, it was demonstrated that TNK effectively reduced the apoptosis of islet β cells in fa/fa ZDF rats, which presented a protective effect.
Tangnaikang, islet β cells, Zucker diabetic fatty rats, hematoxylin-eosin staining, terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay, caspase-3
(责任编辑:董晓娜,责任译审:朱黎婷)
10.11842/wst.2016.07.007
R2-031
A
2016-07-01
修回日期:2016-07-15
* 科学技术部国家“十二五”科技支撑计划课题(2014BAI10B04):中药干预糖调节受损临床疗效评价研究,负责人:刘铜华。
** 通讯作者:刘铜华,本刊编委,教授,博士生导师,主要研究方向:中医药防治糖尿病及其并发症的临床和基础研究。

