基于DNA条形码的岭南特色药材广东海桐皮、木棉花与其混淆品的分子鉴定*
黄 娟,徐 文,谭瑞湘,白俊其,李西文,黄志海**
(1. 广州中医药大学第二临床医学院 广州 510006;2.中国中医科学院中药研究所 北京 100700)
基于DNA条形码的岭南特色药材广东海桐皮、木棉花与其混淆品的分子鉴定*
黄 娟1,徐 文1,谭瑞湘1,白俊其1,李西文2,黄志海1**
(1. 广州中医药大学第二临床医学院 广州 510006;2.中国中医科学院中药研究所 北京 100700)
目的:本研究主要应用第二内转录间隔区(ITS2)序列作为DNA条形码进行分析,建立对岭南中药广东海桐皮、木棉花与其混淆品的快速鉴定法。方法:收集广东海桐皮等9个物种样本,提取样本基因组DNA,扩增ITS2基因片段,对其产物进行双向测序。所得序列采用CodonCode Aligner进行拼接。利用MEGA 6.06软件进行种间变异及遗传距离分析,并构建系统进化树。结果:9个物种的ITS2序列长度范围为224-237 bp,物种的种内遗传距离(0.000-0.017)明显小于种间遗传距离(0.045-0.820),NJ和ML聚类树显示,各物种样本独聚一支,表现出单系性。结论:ITS2序列能够有效鉴别植物海桐皮、木棉花与其混淆品,为其基原植物鉴定提供依据,为保证用药真实及其临床疗效提供分子鉴定方法。
海桐皮 木棉花 ITS2序列 分子鉴定 DNA条形码
中药材的真伪是中药质量控制的首要问题。岭南药材为广东特色中药材,其中部分道地药材已被《中国药典》(以下简称《药典》)收录,如:广金钱草、广藿香、化橘红、何首乌、陈皮、佛手等;但大部分广东常用中药材尚未被《药典》收载,且与《药典》收载的品种同名,如:络石藤与广东络石藤、旋覆花与广东旋覆花、海风藤与广东海风藤、合欢花与广东合欢花、海桐皮与广东海桐皮等。上述同名异物药材在临床上常常混用,严重影响临床疗效。
木棉科植物木棉Bombax malabaricum具有重要的药用价值,其树皮、花分别以广海桐皮、木棉花之名收载于现行《广东省中药材标准》中[1]。广东海桐皮,原载于《生草药性备要》中,在广东历来作为海桐皮使用,有清热利湿、活血、消肿的功效,为与其它地区习用海桐皮区别,故以广东海桐皮命名。据调查,全国称之为海桐皮的植物种类来源多,其正品为豆科刺桐Erythrina variegate Linn.树皮,习用品刺楸Kalopanax septemlobus有川桐皮之称,椿叶花椒Zanthoxylum ailanthoides在福建及江浙地区也作为海桐皮使用[2]。同名药材来源的多样性容易混淆使用并使得临床疗效不确定。因此,对海桐皮快速、准确的鉴定并建立相应的质量标准对其临床用药安全有效具有重要的指导意义。
DNA条形码鉴定技术是基于遗传信息的鉴定方法,具有鉴定准确快速、不受研究对象外部形态干扰等特点,特别适合中药材的鉴定[3]。其中ITS2条形码在中草药的鉴定应用非常广泛,如:应用ITS2开展赤芍、锁阳、山豆根等中药及其混淆品的鉴定研究已取得一定成果[4-6]。为保证临床用药的安全性和有效性,本文基于ITS2条形码技术开展岭南特色药材广东海桐皮、木棉花与其常见混淆品的鉴定研究,为建立快速、准确的鉴定方法和相关质量标准提供新的参考。
1 材料和方法
1.1 药材
本研究共收集海桐皮E. variegata Linn.、木棉花B. malabaricum DC.及其混淆品美丽异木棉Ceiba speciosa、吉贝C. pentandra L. Gaetn.、刺楸K. septemlobus Thunb. Koidz.、椿叶花椒Z. ailanthoides Sieb. Et. Zucc.、簕欓花椒Z. avicennae Lam. DC.、大叶臭花椒Z. myriacanthum Wall. Ex Hook. f.、楤木Aralia chinensis L. 9个物种16个样本。植物材料由华南植物鉴定中心叶华谷研究员鉴定,凭证标本已分别保存于广东省中医药科学院和中科院华南植物鉴定中心。同时,从GenBank数据库中获3条完整的ITS2序列,验证后用于比较分析。具体信息见表1。
1.2 试剂和仪器
植物基因组DNA 提取试剂盒(北京天根生化科技有限公司,批号:P4104);D2000 DNA Marker(日本TaKaRa 公司,批号:P4219);2×Taq PCR Mix 酶(北京艾德莱生物科技有限公司,批号:262451AX);无水乙醇(广州化学试剂厂,批号:20150604);异丙醇(广州化学试剂厂,批号:20150309);Tris(美国Sigma公司,批号:V900483);β-巯基乙醇(美国Sigma公司,批号:M6250);Tris-HCl(上海麦克林生化科技有限公司,批号:T818979);Glodview核酸染料(上海赛百盛基因技术有限公司,批号:20151209);琼脂(美国Sigma公司,批号:V900500)。引物由上海美吉生物科技有限公司合成。
ProFlex PCR system(美国Life Technologies公司,型号:ProFlex);小型离心机(德国eppendorf公司,型号:5418);多功能样品均质器(法国Bertin Technologies公司,型号:Precellys 24孔);凝胶成像系统(美国Bio-Rad公司,型号:GelDoc XR+);多功能垂直旋转混合器(英国Grant公司,型号:PTR-30/PTR-60);水平电泳槽(美国Bio-Rad公司,型号:Mini-Sub Cell GT)。
1.3 方法
取根茎40 mg或叶片30 mg左右于2 mL离心管中,加入钢珠磨碎样品,按照DNA提取试剂盒说明书步骤提取植物基因组总DNA。通过ITS2片段进行PCR扩增,正向引物:ITS2F:5’-ATGCGAT ACTTGGTGTGAAT-3’,反向引物:ITS3R:5’-GACG CTTCTCCAGACTACAAT-3’。PCR反应体系为25 μL,包括正、反向引物各1 μL(2.5 μmol·L-1),2×Taq PCR Mix酶 12.5 μL,模板DNA 2.0 μL(约30-100 ng),加TE缓冲液补足至25 μL。扩增程序:94℃变性5 min;94℃变性30 s,56℃退火30 s,72 ℃延伸45 s(40个循环);72 ℃、10 min[10]。扩增产物采用1.2%琼脂糖凝胶电泳进行检测,将电泳条带清晰、明亮、单一的PCR产物送测序公司进行双向测序。
1.4 数据分析
所得序列采用CodonCode Alinger 6.02软件进行校对拼接,基于隐马尔可夫模型的HMMer注释方法去除两端5.8S和28S区段,获得完整的ITS2序列[6]。利用软件MEGA 6.06进行分析比对,分析变异位点,基于K2P模型进行种内种间遗传距离分析,并构建系统发育NJ树及ML树[8,9]。
2 结果与分析
2.1 ITS2序列分析
9种海桐皮、木棉花及混淆品ITS2序列长度均较短,在224- 237 bp之间。其中,木棉花序列长度为237 bp,无种内变异位点;刺楸比对后序列长度为230 bp,有2个变异位点,为100位点C/T突变、217位点A/G突变;簕欓花椒序列长度均为224 bp,有1个变异位点,为132位C/T突变,大叶臭花椒序列长度为224 bp,无变异位点。应用MEGA 6.06分析所得的16条完整的ITS2序列,发现不同物种间的ITS2序列变异较大。木棉与异木棉属美丽异木棉及吉贝间均有20多个变异位点,可明显区分。海桐皮与其混淆品之间也具有较多变异位点,比对后发现,正品海桐皮与其伪品木棉、刺楸、椿叶花椒、簕欓花椒、大叶臭花椒、楤木间分别有96、108、98、97、100、及103个变异位点。详见表2。
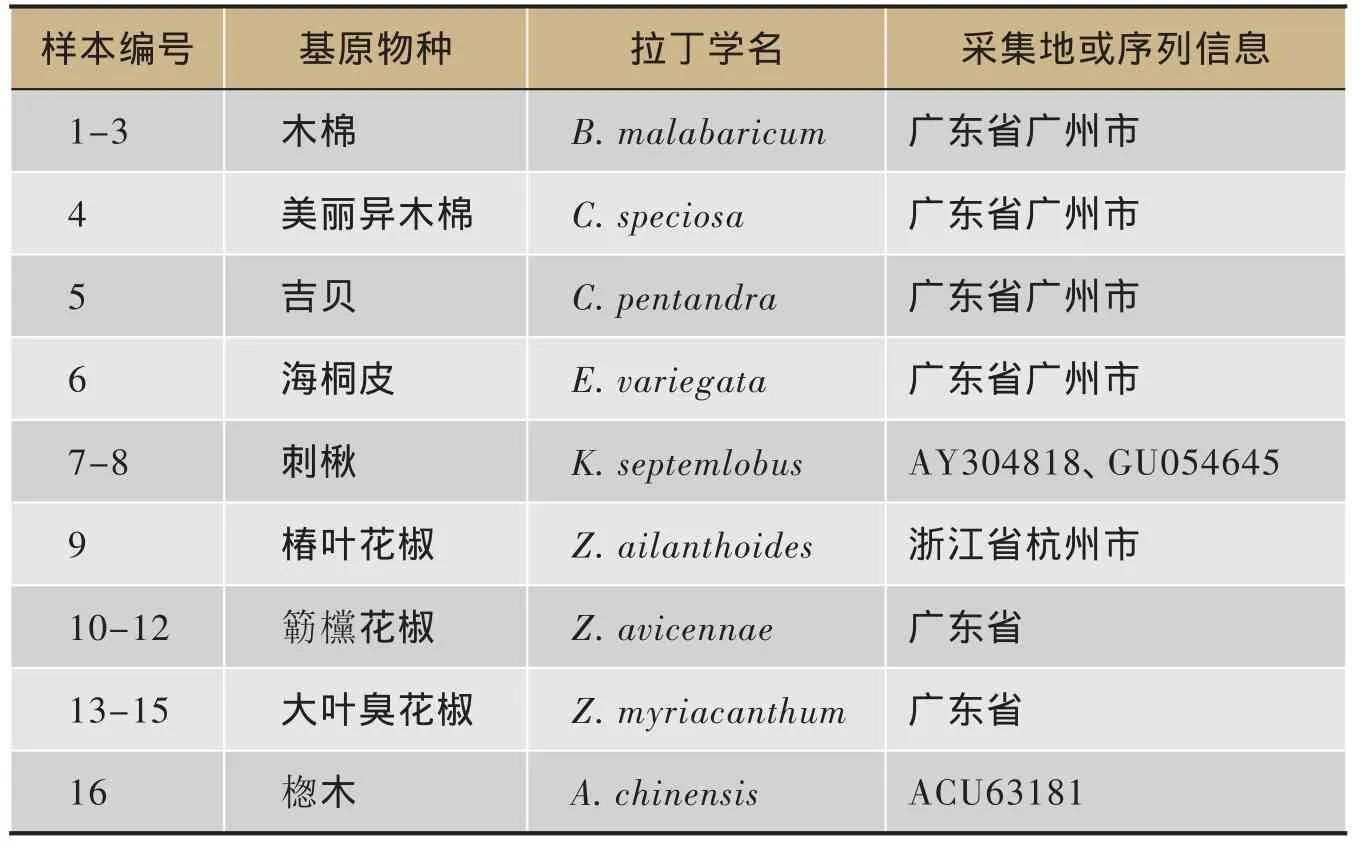
表1 海桐皮、木棉花与其混淆品样本信息
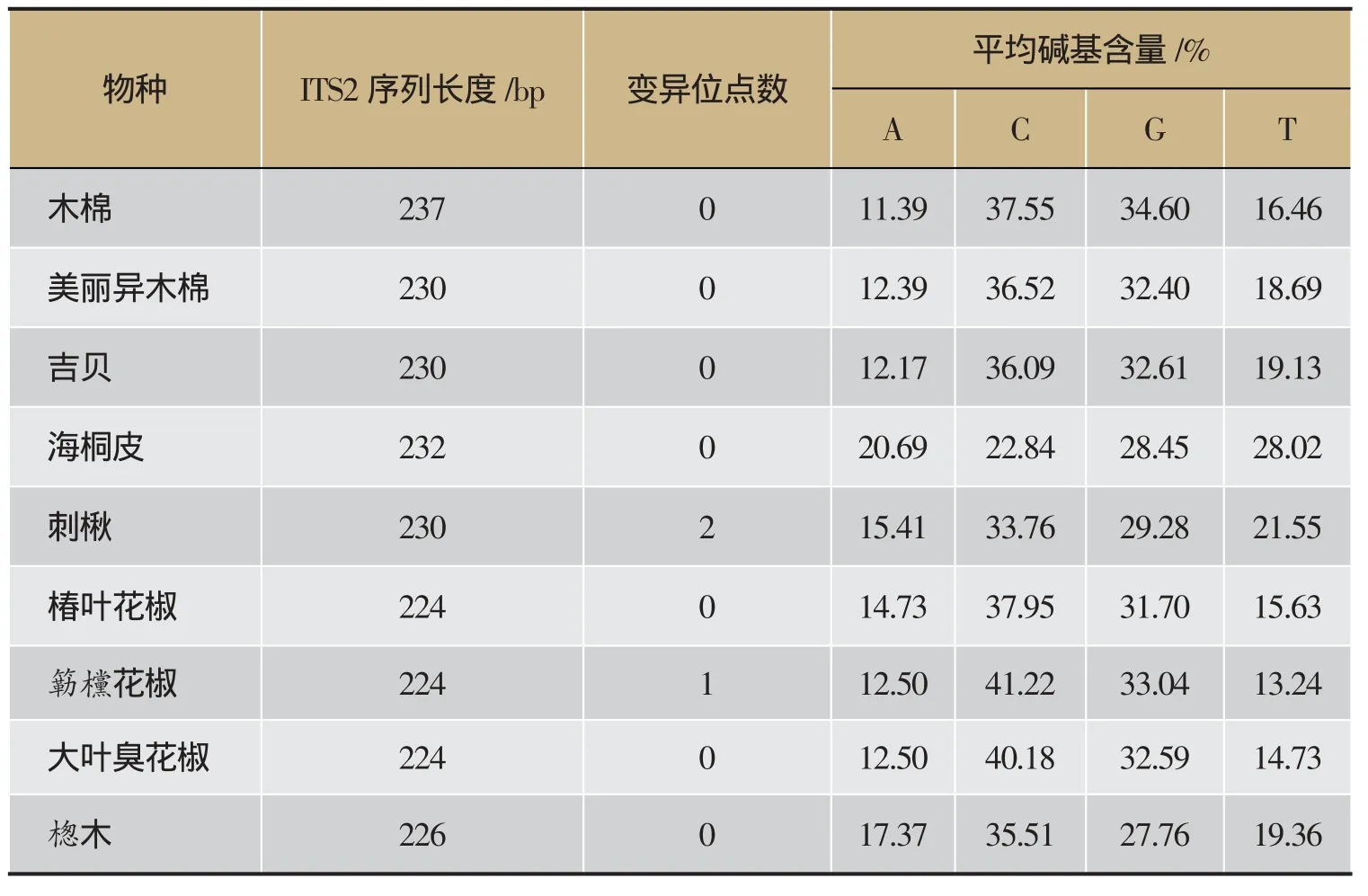
表2 海桐皮、木棉花与其混淆品的ITS2序列特征
2.2 遗传距离分析
基于MEGA 6.06分析得到种间K2P距离(表3)。分析发现,同属植物美丽异木棉与吉贝间种间K2P距离最小,与植物分类学一致。物种间K2P距离(0.045-0.820)远远大于种内遗传距离(0.000-0.017),可将各物种明显区分。
2.3 聚类树分析
为确定ITS2序列在海桐皮、木棉花与其混淆品之间的鉴定能力,本实验基于K2P模型构建了两种不同的聚类树,即NJ树和ML树,并去除bootstrap支持率小于50%的分支,见图1和图2。分析NJ树结果,海桐皮基原植物单独成枝,木棉属植物木棉、美丽异木棉及吉贝聚成一大支,椿叶花椒、簕欓花椒及大叶臭花椒聚成一支;ML树结果显示,除了美丽异木棉、吉贝与木棉分开单独成枝,其余分支情况与NJ树一致。两个聚类树结果共同表明,各物种种内样本分别聚在一支,表现出单系性,与其他品种能够明显区分。
3 讨论
本文对海桐皮、其习用品及相关同属植物进行研究。结果显示,同属植物美丽异木棉与吉贝间种间K2P距离最小,仅为0.045;但两者间存在9个变异位点,且聚类树结果bootstrap支持率均大于90%,因此易于区分。分析其他物种,发现其余各品种间的变异位点数量均大于20个,且遗传距离距离较大(0.111-0.820),可明显区分。聚类树结果显示,同属植物聚为一大支,符合生物学分类特点;且各物种独聚一支,表现出单系性。以上结果证明,利用ITS2序列可准确鉴定海桐皮、木棉花及相关混淆品,迅速判断基原植物,给临床使用提供一定的参考价值。
中药材因历史渊源、民间习俗等原因,长期存在异药同名的现象,甚至地方标准和《中国药典》中也存在严重的同名异物问题[10],加之中药材市场的混乱,造成中药材品种难以区别的现象。南药海桐皮为同名异药的典型,各地均有该名称药材,而基原植物品种相差甚远。无论是广海桐皮还是川桐皮均以树皮入药,难以从外观上准确鉴定,尤其是对于非植物鉴定专业人员。因此,本文从分子鉴定方法入手,建立了一种快速鉴定海桐皮基原植物的方法。由于样本采集条件的限制,本文所采集植物样本基本分布在广东地区,具有一定的代表性,但并不能囊括该植物的全部特点。由于遗传背景的差异,可能造成不同地区DNA条形码序列的变化。在后期研究中,将扩大采集样本地区,综合分析各物种不同地区之间的差异,为全面准确鉴定植物提供依据。
针对中药材市场混乱的现象,本文认为对于中药饮片应在出厂前进行准确鉴定,结合外观、显微等传统鉴定方法及分子鉴定手段确认药材基原植物。同时可以利用二维码技术构建植物特别是药材DNA数据库,明确基原、产地、功效等信息,达到中药材市场信息化、准确化、便利化的目的,利于临床医生疗效判断,也为患者提供参考。
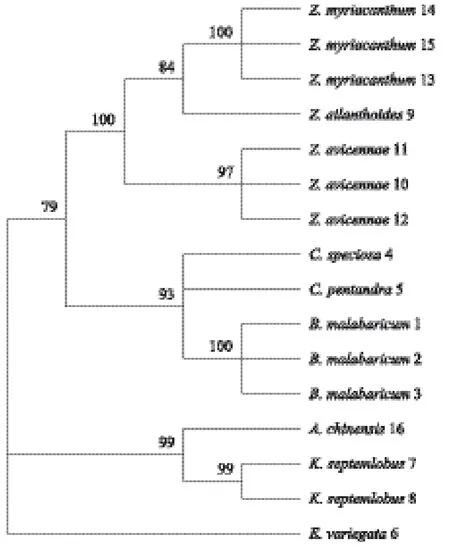
图1 基于ITS2序列的南药材海桐皮、木棉花与其混淆品NJ树
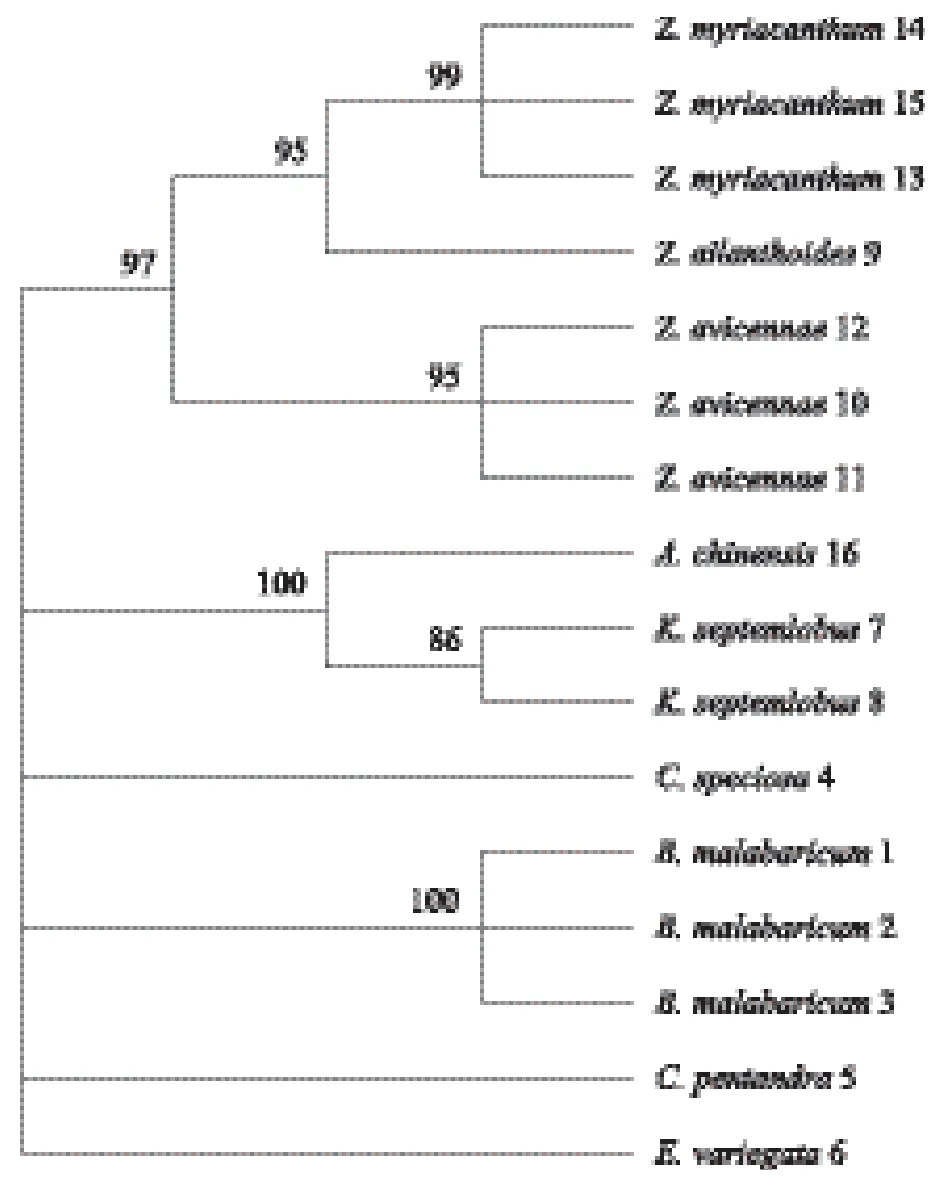
图2 基于ITS2序列的南药材海桐皮、木棉花与其混淆品ML树
1 广东省食品药品监督管理局.广东省中药材标准(第二册).广州:广东科技出版社, 2011: 43.
2 李永杰.海桐皮及其易混品的比较鉴别.时珍国医国药, 2007, 18(10): 2445.
3 费希同,巨苗苗,林源,等. ITS2序列在植物DNA条形码鉴定中的应用.亚热带植物科学, 2014, 43(4): 339-342.
4 孙稚颖,宋经元,姚辉,等. 基于ITS2条形码的中药材赤芍及其易混伪品的DNA分子鉴定.世界科学技术-中医药现代化, 2011, 13(2): 407-411.
5 侯典云,宋经元,石林春,等.中药材锁阳的ITS2条形码分子鉴定研究.中国中药杂志, 2013, 38(23): 4028-4032.
6 徐晓兰,石林春,宋经元,等.基于ITS2条形码序列的山豆根基原植物及其混伪品的DNA分子鉴定.世界科学技术-中医药现代化, 2012, 14(1): 1147-1152.
7 Keller A, Schleicher T, Schultz J, et al. 5.8S-28S rRNA interaction and HMM-based ITS2 annotation. Gene, 2009, 430 (1-2): 50-57.
8 Tamura K, Nei M, Kumar S. Prospects for inferring very larger phylogenies by using the neighbor-joining method. Proc Natl Acad Sci USA, 2004, 101(30): 11030-11035.
9 Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihyood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol, 2011, 28(10) :2731-2739.
10 陈燕芬,卢军.广东特色中药材药性浅析.云南中医学院学报, 2015, 38(6): 21-24.
Molecular Identification of Erythrina variegate Linn., Bombax malabaricum and Their Adulterants Using DNA Barcode
Huang Juan1, Xu Wen1, Tan Ruixiang1, Bai Junqi1, Li Xiwen2, Huang Zhihai1
(1. The 2ndClinical College, Guangzhou University of Chinese Medicine, Guangzhou 510006, China;
2. Institute of Chinese Material Medica, China Academy of Chinese Medicines, Beijing 100700, China)
A molecular identification method taken ITS2 as DNA barcode was adopted to distinguish E. variegate, B. malabaricum from their adulterants. Samples from nine species were gleaned. The ITS2 regions were amplified with bi-directional sequencing. Along with some downloaded ones from the GenBank database, all sequences were assembled by CodonCode Aligner and analyzed by MEGA 6.06. The Kimura 2-Parameter (K2P) distances were computed and phylogenetic tree was built using the neighbor-joining (NJ) and maximum likelihood (ML) trees. As a result, it was found that the lengths of ITS2 sequence of the nine species varied from 224 to 237 bp. The intraspectific distance (0.000-0.017) was significantly shorter than the interspecific distance (0.045-0.820). The results of NJ tree and ML tree presented that all the nine species were separately and obviously clustered to one branch, a monophyletic clade. In conclusion, the ITS2 sequence can be treated as an ideal DNA barcode for the molecular identification of E. variegate, B. malabaricum and their adulterants, providing a reference for clinical application.
Erythrina variegate, Bombax malabaricum, ITS2, molecular identification, DNA barcode
10.11842/wst.2016.08.027
R282
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-07-28
修回日期:2016-08-10
* 广东省中医院院内专项 (2015KT1817):岭南中草药DNA条形码分子鉴定和生态适宜性研究,负责人:黄志海。
** 通讯作者:黄志海,主任药师,主要研究方向:中药资源与中药鉴定研究。

