马尔康柴胡不同药用部位解热、保肝作用与急性毒性研究*
闫 婕,卫莹芳,龙 飞,林 波,康 敏
(成都中医药大学药学院 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室——省部共建国家重点实验室培育基地 成都 610075)
马尔康柴胡不同药用部位解热、保肝作用与急性毒性研究*
闫 婕,卫莹芳**,龙 飞,林 波,康 敏
(成都中医药大学药学院 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室——省部共建国家重点实验室培育基地 成都 610075)
目的:本研究旨在为川产“竹叶柴胡”临床用药的安全性和有效性提供科学依据,为科学评价柴胡属其它植物药用价值及资源的开发和利用奠定基础。方法:研究采用酵母致热法引起实验动物发热,测定大鼠直肠温度。采用四氯化碳(CCl4)法制备肝损伤模型。采用试剂盒测定小鼠血清中谷草转氨酶(GOT)、谷丙转氨酶(GPT)、丙二醛(MDA)含量和肝组织中谷胱甘肽(GSH)含量,结合HE染色病理组织切片镜检及评分分析,对马尔康柴胡地上部分和根部进行解热保肝药理作用的研究。采用最大给药量试验进行急性毒性试验。结果:解热试验中,与模型组比较,地上部分高、低剂量及地下部分高剂量组造模后2 h肛温明显降低,地上部分高剂量组在造模后4 h出现肛温降低。保肝实验中,与模型组相比,马尔康柴胡根及地上部分水提液可降低肝损伤小鼠血清GOT、GPT、MDA水平,提高肝组织GSH水平;结合病理学观察,给药后第2天肝损伤明显,至给药后第6天和第14天,肝损伤程度与对照组相比无明显差异。最大剂量给药时呈现一定程度可逆性肝脏急性毒性。结论:马尔康柴胡根部和地上入药部分具有与柴胡一致的解热、保肝作用,具有药用价值;其“量-效-毒”关系还需深入研究。
马尔康柴胡 竹叶柴胡 解热 保肝 急性毒性
柴胡是大宗、常用中药材,除《中国药典》2015年版收载“柴胡Bupleunum chinense DC.和狭叶柴胡B. scorzonerifolium Willd.的干燥根”外[1],全国尚有20多种柴胡属植物在不同地区作为地区习用品入药[2]。《四川省中药材标准》2010年版首次将地区习用品“柴胡”更名为“竹叶柴胡”,来源为竹叶柴胡B. marginatum Wall.ex DC.、马尾柴胡B. microcephalum Diels.或马尔康柴胡B. malconense Shan et Y. Li的干燥全草[3]。
马尔康柴胡为野生品、资源丰富、疗效确切、价格低廉、使用广泛,但其物质基础和药理作用研究较少。课题组前期对马尔康柴胡不同药用部位药效物质基础进行研究[4-6],表明根主要含柴胡皂苷,地上部分主要含黄酮类成分,皂苷含量甚微。本文对其根和地上部分解热、保肝药效及安全性进行研究,为西南地区习用品“竹叶柴胡”临床用药的安全性和有效性提供科学依据,为科学评价柴胡属其它植物药用价值及资源的开发和利用奠定基础。
1 材料
1.1 药材
实验药材采自四川省汶川县,经成都中医药大学卫莹芳教授鉴定为马尔康柴胡B. malconense Shan et Y. Li的干燥地上部分与根。
1.2 实验动物
清洁级SD大鼠,雌雄各半,体质量200-220 g;清洁级昆明种小鼠,雌雄各半,体质量18-20 g。均购自由成都达硕生物科技有限公司,许可证号:SCXK(川)2008-24。
1.3 实验试剂
高活性干酵母(伊犁安琪酵母股份有限公司,批号:CL20140118),联苯双酯滴丸(台州浙江万邦药业股份有限公司,批号:AO2130139),4%多聚甲醛组织标本固定液(成都科龙化工试剂厂生产,批号:20130415)、乙醇(成都科龙化工试剂厂生产,批号:20130714)、二甲苯(成都科龙化工试剂厂生产,批号:20130318)、苏木素染液(北京百灵威科技有限公司生产,批号:LM10N13)、伊红染液(东京化成工业株式会社生产,批号:GL01-GMPC)、盐酸-乙醇分化液(成都市科龙化工试剂厂生产,批号:20130418)、中性树胶(上海懿洋仪器有限公司,批号:20130118)。试剂盒:GPT/GOT试剂盒(长春汇力生物技术有限公司,批号:2013034/2013018),MDA/GSH试剂盒(南京建成生物工程研究所,批号:20131016/20131017)。
1.4 仪器
电子肛温计(大连欧姆龙健康医疗中国有限公司,型号:MC-246)、多功能酶标仪(美国Thermo公司,型号:Multiskan MK3型)、超低温冰箱(日本Sanyo公司,型号:MDF-U50V)、高速离心机(德国Heraeus公司,型号:Biofuge pico)、微型漩涡混合仪(上海泸西分析仪器厂有限公司,型号:WH-3)、转轮式切片机(德国Leica公司,型号:徕卡-2016)、全自动封闭式组织脱水机/包埋机/病理组织漂烘仪(常州市中威电子仪器有限公司,型号:TSJ-Ⅱ、BMJ-Ⅲ、PHY-Ⅲ)、数码三目摄像显微镜(厦门麦克奥迪实业集团有限公司,型号:BA-400 Digital)等、图像分析软件Motic Images Advanced3.2工作站。
2 方法
药液的制备:取药材粉末适量,装于圆底烧瓶,依次加入10、8倍量水回流提取2次,每次1 h。滤过,合并滤液浓缩至相应体积,得到一定浓度(生药g·mL-1)的水煎液。用此方法分别制备实验“2.1”至“2.3”中不同部位不同剂量的药液。
2.1 采用酵母致热法进行大鼠解热实验
将大鼠置于实验环境中,在固定时间将测定探头插入大鼠直肠,每日两次读取测量值,使大鼠适应肛温测定的刺激。测量2天后,选取肛温在正常范围(36.6-37.8℃),温差不超过0.5℃的合格大鼠60只,按体质量随机分为6组:对照组、模型组、马尔康柴胡地下部分(bm-X)高、低剂量组,马尔康柴胡地上部分(bm-S)的高、低剂量组,每组10只。给药组按0.5 mL/100 g给予灌胃治疗,连续灌胃3天;空白组和模型组给予相同体积的蒸馏水,早晚各测定记录肛温一次。第4天禁食不禁水过夜,灌胃前1、0.5 h分别测肛温一次,灌胃给药后立即从背部皮下注射15%安琪高活性干酵母混悬液5.0 mL·kg-1,并连续测量造模后1 h、2 h、4 h、6 h肛温,记录肛温曲线。
2.2 建立急性肝损伤模型
取小鼠90只,随机分为9组,每组10只。设空对照组、模型组、阳性药对照组(联苯双酯滴丸)、bm-X和bm-S的高、中、低剂量组。分别对各组小鼠灌胃给药或给予同体积水,灌胃剂量0.2 ml·10 g-1,每天1次,连续给药7天。第7天给药后开始禁食,2 h后开始造模。造模方法∶ 除对照组外, 模型组和各给药组腹腔注射0.2% CCl4橄榄油溶液,注射剂量0.1 ml·10g-1。
2.3 保肝作用相关指标检测
造模16 h后摘眼球取血,收集血液至2 mL离心管内,37℃水浴,以3 500 r·min-1的转速分离血清。取血后迅速颈椎脱臼处死小鼠,随即剪取肝脏小叶约0.3-0.4 g,精密称重,使用玻璃匀浆器手动匀浆。血清及匀浆液均置于-80℃超低温冰箱中保存,同时剪取肝脏大叶置于4%多聚甲醛固定液中。按照试剂盒使用说明,测定血清中谷草转氨酶(Glutamic-Oxaloacetic Transaminase,GOT)、谷丙转氨酶(Glutamic-Pyruvic Transaminase,GPT)、丙二醛(Malonaldehyde,MDA),测定肝组织匀浆中谷胱甘肽(Glutathione,GSH)数值。每组随机选取8只小鼠的肝组织作HE染色的病理组织切片,镜检,分标本拍照并依照肝组织病理损伤程度(共分4级)进行评分分析。
2.4 采用最大给药量试验进行小鼠急性毒性
每组小鼠6只,按照7.5、15.0、45.0、75.0、120.0 g·kg-1剂量给药(相当于50、100、300、500、800倍成人日用剂量),观察48 h,没有小鼠死亡,无法计算半数致死量LD50,故按照最大给药量方法进行试验。
取90只小鼠,随机分为3组,即对照组、bm-X组和bm-S给药组,每组30只。实验前禁食不进水过夜,给药组分别按3.3、3.8 g·mL-1的剂量(即成人剂量的1 525倍、1 336倍),给予马尔康柴胡根及地上部分水提取液灌胃治疗,24 h内灌胃3次,对照组给予等体积的蒸馏水。给药后15、30 min和1、1.5、2、3、4、6、8、12、16、24 h观察和记录小鼠自主活动,连续观察14天。分别于第2天、第6天、第14天,每组处死10只小鼠,按照“2.3”项下的方法采集血样及肝组织样本,计算肝体比、测定生化指标、观察肝脏病理组织切片。
2.5 统计学方法
采用SPSS Statistics 15.0分析软件,对各组肛温及生化指标数值进行单因素方差分析,组间两两比较,若方差齐则采用LSD-t检验,若方差不齐采用Tamhane's T2法;病理组织切片镜检评分针对炎性侵润、脂肪变性、坏死、纤维化4个维度进行加权个案分析后,采用非参数检验Mann-Whitney U法。P<0.05认为组间差异有显著性差异,P<0.01认为差异有极显著差异。
3 结果
3.1 马尔康柴胡对发热大鼠肛温的影响
与对照组相比,造模后2 h至6 h模型组肛温明显升高(P<0.01)。与模型组相比,造模后2 h马尔康柴胡地上部分高剂量组肛温明显降低(P<0.01),马尔康柴胡地上部分低剂量组、地下部分高剂量组肛温明显升高(P<0.05)。造模后4 h,与模型组相比,马尔康柴胡地上部分高剂量组明显降低(P<0.05)。造模后6 h,给药各组与模型组相比肛温无明显差异。详见表1。
3.2 马尔康柴胡对急性肝损伤小鼠保肝功能的影响
3.2.1 生化指标测试结果
与对照组相比,模型组小鼠血清GOT、GPT、MDA水平明显升高(P<0.01);与模型组相比,马尔康柴胡地上部分高剂量组和根部高剂量小鼠血清GOT、GPT、MDA水平明显降低,肝组织GSH水平明显升高(P<0.05)。详见表2。
表1 对大鼠肛温的影响(±s,n=10)

表1 对大鼠肛温的影响(±s,n=10)
注:与对照组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
肛温/℃基础体温造模后1 h造模后2 h造模后4 h造模后6 h对照组-37.43±0.25 37.45±0.26 37.42±0.24 37.43±0.21 37.45±0.28模型组-37.42±0.31 37.96±0.28 38.92±0.30**39.37±0.29**39.54±0.32**bm-X高剂量组2.50 37.41±0.27 37.74±0.25 38.19±0.29#39.12±0.25 39.41±0.25 bm-X低剂量组0.80 37.43±0.25 37.83±0.23 38.66±0.25 39.21±0.28 39.50±0.31 bm-S高剂量组2.50 37.42±0.30 37.52±0.27 37.87±0.26##38.42±0.30#39.16±0.33 bm-S低剂量组0.80 37.43±0.23 37.70±0.34 38.20±0.20#38.98±0.28 39.34±0.27组别剂量/g·kg-1
表2 马尔康柴胡对小鼠血清GOT、GPT、MDA和肝组织GSH的影响(±s,n=10)

表2 马尔康柴胡对小鼠血清GOT、GPT、MDA和肝组织GSH的影响(±s,n=10)
注:与对照组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01;与阳性对照组相比,△P<0.05,△△P<0.01。
组别剂量/g·kg-1GOT/mmol·L-1GPT/mmol·L-1MDA/nmol·ml-1GSH/mgGSH·gprot-1对照组-2.092±0.191 1.633±0.190 7.885±2.556 0.338±0.129模型组-3.579±0.369**7.749±0.639**10.880±3.714**0.230±0.181阳性对照组11.670 mg·kg-12.192±0.524##4.761±0.488## 8.363±3.399#0.617±0.335#bm-X高剂量组4.500 2.822±0.448#5.604±0.202## 7.586±2.229##1.132±0.193##△△bm-X中剂量组3.000 2.941±0.678 6.432±0.351#△ 9.290±3.174 0.894±0.432##△bm-X低剂量组1.500 3.174±0.419△7.042±0.293△△ 9.838±2.059△0.876±0.140##△bm-S高剂量组4.500 2.818±0.360#5.897±0.207## 8.075±1.274#0.831±0.271##bm-S中剂量组3.000 3.015±0.664 6.343±0.312#△10.143±1.996△0.716±0.314##bm-S低剂量组1.500 3.206±0.388△6.983±0.427△△10.758±2.711△△0.568±0.233#
3.2.2 马尔康柴胡对急性肝损伤小鼠肝组织结构的影响
肝组织病理切片镜检可见,与对照组比较,模型组可见明显的肝细胞碎片状、灶状及大片溶解灶性坏死;肝细胞明显肿胀,水肿变性,炎细胞浸润,肝细胞细胞间界限不清,胞浆淡染,有的甚至可见细胞气球样变,胞浆变得较为透明,肝窦扩张充血。坏死区域主要位于小叶周边,提示是药物引起的肝小叶桥接坏死,判定CCl4肝损伤模型造模成功。给药组显示肝细胞损伤情况与模型组一致,但与模型组相比,给药组小鼠肝细胞坏死及水肿变性程度都较轻,肝细胞呈点状、碎片状坏死,未见大片溶解性坏死;肝细胞水肿、炎细胞浸润,体积略增大,细胞间尚有界限,胞浆淡染。详见图1。
采用光镜观察的评分记录进行统计学分析,与模型组相比,马尔康柴胡地下部分高剂量组和马尔康柴胡地上部分高剂量组肝组织病理学分值明显降低(P<0.01),马尔康柴胡地上部分与根均能有效抑制CCl4引起的细胞水肿变性和肝细胞坏死,具有抗CCl4肝损伤的作用,与生化指标测试的结果一致。
3.3 急性毒性试验

图1 马尔康柴胡对肝损伤小鼠肝组织结构的影响(HE染色,×100)
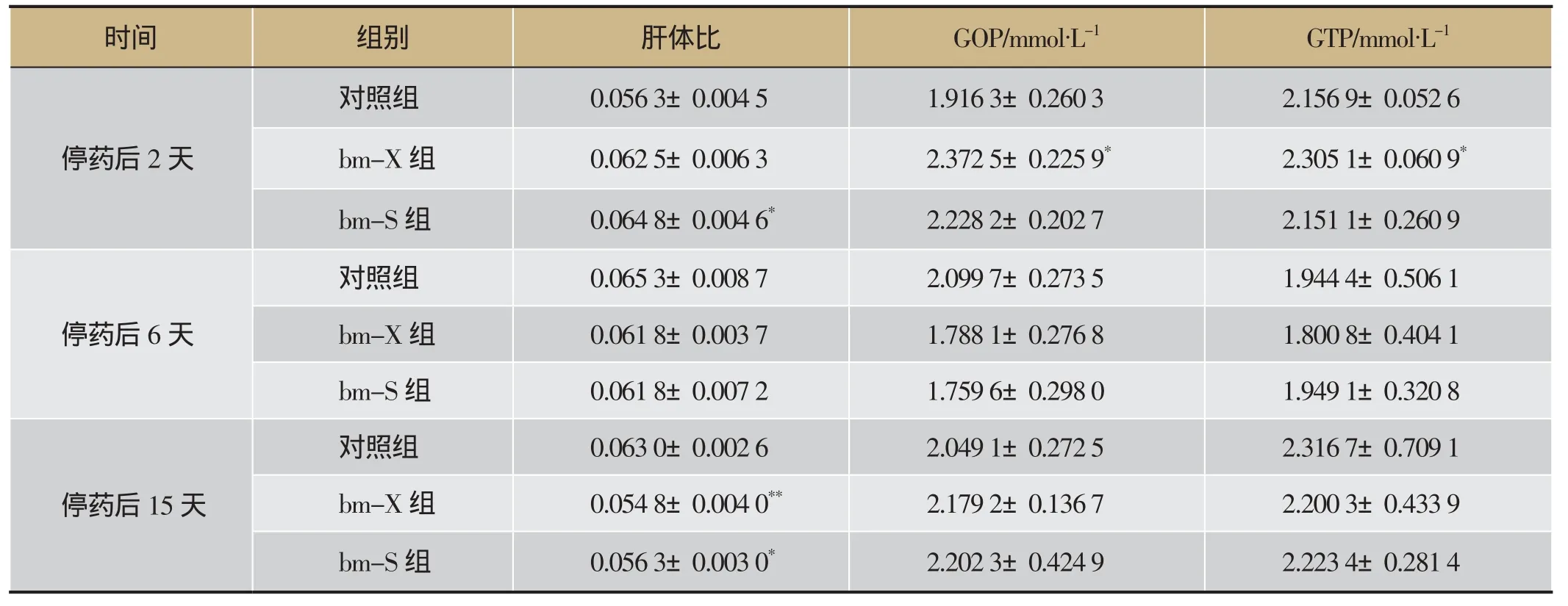
表3 急性毒性试验测试指标
小鼠首次大剂量给药15 min后,自主活动减少,给药4 h后出现腹泻、稀便;给药36 h自主活动逐渐恢复,腹泻症状好转;给药第2天,给药组肝体比值升高,马尔康柴胡根部给药组GOT与GPT水平明显升高(P<0.05);给药第6天与对照组比较未见明显差异(表3)。病理组织切片镜检可见,给药组的肝脏病理改变主要为肝细胞水肿变性,未见肝细胞坏死和肝脏纤维化增生。与对照组相比,给药组小鼠在给药第2天可见肝细胞轻度肿胀、体积增大,炎细胞侵润,细胞间尚有界限,胞浆淡染,地上部分给药组还可见轻微脂肪性病变;给药后第6天和第14天,给药组与空白组未见明显差异(详见图2)。以上急性毒性试验结果提示最大剂量马尔康柴胡不同部位水提取液灌胃具有一定程度的肝脏急性毒性,停药后1周左右可恢复正常。

图2 肝损伤小鼠急性毒性试验肝脏组织病理学观察(HE染色,×100)
4 讨论
干酵母致热为常用动物发热模型,致热原理是由注射部位的局部溃烂引发的剧烈炎症反应导致动物发热,适用于考察清热药的解热作用[7,8]。马尔康柴胡地上部分及根部提取物均可明显降低干酵母导致的大鼠体温升高,具有一定解热作用,其作用机制可能与抑制炎症反应有关。
CCl4所致肝损伤模型是药物性肝损伤的经典模型,其代谢过程中产生的自由基,可引起细胞膜和细胞器膜的不饱和脂肪酸过氧化,从而改变膜的流动性和通透性,导致细胞死亡[9,10]。GOT、GPT是反映肝功能受损的常用指标,MDA反应机体脂质过氧化的程度,可间接反映细胞损伤的程度;GSH可消除人体自由基,提高免疫力,是衡量机体抗氧化能力的重要指标[11,12]。马尔康柴胡地上部分与根部提取物能降低肝损伤后血清GOT、GTP、MDA水平,增加肝组织GSH水平;提示马尔康柴胡不同部位水提取液对CCl4致小鼠肝损伤具有保护作用,病理组织切片进一步验证了该结果。其保肝机制可能与提高机体清除自由基能力与抗脂质过氧化能力有关。
最大剂量给药时有一定程度可逆的肝脏急性毒性,后期应对马尔康柴胡的长期毒性、安全剂量及“量-效-毒”关系进行深入研究[13,14]。
5 小结
马尔康柴胡全草入药,药用部位及物质基础均与药典所述品种不同,本研究对根部与地上部分分别进行柴胡的传统功效相关的药理学研究,认为不同部位均具有解热、保肝作用,明确了四川地区习用品“竹叶柴胡”的药用价值,为全草入药的合理性提供科学依据,也为科学地评价柴胡属其它植物药用价值和西南地区柴胡资源的开发和利用奠定基础[15]。
1 国家药典委员会.中华人民共和国药典(一部).北京:中国医药科技出版社, 2010: 263-264.
2 潘胜利,顺庆生,柏巧明,等.中国药用柴胡原色图志.上海:上海科学技术文献出版社, 2002: 9.
3 四川省食品药品监督管理局.四川省中药材标准.成都:四川科学技术出版社, 2010: 250-253.
4 马逾英,卫莹芳,万德光.川产柴胡地上部分的理化鉴定.成都中医药大学学报, 1999, 22(12): 30-31.
5 闫婕,卫莹芳,古锐,等. HPLC测定4种川产柴胡地上与地下部分柴胡皂苷a,c,d的含量.中国实验方剂学杂志, 2014, 20(13): 73-76.
6 闫婕,卫莹芳,古锐.应用自动质谱退卷积定性系统(AMDIS)和保留指数分析马尔康柴胡地上、地下部分与北柴胡挥发油的成分差异.中国中药杂志, 2014, 39(6): 1048-1053.
7 刘学伟,曹敏,刘树民.龙胆碱的解热作用及机制研究.中国实验方剂学杂志, 2011, 17(24): 128-131.
8 陈健,常秀娟,陈春苗,等.热毒宁注射液解热镇痛作用研究.世界科学技术-中医药现代化, 2014, 16(9): 1912-1915.
9 林兴,黄权芳,张士军,等.山芝麻对CCl4诱导小鼠肝损伤的脂质过氧化反应的影响.中国实验方剂学杂志, 2010, 16(10): 147-149.
10 王宪龄,李伟,刘方洲,等.柴胡黄芩配伍对CCl4所致小鼠急性肝损伤的研究.中药药理与临床, 2005, 21(6): 11-13.
11 闫冰,蔡秀江,姚卫峰,等.二至丸保肝活性成分群对CCl4致小鼠急性肝损伤保护作用研究.中国中药杂志, 2012, 37(9): 1303-1306.
12 李霞,门九章,梁锐,等.雄芍汤保肝降酶及抗氧化有效部位的研究.世界科学技术-中医药现代化, 2014, 16(4): 774-779.
13 孙蓉,黄幼异,黄伟,等.基于能量代谢机制的柴胡总皂苷对小鼠肝毒性“量-时-毒”关系研究.中药药理与临床, 2012, 28(4): 60-62.
14 黄伟,赵燕,孙蓉.基于柴胡皂苷类成分的保肝作用与肝毒性研究进展.中国药物警戒, 2011, 8(1): 38-41.
15 闫婕.马尔康柴胡不同部位药用价值评价研究.成都:成都中医药大学博士学位论文, 2014: 10-14.
Antipyretic and Hepatoprotective Effects and Acute Toxicity of the Roots and Acrial Part of Bupleunum Malconense
Yan Jie, Wei Yingfang, Long Fei, Lin Bo, Kang Min
(The Ministry of Education Key Laboratory of Standardization of Chinese Herbal Medicine, Key Laboratory of Systematic Research, Development and Utilization of Chinese Medicine Resources in Sichuan Province--Key Laboratory Breeding Base of Co-Founded by Sichuan Province and MOST, Pharmacy College, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China)
This study aimed to provide a scientific basis on the safety and efficacy of Bupleuri Herba in Sichuan for clinical use, and lay a fundation for its development and utilization and the evaluation of medicinal value of other plants belonging to Bupleuri. The febril rats were induced by yeast, and core temperature was tested. Hepatic injury model was established using CCl4injection. Enzyme standard instrument was used for detecting the indexes of liver function, including serum glutamic-oxaloacetic transaminase (GOT), glutamic-pyruvic transaminase (GPT) and malondialdehyde (MDA) and glutathione (GSH) from liver tissue. Combining with microscopic observation of liver tissue sections stained by HE staining and the related analysis, antipyretic and hepatoprotective effects of the roots and acrial part of B. malconense were explored. At last, acute toxicity test was also adopted. It was found that the core temperature of rats in the high- and low-dose B. malconense (acrial part) groups and in the high-dose B. malconense (roots) group significantly reduced 2 h after modeling, compared with the model group. 4 h after modeling, the core temperature of rats in the high-dose B. malconense (acrial part) group was also higher than that in the model group. Serum GOT, GPT and MDA levels and hepatic GSH level of hepatic injury rats increased, treated with water extracts of the roots and acrial parts of B. malconense. Morphologic observation showed that hepatic injury occurred on the 2ndday of administration, while the situation of hepatic injury presented undifferentiated compared with that in the control group on the 6thand 14thday of administration. In addition, there was a reversible liver acute toxicity in maximum doses. According to these results, it was demonstrated that the pharmacological effects of B. malconense was consistent with the traditional efficacy of Radix Bupleuri, presenting its medicinal value. However, its “dose-effect-toxicity” relationship still needs to be explored profoundly.
Bupleunum malconense, Bupleuri Herba, antipyresis, hepatoprotection, acute toxicity
10.11842/wst.2016.08.021
R285
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-04-18
修回日期:2016-05-20
* 国家自然科学基金委青年科学基金项目(81503200):基于肝细胞色素P450酶表达调控的竹叶柴胡“疏肝解郁”物质基础及机理研究,负责人:闫婕;成都中医药大学校级项目(030029056):不同产地“竹叶柴胡”的品质评价研究,负责人:闫婕。
** 通讯作者:卫莹芳,教授、博士生导师,主要研究方向:中药品种、质量及资源研究。

