狼尾草根系对阿特拉津长期胁迫的氧化应激响应
马兵兵,姜昭1,,Kehinde Olajide Erinle,曹博,李金梅,陈玉坤,张颖,*
1. 农业部产地环境质量重点实验室/天津市农业环境与农产品安全重点实验室,天津 300191 2. 东北农业大学资源与环境学院,哈尔滨 150030
狼尾草根系对阿特拉津长期胁迫的氧化应激响应
马兵兵2,姜昭1,2,Kehinde Olajide Erinle2,曹博2,李金梅2,陈玉坤2,张颖2,*
1. 农业部产地环境质量重点实验室/天津市农业环境与农产品安全重点实验室,天津 300191 2. 东北农业大学资源与环境学院,哈尔滨 150030
通过盆栽实验研究了抗性植物狼尾草根部丙二醛(MDA)、脯氨酸(Pro)、抗坏血酸(AsA)含量及超氧化物歧化酶(SOD)、谷胱甘肽还原酶(GR)等氧化应激生理指标对不同浓度阿特拉津长期(48 d)胁迫的响应规律。结果表明:当阿特拉津胁迫浓度分别高于20 mg·kg-1和50 mg·kg-1时,狼尾草根系的MDA与Pro含量较对照组显著升高(P < 0.05);随着阿特拉津胁迫浓度的增加,狼尾草根部SOD和GR活性呈先升高后降低的趋势,其中当阿特拉津胁迫浓度为20 mg·kg-1时,SOD和GR活性达到最大值;供试植物根系中AsA含量与阿特拉津胁迫浓度呈正相关。综上,中低浓度(≤ 20 mg·kg-1)阿特拉津处理没有对狼尾草的根系产生明显的氧化胁迫效应,狼尾草根系的上述抗氧化应激生理指标对于发挥阿特拉津抗性起着重要的作用。
阿特拉津;狼尾草;根系;氧化应激;长期胁迫
阿特拉津(2-氯-4-乙氨基-6-异丙氨基-1, 3, 5-三嗪)是一种三嗪类除草剂,别名莠去津,从1959年投产并推广以来[1],至今已有57年的使用历史。其主要施用于玉米、甘蔗、高粱、茶园和果园等地,可防除1年生禾本科杂草和阔叶杂草,对某些多年生杂草也有较好的抑制作用[2],因此其使用量每年正以20%的速率在递增[3]。阿特拉津水溶性相对较强,其容易在雨水、灌溉水的作用下从土壤中迁移到地表水和地下水中,由于其结构较为稳定,可在生态环境中长期存在。有数据显示:阿特拉津在水中的半衰期为42 d,而在土壤中的半衰期大约为382~742 d[4]。除具有上述迁移性与长残留特性外,阿特拉津也具有一定的生物毒性。EL-Sheekh等[5]研究表明:当水体中阿特拉津的污染浓度达到15 μmol·L-1时,小球藻的生长即受到抑制。此外,其他的毒性试验也表明,阿特拉津暴露与哺乳动物肿瘤的发生有一定的关系[6],会干扰内分泌水平,导致肝癌等[7-8]。因此,阿特拉津对生态环境及各类生物健康所构成的威胁已引起人们的广泛关注。近年来,有关阿特拉津对植物的毒理效应与相关机制的研究结果表明,阿特拉津胁迫可显著的增加敏感植物体内自由基的数量。由于上述敏感植物体内过多的自由基不能及时被清除,因此导致敏感植物膜脂过氧化水平加剧,细胞膜的完整性遭到破坏、细胞质交换平衡被打破,抑制植物的光合作用,进而使敏感植物的一系列的生理生化代谢发生紊乱,最终使植物的生长受到抑制[9-12]。
当植物处于逆境条件时,会通过体内的一些代谢反应应答来降低或修复逆境造成的损伤,这种反应被认为是抗性植物耐受逆境胁迫的重要生理生化机制[13]。抗坏血酸作为一种非酶促小分子抗氧化剂,与其他小分子抗氧化剂和抗氧化酶(超氧化物歧化酶(SOD)、谷胱甘肽还原酶(GR)等)共同调节着植物细胞内的活性氧水平,在对环境氧化胁迫响应的过程中起着至关重要的作用。同时,抗氧化剂数量及抗氧化酶活性的增加可以增强植物的抗逆性[14]。脯氨酸是植物在逆境胁迫条件下体内所积累的代谢产物,积累的脯氨酸除了作为植物细胞质内渗透调节物质外,还可以稳定生物大分子结构、降低细胞酸性,在一定程度上能够提升植物对于逆境环境胁迫的耐受能力[15]。
狼尾草为多年生禾本科狼尾草属,其具有株形优美、花序美丽、适应性强、根系发达、耐干旱等特点[16-17]。已有研究表明:只有在阿特拉津短期(28 d)胁迫下且浓度高于50 mg·kg-1处理,狼尾草生长及典型生理指标才逐渐受到显著影响[18]。此外,与苏丹草和黑麦草相比,狼尾草能够快速降解其根际土壤中的阿特拉津。因此,狼尾草具有较强的修复阿特拉津污染土壤的潜在优势[19]。然而,包括狼尾草在内的大多数抗性植物在修复污染土壤过程中均需与供试土壤中的污染持续接触,因此深入探讨污染物长期胁迫下抗性植物的生理响应对于更好地揭示植物修复机理尤为重要。目前,有关狼尾草在阿特拉津长期胁迫下的抗逆境生理指标研究的报道尚未明确。针对上述科学问题,本研究将着重考察阿特拉津长期胁迫条件下狼尾草根系典型氧化应激指标,如丙二醛、游离脯氨酸含量,抗氧化酶(SOD、GR)活性、非酶物质(AsA)含量等的响应规律,以期进一步的完善狼尾草耐受阿特拉津胁迫的相关理论。
1 材料与方法(Material and methods)
1.1 试验材料
试验所采用的供试植物为狼尾草属中的美洲狼尾草P. americanum L. (cv. K. Schum),供试植物种子购自江苏兴隆种子公司。阿特拉津原药(纯度≥ 97%)由山东农药研究所提供。盆栽试验所需土壤样品采自黑龙江省阿城区舍利屯玉米地耕层(0~20 cm),供试土壤中检测无阿特拉津残留。供试土壤(按质量比土壤∶蛭石=3∶1混合而成)的理化性质如表1所示。
1.2 试验处理与幼苗培养
供试狼尾草种子在室温条件下经蒸馏水浸泡4 h后,再用30%(V/V)H2O2溶液消毒处理10 min后将种子在恒温气候箱暗培养的条件下萌发过夜。将阿特拉津-丙酮溶液与适量的供试土壤搅拌均匀,使供试土壤中阿特拉津的终浓度分别为0、5、10、20、50、100、200 mg·kg-1。静置于通风厨内待丙酮挥发完毕后,上述各阿特拉津添加浓度处理的供试土壤平均分装于3个小型花盆中(即每个处理设置3个平行,每盆500 g供试土壤)开展后续盆栽试验。选择发芽一致的狼尾草种子播种于上述含有不同浓度梯度的阿特拉津土壤中,每盆20颗,并置于东北农业大学园艺站温室内进行培养,温度为(27±1) ℃/(20±1) ℃(日/夜)。幼苗培养过程中,每天观察盆栽土壤的水分含量,通过称重法添加补充适宜体积的Hoagland营养液[20]使上述盆栽土壤的含水量维持在土壤田间最大持水量的60%左右。于培养48 d后收获狼尾草植株的根系用于测定其丙二醛(MDA)、游离脯氨酸(Pro)、抗坏血酸(AsA)含量及超氧化物歧化酶(SOD)、谷胱甘肽还原酶(GR)活性。
1.3 测定指标及方法
提取液的制备采用周启星等[21]所使用的方法,即称取0.3 g鲜狼尾草根,加入50 mmol·L-1预冷的磷酸缓冲液(pH 7.8),研磨,定容至5 mL。4 ℃、10 000 g离心10 min,上清液用于测定MDA含量、SOD活性和GR活性。
MDA含量的测定采用硫代巴比妥酸法[22],单位为mmol·g-1FW。
SOD活性采用NBT还原法进行测定[23],在560 nm处测定吸光度,单位为U·g-1FW·min-1。
GR活性参考Foster and Hess[24]使用的方法进行测定,反应混合液包括1 mL的磷酸缓冲溶液,15 mmolL-1乙二胺四乙酸二钠0.1 mL,10 mmolL-1叠氮化钠0.1 mL,6.3 mmolL-1氧化型谷胱甘肽0.1 mL和0.1 mL的酶液并且用蒸馏水定容到2 mL,试管保温3 min并且添加0.1 mL的还原型辅酶II,在340 nm测定2 min内吸光度的减少量来衡量酶活性的大小,单位为U·mg-1FW。
Pro含量的测定采用酸性茚三酮染色法[25],称取鲜狼尾草根0.3 g,加入质量分数为3%磺基水杨酸5 mL,在沸水浴中提取10 min,冷却至室温。吸取2 mL上述提取液,加入2 mL冰醋酸及2 mL质量分数为2.5%的酸性茚三酮,于沸水浴中加热30 min,冷却后加5 mL甲苯充分振荡,以萃取红色物质,静止分层取上清液。在520 nm处测定吸光度,单位为μg·g-1FW。
AsA含量的测定,狼尾草根采用液氮速冻后,使用质量分数为6%的三氯乙酸(TCA)迅速研磨成匀浆定容至25 mL,离心后取上清液用于测定AsA含量。测定过程参照Hodges等[26]报道的方法,在525 nm测定吸光度,单位为μg·g-1FW。
1.4 数据分析
本试验结果数据均以平均值±标准差(mean ± SD)的形式表示。运用SPSS 19.0软件进行方差分析,利用Duncan方法对不同处理间的数据进行显著性分析(P < 0.05)。采用Origin 9.0软件作图。
2 结果与分析(Results and analysis)
2.1 阿特拉津长期胁迫对狼尾草根系丙二醛(MDA)含量的影响
阿特拉津长期(48 d)胁迫条件下狼尾草根系MDA含量的变化情况如图1所示。结果表明:随着阿特拉津浓度的增加,供试植物狼尾草根系MDA含量呈现先升高后降低的趋势,其中阿特拉津浓度为100 mg·kg-1时处理样品根系中MDA含量最大。此外,阿特拉津浓度为50~200 mg·kg-1时处理样品根系中MDA含量较空白处理及其他低浓度(< 50 mg·kg-1)处理显著升高(P < 0.05)。
2.2 阿特拉津长期胁迫对狼尾草根系脯氨酸(Pro)含量的影响
不同浓度阿特拉津胁迫条件下供试植物根系Pro含量的变化情况如图2所示。结果表明:随着阿特拉津胁迫浓度的增加,狼尾草根系Pro含量呈逐渐升高的趋势,即Pro含量变化与阿特拉津胁迫浓度呈显著正相关(表2)。此外,阿特拉津胁迫浓度为100 mg·kg-1和200 mg·kg-1时处理样品根系中Pro含量较对照组及其他低浓度(< 50 mg·kg-1)组相比显著升高(P < 0.05)。

表1 供试土壤的理化性质Table 1 The physical and chemical properties of the test soil
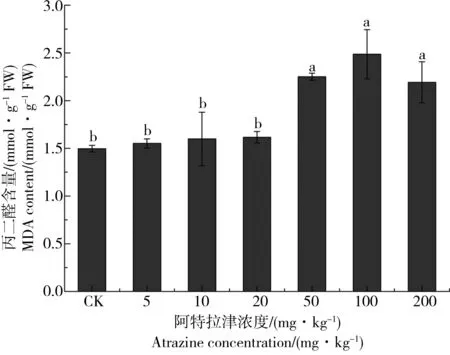
图1 阿特拉津长期胁迫对狼尾草根系丙二醛(MDA)含量的影响注:不同小写字母表示处理组与对照之间的显著性差异,P < 0.05,n=3。Fig. 1 Effect of long term atrazine exposure on malonaldehyde (MDA) content in root of P. americanum seedlingsNote: Different lower-case letters represent significant differences between the control and atrazine treatment, P < 0.05, n=3.
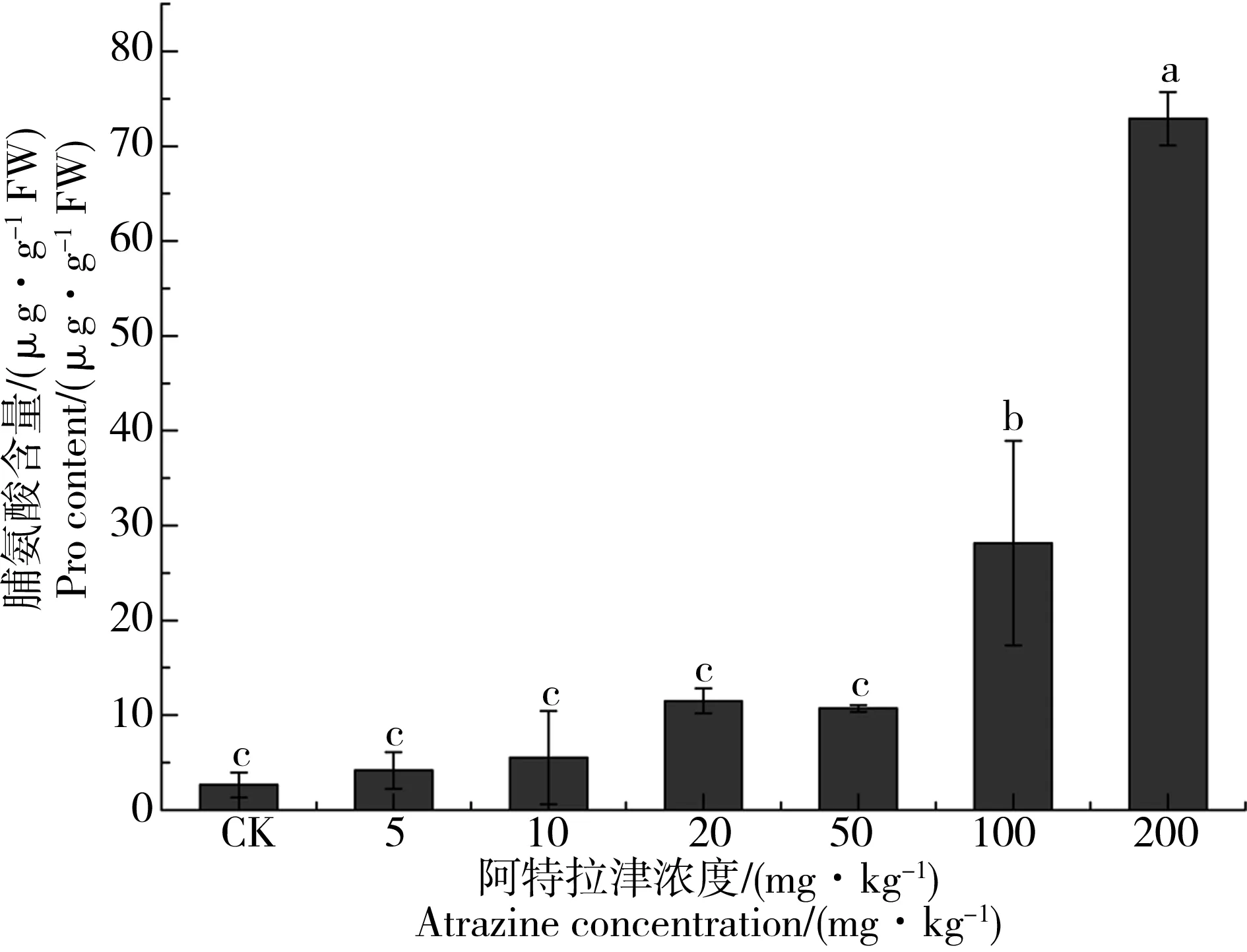
图2 阿特拉津长期胁迫对狼尾草根系脯氨酸(Pro)含量的影响注:不同小写字母表示处理组与对照之间的显著性差异,P < 0.05,n=3。Fig. 2 Effect of long term atrazine exposure on proline (Pro) content in root of P. americanum seedlingsNote: Different lower-case letters represent significant differences between the control and atrazine treatment, P < 0.05, n=3.
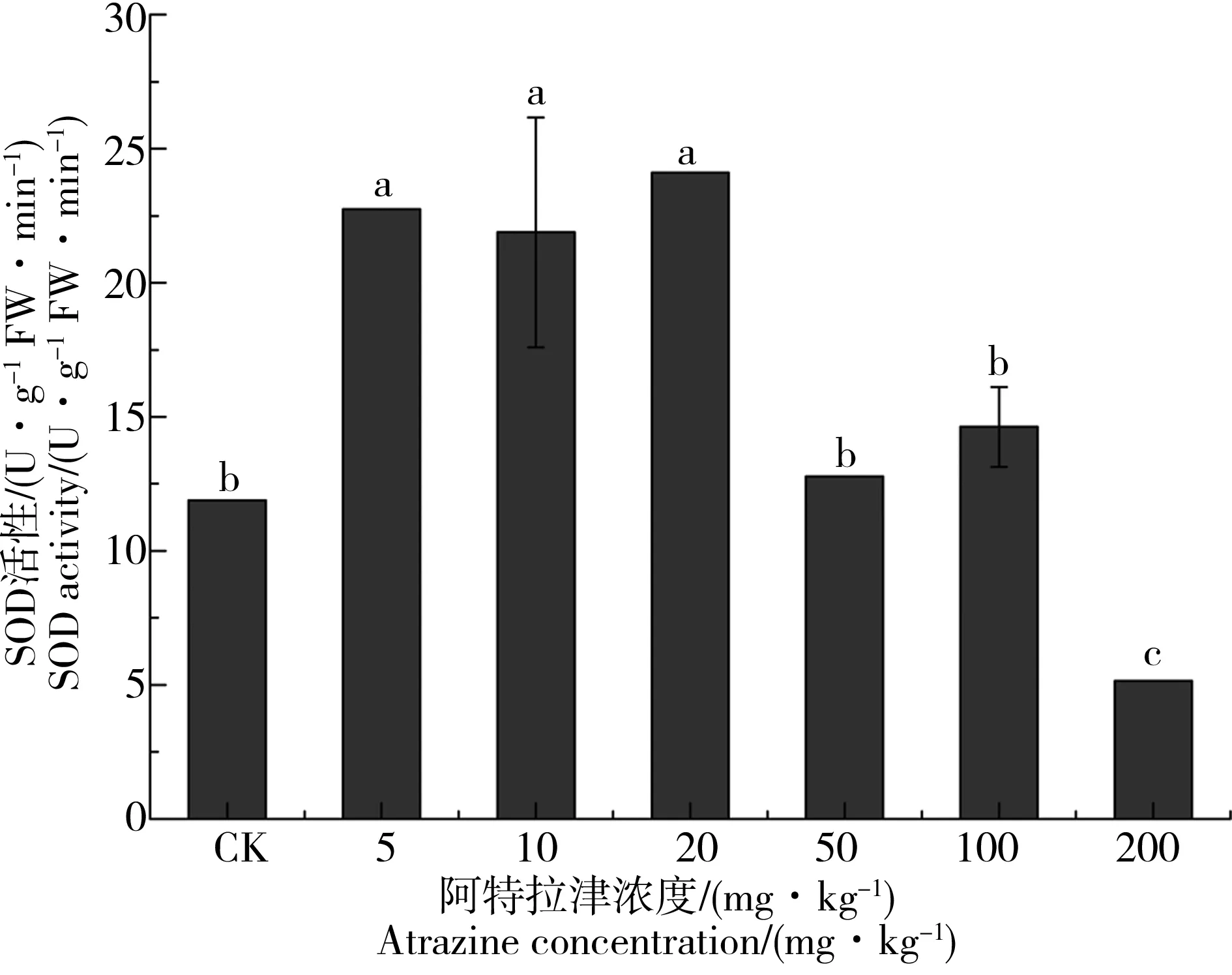
图3 阿特拉津长期胁迫对狼尾草根系超氧化物歧化酶(SOD)活性的影响注:不同小写字母表示处理组与对照之间的显著性差异,P < 0.05,n=3。Fig. 3 Effect of long term atrazine exposure on superoxide dismutase (SOD) activity in root of P. americanum seedlingsNote: Different lower-case letters represent significant differences between the control and atrazine treatment, P < 0.05, n=3.
2.3 阿特拉津长期胁迫对狼尾草根系超氧化物歧化酶(SOD)活性的影响
供试植物狼尾草根系SOD活性在不同浓度阿特拉津长期胁迫条件下的变化趋势如图3所示。随着阿特拉津胁迫浓度的增加,各试验处理样品根系中SOD活性呈现先升高后降低的趋势。中低浓度(5~20 mg·kg-1)阿特拉津胁迫处理使狼尾草根系中的SOD活性较对照组明显提升,其中阿特拉津胁迫水平为20 mg·kg-1时处理样品根系SOD活性最大。伴随着胁迫浓度的继续升高,供试植物根系SOD活性逐渐降低,200 mg·kg-1阿特拉津处理样品的SOD活性降至最低并明显低于对照组。上述结果说明阿特拉津对狼尾草根部SOD活性的影响呈现“低浓度促进高浓度抑制”的规律。
2.4 阿特拉津长期胁迫对狼尾草根系谷胱甘肽还原酶(GR)活性的影响
供试植物种植48 d后,各污染胁迫处理条件下,其根中GR活性变化如图4所示。0~20 mg·kg-1阿特拉津处理条件下,狼尾草根系GR活性保持在7.38~7.58 U·mg-1FW之间,差异不明显。随着阿特拉津胁迫浓度进一步增加(50~200 mg·kg-1),狼尾草根系GR活性开始降低,保持在6.04~5.36 U·mg-1FW之间。尽管高浓度(50~200 mg·kg-1)阿特拉津处理在一定程度上会抑制狼尾草根部GR活性,但上述抑制程度均未达到显著差异水平。
2.5 阿特拉津长期胁迫对狼尾草根系抗坏血酸(AsA)的影响
供试植物狼尾草根系AsA含量对不同浓度阿特拉津长期(48 d)胁迫的响应规律如图5所示。与空白处理相比,低浓度(5~10 mg·kg-1)阿特拉津胁迫会使狼尾草根部AsA含量降低,伴随着胁迫浓度的继续增加,供试植物根系AsA的含量开始持续增加,当阿特拉津胁迫浓度为200 mg·kg-1时其含量达到最高值。
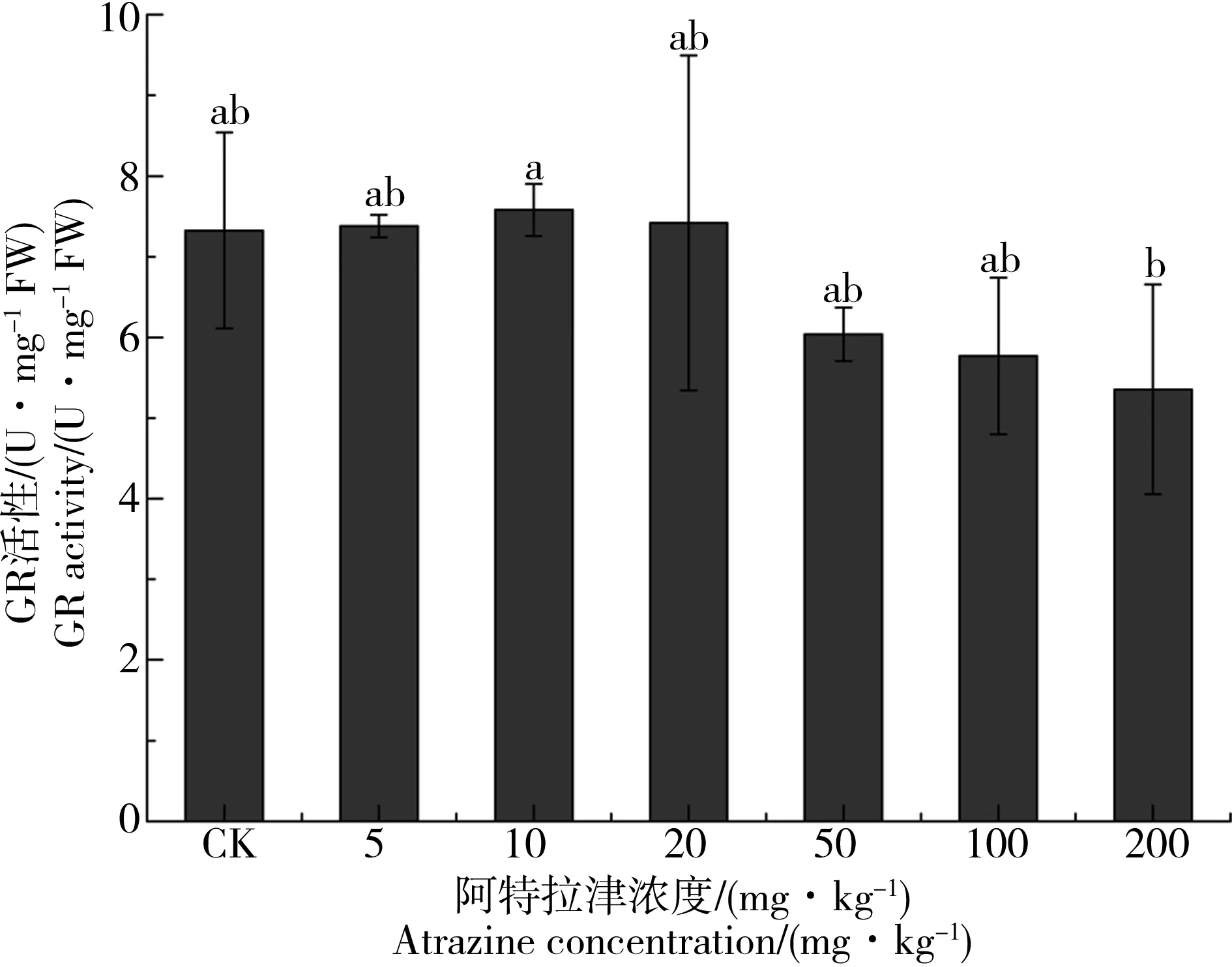
图4 阿特拉津长期胁迫对狼尾草根系谷胱甘肽还原酶(GR)活性的影响注:不同小写字母表示处理组与对照之间的显著性差异,P < 0.05,n=3。Fig. 4 Effect of long term atrazine exposure on glutathione reductase (GR) activity in root of P. americanum seedlingsNote:Different lower-case letters represent significant differences between the control and atrazine treatment, P < 0.05, n=3.
3 讨论(Discussion)
MDA是超氧自由基氧化生物膜时(膜质过氧化过程)所形成的产物,因此,其含量被认为是一种能够很好地反映细胞膜被氧化损伤程度的指标[27]。研究发现,当狼尾草暴露在浓度为50 mg·kg-1的阿特拉津中时,其根系MDA含量较对照组相比显著增加,说明上述胁迫水平可引起狼尾草根系细胞膜氧化损伤。结合我们前期研究[19]所观察到的结果(浓度为100 mg·kg-1的阿特拉津处理才会使狼尾草叶片中MDA含量明显增加)可以发现:狼尾草根系对阿特拉津较叶片相比更为敏感。分析其原因可能是由于狼尾草的根系是直接接触并吸收阿特拉津的器官,故而根系受阿特拉津的影响较大。另有研究表明,一些抗性植物在适宜浓度(抗性范围内)重金属[28]、除草剂[14]等污染物胁迫下,其体内MDA含量能够维持在比较稳定的水平。本研究结果与上述研究相吻合,即供试植物狼尾草经中低浓度(≤ 20 mg·kg-1)阿特拉津胁迫48 d后,其根系MDA含量较空白组相比仅表现为轻微升高,并未达到显著差异水平,说明该污染胁迫水平并未对狼尾草根系造成明显的氧化损伤。这可能与中低浓度阿特拉津胁迫激活了狼尾草根系的抗氧化防御系统或提高了细胞内的渗透压调节物质有关。

图5 阿特拉津长期胁迫对狼尾草根系抗坏血酸(AsA)含量的影响注:不同小写字母表示处理组与对照之间的显著性差异,P < 0.05,n=3。Fig. 5 Effect of long term atrazine exposure on ascorbic acid (AsA) content in root of P. americanum seedlingsNote: Different lower-case letters represent significant differences between the control and atrazine treatment, P < 0.05, n=3.
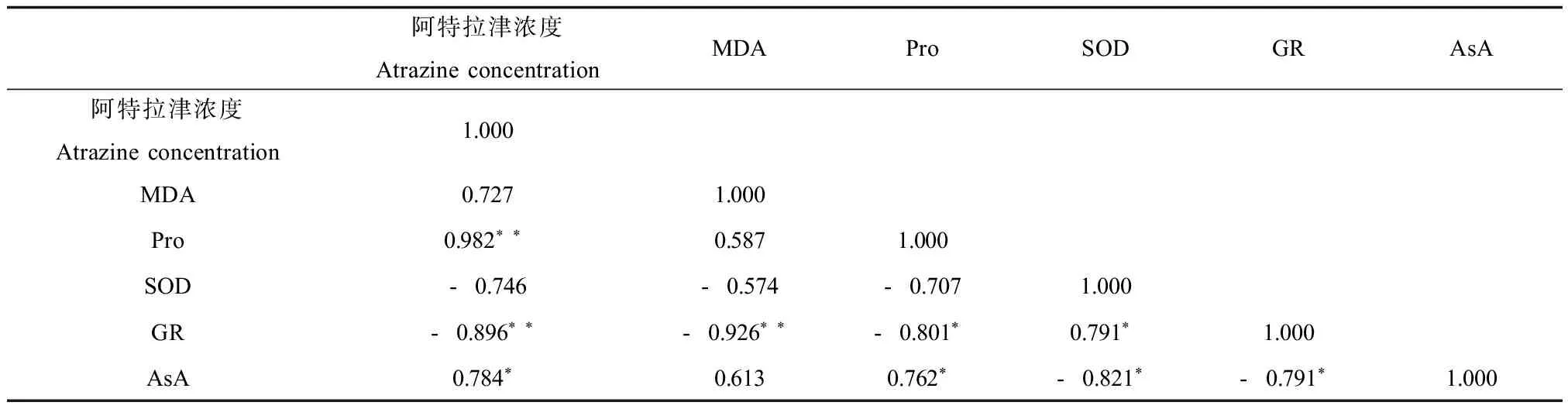
表2 MDA、Pro、AsA含量、SOD、GR活性,阿特拉津浓度之间相关性分析Table 2 Correlation analysis among MDA, Pro, AsA content, SOD, GR activity and atrazine concentration
注:*表示在0.05水平上显著相关;**在0.01水平上显著相关。
Note: * represent significant correlations at P < 0.05;**represent significant correlations at P < 0.01.
植物在非生物胁迫条件下会通过增加其体内脯氨酸含量来调节细胞渗透压,清除活性氧自由基,缓解氧化还原电位升高等保持膜的完整性以及抗氧化酶和蛋白质的稳定性等,最终使其耐受逆境环境胁迫[29]。此外,已有报道证实,在环境胁迫下[30]植物体内积累的脯氨酸与环境胁迫的抗逆性有关,如水稻在缺水的条件下其叶片中脯氨酸浓度会大量增加[31]。本研究结果发现,狼尾草根系中的脯氨酸含量随着阿特拉津胁迫浓度的增加呈逐渐升高的趋势,说明供试植物所承受的污染胁迫程度在不断地升高,这一研究结果与焦树英等[32]、张怀山等[33]对狼尾草研究的结果相吻合。基于上述研究结果分析认为:狼尾草在中低浓度(0~50 mg·kg-1)阿特拉津胁迫下可通过增加其体内脯氨酸含量来使细胞质浓度增大或激活具有自由基清除作用的抗氧化防御系统,抵御阿特拉津胁迫对其造成的氧化损伤。
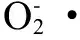
谷胱甘肽还原酶(GR)也是植物体内一种重要的抗氧化酶类,其主要的生理功能是将氧化型谷胱甘肽(GSSG)还原成还原型谷胱甘肽(GSH),进而为活性氧的清除提供还原力,保护植物免受伤害[38]。同时,GR作为抗氧化酶类参与植物抗坏血酸谷胱甘肽循环并与SOD等酶相互作用,降低植物体内过量的活性氧,从而保护植物免受氧化胁迫的伤害[38-39]。本研究结果发现:供试植物根系的GR活性与SOD活性呈显著正相关,与AsA含量呈显著负相关(如表2),这一结果充分说明GR、SOD活性与AsA含量间存在着密切的关系,在保护狼尾草根系耐受阿特拉津胁迫方面发挥重要作用。试验结果表明在不同浓度阿特拉津胁迫下狼尾草根系GR活性变化遵循着先升高后降低的变化趋势,分析认为狼尾草根系GR活性的升高是供试植物主动防御一定水平(≤ 20 mg·kg-1)阿特拉津胁迫的表现。这一机制与很多研究发现相类似,如Kornyeyev等[40]研究棉花在低温胁迫下通过增加叶绿体GR活性来使植物叶片光化学比率增加从而减轻植物的氧化胁迫。Aghaei等[41]的研究结果也表明耐盐土豆中GR活性要比盐敏感土豆中GR活性高。
除了上述抗氧化酶系统在减轻活性氧对植物细胞膜及胞内生物大分子伤害方面发挥作用外,一些非酶促小分子抗氧化物质在上述胁迫防御方面也起到重要作用。抗坏血酸(AsA)作为一种小分子抗氧化剂能够参与植物体系活性氧的代谢过程,同时也对植物体内的抗氧化酶具有一定的调节作用,进而有效地增强植物在逆境环境胁迫下的抗逆能力[14,42]。本研究发现,供试植物根系AsA含量与阿特拉津胁迫浓度呈显著正相关(表2),说明根系AsA在面对不同浓度阿特拉津胁迫水平时能够灵敏有效地进行应答。此外,相关性分析表明:供试植物根系AsA含量与GR活性呈显著的负相关(表2),说明狼尾草根系中的AsA在阿特拉津污染胁迫时与抗氧化酶之间存在着较为密切的联系。基于相关报道与研究结果,可以推测狼尾草根系内的上述非酶促小分子抗氧化物质与抗氧化酶类物质联合作用在维持其阿特拉津抗性方面发挥一定的作用。
表2中的数据表明:膜质过氧化产物MDA含量与阿特拉津浓度呈正相关,同时MDA含量与SOD、GR活性存在明显的负相关,与Pro、AsA含量呈正相关,说明本研究所探讨的几类生理指标能够有效地表征供试植物狼尾草根系暴露于不同浓度阿特拉津时所产生的氧化胁迫。另外,由于中低浓度水平(≤ 20 mg·kg-1)阿特拉津胁迫并未对供试植物根系造成显著的氧化损伤(表2),说明上述指标间的相关作用对于维持供试植物表现出一定的阿特拉津氧化胁迫防御能力也将发挥着一定的作用。
致谢:感谢农业部环境保护科研监测所省部级重点实验室开放基金对于本研究的资助。
[1] Solomon K R, Baker D B, Richards R P, et al. Ecological risk assessment of atrazine in north American surface waters [J]. Environmental Toxicology and Chemical, 1996, 15(1): 31-76
[2] Albright V C, Murphy I J, Anderson J A, et al. Fate of atrazine in switchgrass-soil column system [J]. Chemosphere, 2013, 90: 1847-1853
[3] 司友斌, 孟雪梅. 除草剂阿特拉津的环境行为及其生态修复研究进展[J]. 安徽农业大学学报, 2007, 34(3): 451-455
Si Y B, Meng X M. Advance in environmental fate and ecological remediation of the herbicide atrazine [J]. Journal of Anhui Agricultural University, 2007, 34(3): 451-455 (in Chinese)
[4] Su Y H, Zhu Y G, Lin A J, et al. Effects of exposure time and co-existing organic compounds on uptake of atrazine from nutrient solution by rice seedlings (Oryza sativa L.) [J]. Journal of Hazardous Materials, 2007, 141: 223-229
[5] El-Sheekh M M, Kotkat H M, Hammouda O H F. Atrazine herbicide on growth, photosynthesis, protein synthesis, and fatty acid composition in the uniceller green algae Chlorella kessleri [J]. Ecotoxicology and Environmental Safety, 1994, 29: 319-358
[6] Sathiakumar N, MacLennan P A, Mandel J, et al. A review of epidemiologic studies of triazine herbicides and cancer [J]. Critical Reviews in Toxicology, 2011, 41: 1-34
[7] Hayes T B, Collins A, Lee M, et al. Hermaphroditic,demasculinized frogs after exposure to the herbicide atrazine at low ecologically relevant doses [J]. Proceedings of the National Academy of Sciences, 2002, 99: 5476-5480
[8] Friedmann A S. Atrazine inhibition of testosterone production in rat males following prepubertal exposure [J]. Reproductive Toxicology, 2002, 16: 275-279
[9] 周启星, 王美娥. 土壤生态毒理学研究进展与展望[J]. 生态毒理学报, 2006, 1(1): 1-11
Zhou Q X, Wang M E. Researching advancement and prospect of soil ecotoxicology [J]. Asian Journal of Ecotoxicology, 2006, 1(1): 1-11 (in Chinese)
[10] Singh N, Megharaj M, Kookana R S, et al. Atrazine and simazine degradation in Pennisetum rhizosphere [J]. Chemosphere, 2004, 56(3): 257-263
[11] Wang M E, Zhou Q X. Effects of herbicide chlorimuron-ethyl on physiological mechanisms in wheat (Triticum aestivum) [J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 190-197
[12] Zhang J J, Lu Y C, Zhang J J, et al. Accumulation and toxicological response of atrazine in rice crops [J]. Ecotoxicology and Environmental Safety, 2014, 102: 105-112
[13] 张坤, 李元, 祖艳群, 等. 皇竹草活性氧代谢对阿特拉津胁迫的响应特征[J]. 西北植物学报, 2013, 33(12): 2479-2485
Zhang K, Li Y, Zu Y Q, et al. Response characteristics of reactive oxygen metabolism in Pennisetum hydridum to atrazine stress [J]. Acta Botanica Sinica, 2013, 33(12): 2479-2485 (in Chinese)
[14] Noctor G, Foyer C H. Ascorbate and glutathione: Keeping active oxygen under control [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49: 249-279
[15] 刘旻霞, 马建祖. 6种植物在逆境胁迫下脯氨酸的积累特点研究[J]. 草业科学, 2010, 27(4): 134-138
Liu M X, Ma J Z. Study on proline accumulation of patterns of six plant species under adversity stress [J]. Pratacultural Science, 2010, 27(4): 134-138 (in Chinese)
[16] Llewellyn L M, Jerry C L. Xeriscape ornamental perennial grass trial for low water use landscaping [J]. Annual Report, 2002, 2(1): 79-84
[17] 武菊英. 生态与观赏效果俱佳的狼尾草[J]. 中国花卉园艺, 2003, 21: 32
Wu J Y. Ecological and ornamental effect excellent of Pennisetum [J]. Chinese Flowers Gardening, 2003, 21: 32 (in Chinese)
[18] 马兵兵, 姜昭, 叶思源, 等. 狼尾草典型生理生化特征对阿特拉津胁迫的响应[J]. 农业环境科学学报, 2015, 34(11): 2083-2088
Ma B B, Jiang Z, Ye S Y, et al. Typical physiological and biochemical characteristics of Pennisetum americanum L. (cv. K. Schum) under atrazine stresses [J]. Journal of Agro-Environment Science, 2015, 34(11): 2083-2088 (in Chinese)
[19] Ma Y X, Zhang Y, Du J, et al. Research on three resistant plants remediating atropine contaminated soil [J]. Procedia Environmental Sciences, 2012, 12(Part A): 238-242
[20] Hoagland D R, Arnon D I. The water-culture method for growing plants without soil [J]. California Agricultural Experiment Station, 1938, 347: 1-39
[21] 孙约兵, 周启星, 王林, 等. 三叶鬼针草幼苗对镉污染的耐性及其吸收积累特征研究[J]. 环境科学, 2009, 30(10): 3028-3035
Sun Y B, Zhou Q X, Wang L, et al. Characteristics of cadmium tolerance and bioaccumulation of Bidens pilosa L. seedlings [J]. Environmental Science, 2009, 30(10): 3028-3035 (in Chinese)
[22] Chen Y S, Wu C F, Zhang H B, et al. Empirical estimation of pollution load and contamination levels of phthalate esters in agricultural soils from plastic film mulching in China [J].Environmental Earth Sciences, 2013, 70(1): 239-247
[23] Giannopolitis C N, Ries S K. Superoxide dismutases: I. Occurence in higher plants [J]. Plant Physiology, 1977, 59(2): 309-314
[24] Foster J G, Hess J L. Responses of superoxide dismutase and glutathione reductase activities in cotton leaf tissue exposed to an atmosphere enriched in oxygen [J]. Plant Physiology, 1980, 66(3): 482-487
[25] Shevyakova N I, Bakulina E A, Kuznetsov V V. Proline antioxidant role in the common ice plant subjected to salinity and paraquat treatment inducing oxidative stress [J]. Russian Journal of Plant Physiology, 2009, 56(5): 663-669
[26] Hodges D M, DeLong J M, Fomey C F, et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds [J]. Planta, 1999, 207(4): 604-611
[27] Chiang Y J, Wu Y X, Chiang M Y, et al. Role of antioxidative system in paraquat resistance of tall fleabane (Conyza sumatrensis) [J]. Weed Science, 2008, 56(3): 350-355
[28] 杨卫东, 陈益泰. 镉胁迫对旱柳细胞膜透性和抗氧化酶活性的影响[J]. 西北植物学报, 2008, 28(11): 2263-2269
Yang W D, Chen Y T. Membrane leakage and antioxidant enzyme activities in roots and leaves of Salix matsudana with cadmium stress [J]. Acta Botanica Sinica, 2008, 28(11): 2263-2269 (in Chinese)
[29] Ashraf M, Foolad M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance [J]. Environmental and Experimental Botany, 2007, 59: 206-216
[30] Petrusa L M, Winicov I. Proline status in salt-tolerant and salt-sensitive alfalfa cell lines and plants in response to NaCl [J]. Plant Physiology and Biochemistry, 1997, 35: 303-310
[31] Hsu S Y, Hsu Y T, Kao C H. The effect of polyethylene glycol on proline accumulation in rice leaves [J]. Biologia Plantarum, 2003, 46(1): 73-78
[32] 焦树英, 李永强, 沙依拉·沙尔合提, 等. 干旱胁迫对3种狼尾草种子萌发和幼苗生长的影响[J]. 西北植物学报, 2009, 29(2): 0308-0313
Jiao S Y, Li Y Q, Shayila S E H T, et al. Seeds germination and seedling growth about 3 pennisetum ornamental grasses under drought stress [J]. Acta Botanica Sinica, 2009, 29(2): 0308-0313 (in Chinese)
[33] 张怀山, 赵桂琴, 栗孟飞, 等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答[J]. 草业学报, 2014, 23(2): 180-188
Zhang H S, Zhao G Q, Li M F, et al. Physiological responses of Pennisetum longissimum var. intermedium seedlings to PEG, low temperature and salt stress treatments [J]. Acta Prataculturae Sinica, 2014, 23(2): 180-188 (in Chinese)
[34] Amor N B, Hamed K B, Debez A C, et al. Physiological and antioxidant responses of the perennial halophyte Crithmum maritimum to salinity [J]. Plant Science, 2005, 168(4): 889-899
[35] 刘慧芹, 韩巨才, 刘慧平, 等. 铅梯度胁迫对多年生黑麦草幼苗生理生化特性影响[J]. 草业学报, 2012, 21(6): 57-63
Liu H Q, Han J C, Liu H P, et al. Influence of lead gradient stress on the physiological and biochemical characteristics of perennial ryegrass (Lolium perenne) seedlings [J]. Acta Prataculturae Sinica, 2012, 21(6): 57-63 (in Chinese)
[36] 谢亚军, 王兵, 梁新华, 等. 干旱胁迫对甘草幼苗活性氧代谢及保护酶活性的影响[J]. 农业科学研究, 2008, 29(4):19-22
Xie Y J, Wang B, Liang X H, et al. Effect of drought stress on active oxygen metabolism and activities of protective enzymes of licorice seedlings [J]. Journal of Agricultural Sciences, 2008, 29(4): 19-22 (in Chinese)
[37] Ernst W, Doe K, Cook A, et al. Dispersion and toxicity to non-target crustaceans of azamethiphos and deltamethrin after sea lice treatments on farmed salmon, Salmo salar [J]. Aquaculture, 2014, 424-425: 104-112
[38] Scandalios J G. Oxidative stress: Molecular perception and transduction of signals triggering antioxidant gene defenses [J]. Brazilian Journal of Medical and Biological Research, 2005, 38: 995-1014[39] Foyer C H, Noctor G. Ascorbate and glutathione: The heart of the redox hub [J]. Plant Physiology, 2011, 155: 2-18
[40] Komyeyev D, Paxton R, Payton P R, et al. Elevated chloroplastic glutathione reductase activities decrease chilling-induced photoinhibition by increasing rates of photochemistry, but not thermal energy dissipation, in transgenic cotton [J]. Functional Plant Biology, 2003, 30(1): 101-110
[41] Aghaei K, Ehsanpour A A, Komatsu S. Potato responds to salt stress by increased activity of antioxidant enzymes [J]. Journal of Integrative Plant Biology, 2009, 51(12): 1095-1103
[42] Pastori G M, Kiddle G, Antoniw J, et al. Leaf vitamin C contents modulate plant defense transcripts and regulate genes that control development through hormone signaling [J]. Plant Cell, 2003, 15: 939-951
◆
Oxidative Stress Response in Root ofPennisetumamericanumL.(cv. K. Schum) to Long Term Atrazine Exposure
Ma Bingbing2, Jiang Zhao1,2, Kehinde Olajide Erinle2, Cao Bo2, Li Jinmei2, Chen Yukun2, Zhang Ying2,*
1. Key Laboratory of Original Agro-environment Quality of Ministry of Agriculture, Tianjin Key Laboratory of Agro-environment and Safe-product, Tianjin 300191, China 2. School of Resources & Environment, Northeast Agricultural University, Harbin 150030, China
Received 6 February 2016 accepted 1 June 2016
Pennisetum americanum L. ( cv. K. Schum) has been reported as a phytoremediator which exhibits tolerance to atrazine. Atrazine is a herbicide that can effectively control broadleaf and grass weeds, but its use also causes serious pollution issues. To evaluate the influence of atrazine stress on the tolerant plant, an experiment was conducted focusing on the response of malondialdehyde (MDA), proline (Pro), ascorbic acid (AsA) content, superoxide dismutase (SOD) and glutathione reductase (GR) activities in the root of P. americanum exposed to different concentrations of atrazine during a long-term (48 d) period. The results showed that MDA and Pro contents in the root of the plant increased significantly under atrazine concentrations above 20 mg·kg-1and 50 mg·kg-1, respectively, when compared with the control (P < 0.05). With the increase in atrazine concentration, SOD and GR activities in the root of P. americanum first increased and then decreased; their activities reached the maximum when exposed to 20 mg·kg-1atrazine. AsA content in the root of the test plant and atrazine concentration were positively correlated. The above results demonstrated that low atrazine concentrations (≤ 20 mg·kg-1) did not show significant oxidative stress effect on the root of P. americanum. Physiological response characteristics of the antioxidant defense system in the root of the test plant played an important role for atrazine tolerance.
atrazine; Pennisetum americanum L. ( cv. K. Schum); root; oxidative stress; long term stress
农业部环境保护科研监测所省部级重点实验室2015年度开放基金课题;国家自然科学基金(31300433);黑龙江省高校创新团队建设计划项目(2013TD003)
马兵兵(1989-),女,硕士研究生,研究方向为污染物生态毒理效应,E-mail:492912579@qq.com;
*通讯作者(Corresponding author), E-mail: zhangyinghr@hotmail.com
10.7524/AJE.1673-5897.20160206001
2016-02-06 录用日期:2016-06-01
1673-5897(2016)6-214-09
X171.5
A
张颖(1972—),女,工学博士,教授,主要研究方向为农业环境保护。
马兵兵, 姜昭, Kehinde Olajide Erinle, 等. 狼尾草根系对阿特拉津长期胁迫的氧化应激响应[J]. 生态毒理学报,2016, 11(6): 214-222
Ma B B, Jiang Z, Erinle K O, et al. Oxidative stress response in root of Pennisetum americanum L. (cv. K. Schum) to long term atrazine exposure [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 214-222 (in Chinese)

