苦荞多糖抗氧化及对Hep G2细胞增殖抑制作用
李姗姗,崔晓东,李晨,李玉英,王转花(化学生物学与分子工程教育部重点实验室,山西大学生物技术研究所,山西太原030006)
苦荞多糖抗氧化及对Hep G2细胞增殖抑制作用
李姗姗,崔晓东,李晨,李玉英,王转花*
(化学生物学与分子工程教育部重点实验室,山西大学生物技术研究所,山西太原030006)
摘要:采用热提取和Superdex G75分子排阻层析对苦荞多糖进行了提取及初步的分离纯化,通过紫外光谱扫描和聚丙烯酰胺凝胶电泳等方法鉴定多糖的纯度;纯化的苦荞多糖在体外检测其抗氧化能力及对Hep G2细胞增殖抑制作用。结果表明,制备的多糖纯度较高,不含核酸和蛋白质。用纯化的苦荞多糖在体外检测其抗氧化能力及其对Hep G2细胞增殖和细胞核的影响。结果表明,该多糖对羟基自由基有明显的清除作用,清除作用与浓度有一定的量效关系,EC50为0.17mg/mL,对Hep G2细胞增殖有明显的抑制作用,并可使细胞核形态出现聚缩,染色质DNA出现断裂。苦荞多糖的制备及其体外抑制肿瘤细胞的增殖等初步研究为深入考察其生物学活性奠定了基础。
关键词:苦荞;多糖;抗肿瘤;羟自由基
多糖(polysaccharide)是由多个单糖分子缩合经糖苷键连接而成的一类分子结构复杂且分子量庞大的聚糖类物质。多糖及其复合物在高等动植物的细胞膜和微生物细胞壁中含量非常丰富,对维持生命活动起着至关重要的作用。近年来,由于天然多糖具有抗肿瘤、抗病毒、抗衰老、降血糖、调节免疫等多种生物活性,毒副作用小等优点,对天然多糖的研究及开发呈现逐渐增多的趋势[1]。近期研究表明,多种不同来源的多糖具有明显的抗肿瘤效应。芦荟多糖能激活巨噬细胞,增加一氧化氮合酶mRNA的表达进而增加NO的合成,刺激巨噬细胞表面分子的表达,发挥其抗肿瘤的活性[2]。枸杞多糖可提高H22荷瘤小鼠的T淋巴细胞转化能力和人体自然杀伤细胞(NK细胞)活性,同时显著提高SOD含量降低MDA含量,表明枸杞多糖的抗肿瘤机制可能与其增强机体免疫力和提高机体的抗氧化活性有关[3]。银耳中的酸性多糖能提高机体免疫力,且具有抗肿瘤作用[4]。此外,铁筷子,南瓜,银杏等其它的植物多糖也具有明显的抗肿瘤效应[5-6]。
荞麦为蓼科荞麦属植物,营养及药用价值较高,是一种古老的药食同源性植物[7]。荞麦,尤其苦荞麦,含有丰富的黄酮类物质,具有抗氧化、降血糖,降血脂、防止DNA损伤等多种生理功能[8],对糖尿病、高血脂、冠心病、中风等病症有一定的预防作用,逐渐引起人们的关注。作为荞麦中主要功能物质的多糖能显著地清除超氧阴离子自由基和羟基自由基,但是荞麦多糖抑制肿瘤增殖的报道较少,仅见于台湾学者报道荞麦多糖可通过诱导人THP-1白血病细胞分化从而抑制其增殖[9]。
为了拓宽药食同源作物-荞麦的基础和应用研究范围,揭示荞麦多糖在抗病、抗衰老及其抑制肿瘤细胞的增殖等方面的作用,本试验以山西黑苦荞为原料,采用热提取和Superdex G 75分子排阻层析对苦荞多糖进行了提取及初步分离纯化,并采用分子排阻层析对获得的粗品进行纯化,初步研究了苦荞麦多糖在体外对·OH自由基的清除作用及抗肿瘤效应,为荞麦功能性保健食品的开发研究提供一定依据。
1材料与方法
1.1材料与试剂
山西黑苦荞:山西省农业科学院农作物品种资源研究所提供;人肝癌细胞株Hep G2:中国科学院细胞资源中心;胰蛋白酶(trypsin)、二甲基亚砜(DMSO):Solarbio公司;DMEM培养基:美国Hyclone;胎牛血清:杭州四季青公司;其它试剂均为国产分析纯。
1.2仪器与设备
CO2细胞培养箱:美国Thermo公司;AKTA explorer蛋白纯化系统:美国GE公司;FV1000激光共聚焦显微镜:日本OLYMPUS公司;酶联免疫检测仪:美国BIO-RAD公司。
1.3方法
1.3.1苦荞多糖的提取和纯化
将苦荞种子粉碎,去壳,过40目筛,得到苦荞粉。经丙酮浸泡、脱脂,除去色素、小分子糖等物质,残渣晾干备用。称取20 g脱脂苦荞粉,加入500 mL去离子水,90℃提取4 h,离心取上清。将沉淀再次加入去离子水,重复上述提取步骤。合并两次提取的上清液,对上清进行减压浓缩至体积约100 mL,加入4倍体积95 %乙醇,4℃过夜沉淀。离心取沉淀,用少量水溶解。将溶解的沉淀用Sevag法除蛋白[10],重复3次,冷冻干燥后得到苦荞粗多糖。准确称取1 mg多糖粗品,加入1 mL去离子水,充分溶解后取0.5 mL上样到Superdex G 75 HR 10/300凝胶柱,以10 mmol/L Tris-HCl缓冲液洗脱,控制流速为0.5 mL/min,280 nm波长下检测多糖样品中蛋白的含量。同时将样品收集到不同的EP管中,每管收集1 mL,用苯酚硫酸法测定多糖的含量,跟踪多糖含量的变化。
1.3.2多糖的纯度测定
取适量凝胶层析后的苦荞多糖溶液采用紫外扫描法在200 nm~500 nm波长下进行紫外光谱扫描,检测其在260 nm及280 nm处的吸收情况,从而判定多糖的纯度。同时采用SDS-PAGE法检测蛋白质的残留量。以标准分子质量蛋白为对照,在4 %浓缩胶和12.5 %分离胶中电泳,考马斯亮蓝R-250染色。
1.3.3苦荞多糖对羟自由基(·OH)的清除作用
采用水杨酸氧化法[11],分别加入9 mmol/L FeSO4、9 mmol/L水杨酸-乙醇和不同浓度的待测液各1 mL,加入1 mL 8.8 mmol/L H2O2启动反应,37℃水浴反应0.5 h后,分别测定对照组和样品组在510 nm处的吸光度。按以下公式计算清除率。

式中:E为清除率,%;A0为对照组光吸收值;AX为样品组光吸收值;AX0为空白组光吸收值。
1.3.4苦荞多糖对Hep G2细胞增殖的影响
人肝癌细胞株Hep G2,在DMEM完全培养基(10 %胎牛血清,100 U/mL青霉素,100 μg/mL链霉素),37℃,5 % CO2培养箱中培养。生长对数期Hep G2细胞经胰蛋白酶消化,接种于96孔细胞培养板中,继续过夜培养。次日分别加入不同浓度(25、50、100、200 μg/mL)苦荞多糖,每组各设置5个复孔,以加培养基的实验组作空白对照,分别培养24 h和48 h后,每孔加20 μL MTT(5 mg/mL),继续培养4 h,弃去孔中培养液及MTT,每孔加入150 μL DMSO,室温低速振荡10 min。待结晶物完全溶解后,在酶标免疫测定仪(BIO-RAD MODEL 550)测定490 nm处的吸光值。
1.3.5苦荞多糖对Hep G2细胞细胞核的影响
将无菌的盖玻片铺于6孔板底部,取对数期的细胞适量接种于6孔细胞培养板中,在CO2培养箱中培养,过夜至细胞贴壁,用200 μg/mL的苦荞多糖,分别作用Hep G2细胞24 h和48 h,DAPI染色后激光共聚焦显微镜下观察Hep G2细胞核形态的变化。将同样条件作用后的Hep G2细胞提取DNA[12],2 %的琼脂糖凝胶电泳检测DNA片段化。
2结果与分析
2.1苦荞多糖的分离纯化
按照1.3.1方法,以1∶25(g/mL)的料液比,在温度为90℃,提取4 h后,通过Sevag法除去游离蛋白质,获得多糖粗提物。苦荞多糖的纯化及鉴定如图1所示。

A.苦荞粗多糖在Superdex G 75凝胶柱的分离;B.多糖的纯度鉴定;Mr.标准分子量蛋白;1.纯化的苦荞麦多糖。图1苦荞多糖的纯化及鉴定Fig.1 Purification and identification of TBL
粗多糖经Superdex G75凝胶层析进行了初步的分离纯化,苯酚-硫酸法测定的结果显示(图1A),在洗脱体积为8 mL~15 mL时,为多糖的吸收峰。根据多糖出峰位置判定,该提取物分子量约为20 kD~50 kD,因此我们推测获得的荞麦多糖可能为一种复合多糖。紫外扫描法结果显示,制备的多糖在280 nm处没有明显的吸收,同时SDS-PAGE试验结果(图1B)也表明,制备的多糖不含蛋白,纯度较高。
2.2苦荞多糖对羟基自由基的清除作用
羟自由基是体内最活跃的活性氧,可导致大量疾病的发生,对羟自由基清除率的检测是抗氧化剂抗氧化活性检测的指标之一。按照1.3.3方法测定并计算纯化的苦荞多糖对羟自由基的清除作用,结果如图2所示。
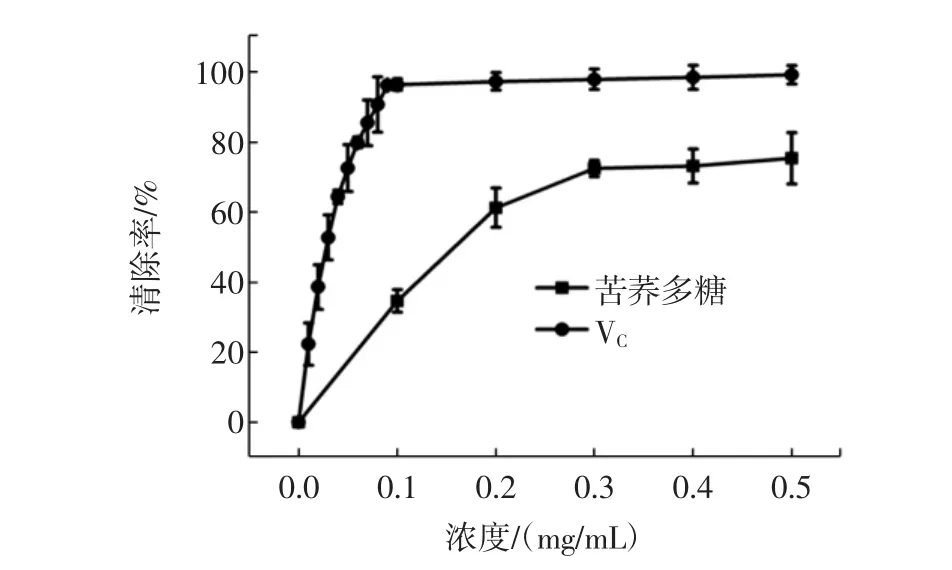
图2多糖对羟自由基(·OH)的清除作用Fig.2 Scavenging effects of polysaccharides on hydroxyl free radical
由图2可知,在较低浓度时(0.1mg/mL~0.3mg/mL),苦荞多糖对羟自由基的清除作用随着浓度升高而增强,有明显的量-效关系,但当浓度达到0.3 mg/mL或更高时,清除能力增加缓慢,经计算可知,清除率达50 %时,所需多糖浓度EC50为0.17 mg/mL。试验中,以清除羟自由基能力较强的VC做参照,图2显示VC的EC50为0.03mg/mL,对羟自由基的清除率可达近100 %,苦荞多糖最大清除率为72 %左右,表明本法提取的多糖具有一定的抗氧化能力。
2.3苦荞多糖对Hep G2细胞增殖的影响
采用MTT法测定了苦荞多糖对HepG2细胞增殖的影响。苦荞多糖HepG2细胞增殖抑制作用如图3所示。
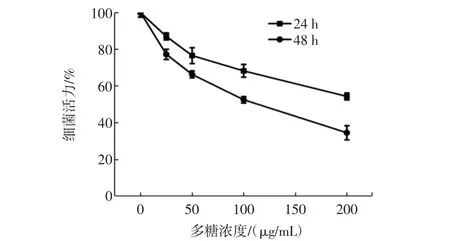
图3苦荞多糖对Hep G2细胞增殖抑制作用Fig.3 The effect of tartary buckwheat polysaccharides on Hep G2 cells proliferation
对从曲线图(图3)分析,苦荞多糖对Hep G2细胞的抑制作用呈剂量与时间依赖性。当不同浓度多糖(50 μg/mL~200 μg/mL)作用时间为24 h时,随着苦荞多糖浓度的升高,对Hep G2细胞增殖抑制作用也逐渐升高。而同样浓度的多糖作用48 h时的抑制效果明显强于24 h。当浓度为200 μg/mL,作用48 h后,苦荞多糖对Hep G2细胞增殖最大抑制率可达35 %。
2.4苦荞多糖对Hep G2细胞核的影响
苦荞多糖对Hep G2细胞核和DNA的影响见图4和图5。
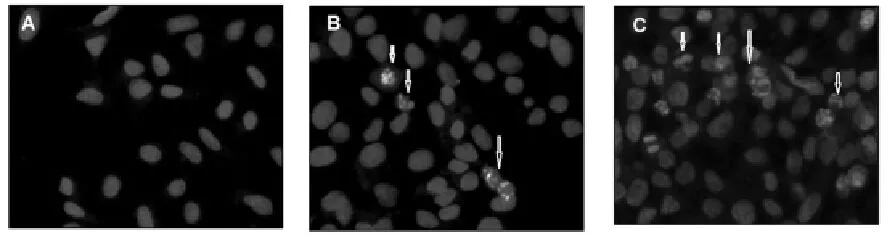
A.对照组;B. 200 g/mL苦荞多糖作用Hep G2细胞24 h;C. 200 g/mL苦荞多糖作用Hep G2细胞48 h。图4苦荞多糖对Hep G2细胞细胞核的影响Fig.4 Hep G2 Cells nuclei morphological changes induced by tartary buckwheat polysaccharides

A.对照组;B. 200 g/mL苦荞多糖作用Hep G2细胞24 h;C. 200 g/mL苦荞多糖作用Hep G2细胞48 h。图5苦荞多糖对Hep G2细胞DNA的影响Fig.5 The effect of Tartary buckwheat polysaccharides on DNA of Hep G2 cells
苦荞多糖作用Hep G2细胞24 h和48 h后,经DAPI染色,图4显示,细胞核都出现了不同程度的浓缩及典型细胞凋亡的特征,且作用48 h时,核异化率明显高于24 h。另外,用苦荞多糖作用Hep G2细胞不同时间后,检测DNA的变化,图5显示,苦荞多糖可使染色质DNA出现断裂,产生大小不等的DNA片段,但未出现典型的200整数倍的DNA ladder条带。有关苦荞多糖抑制Hep G2细胞增殖的机理还有待深入研究。
3讨论与结论
多糖是由单糖通过糖苷键连接而成的一类结构复杂的大分子物质,分子中的单糖又可以在不同的位点相互连接形成不同的支链或者直链结构。与其它天然产物类似,目前很难得到纯多糖或分子量不变的多糖,同时多糖的纯度和分子量和药效有很大关系[13]。不同的提取条件,如温度、pH值的改变可能会破坏植物多糖的高级结构,引起多糖链降解,从而导致植物多糖某种活性的失活。因此研究荞麦多糖的提取条件与相应生物活性的关系有利于多糖在食品、医疗和保健领域的应用。
多糖的抗肿瘤作用机制可以归纳为两大类:第一类多糖与机体的免疫细胞通过分子间的接触,激活免疫细胞,释放出某种信号分子,进而激发和增强免疫反应,间接抑制或杀死肿瘤细胞。例如,从植物、细菌和真菌中提取到β-葡聚糖,使免疫细胞(巨噬细胞、T 和B淋巴细胞及其它效应细胞)迅速处于激活状态,诱导并调节免疫反应,抑制肿瘤或癌细胞的生长繁殖[14]。另一类多糖是具有细胞毒性的多糖,可以直接杀死肿瘤细胞,如青钱柳多糖可以显著抑制人宫颈癌Hela细胞的生长,诱使细胞发生凋亡,使细胞在S期发生阻滞[15]。在我们的实验中发现,苦荞多糖可以使Hep G2细胞的细胞核形态出现明显的染色质凝集等凋亡特征,并且出现明显的DNA断裂等现象,与Wu等[9]报道存在较大的差异,分析原因可能是二者多糖来源及种类不同,前者来源于普通荞麦,后者来源于苦荞麦。同时二者在提取方法上也存在较大的差异,这也可能是二者多糖出现功能差异的原因之一。这些基础研究也将为深入研究天然生物活性物质的功能,为功能保健食产品的开发利用奠定基础。
参考文献:
[1] Zong AZ, Cao HZ, Wang FS. Anticancer polysaccharides from natural resources: A review of recent research[J]. Carbohydrate Polymers, 2012, 90(4):1395-1410
[2]周永.芦荟抗肿瘤作用的研究进展[J].国外医学(卫生学分册), 2001, 28(3):133-139
[3]朱彩平,张声华.枸杞多糖对H22肝癌小鼠的抑癌作用[J].中国公共卫生,2006,22(6):717-718
[4]暴悦梅,陈仁绍.银耳多糖的保健作用及应用前景[J].食品研究与开发,2009,30(10):137-138
[5]陈群,刘天骄.银杏叶多糖的抗肿瘤和免疫调节作用[J].中药药理与临床,2003,19(5):18-19
[6]王传,栋蓝天,郭效东,等.南瓜多糖抑瘤及增强红细胞免疫吸附作用研究[J].中国当代医药,2012,19(4):17-18
[7]闫斐艳,崔晓东,李玉英,等.苦荞总黄酮对人食管癌细胞增殖的影响[J].中草药, 2010, 41(7): 1142-1145
[8] Liu CL, Chen YS, Yang JH, et al. Antioxidant activity of tartary (Fagopyrum tataricum (L.) Gaertn.) and common (Fagopyrum esculentum Moench) buckwheat sprouts[J]. Journal of Agricultural and Food Chemistry, 2008, 56(1):173-178
[9] Wu SC, Lee BH. Buckwheat Polysaccharide Exerts Antiproliferative Effects in THP-1 Human Leukemia Cells by Inducing Differentiation [J]. Journal of Medicinal Food, 2011,14(1):1-8
[10]齐慧玲,魏绍云,王继伦,等. Sevag法去除白及多糖中蛋白的研究[J].天津化工,2000,14(3):20-22
[11]文镜,贺素华,杨育颖,等.保健食品清除自由基作用的体外测定方法和原理[J].食品科学,2004,25(1):190-195
[12]段勇,王玉明,赵淮.从血细胞快速抽提DNA的方法探讨[J].昆明医学院学报,1998,19(2):28-30
[13] Surenjava U, Zhang LN, Xu XJ, et al. Effects of molecular structure on antitumor activities of (1→3)-β-D-glucans from different Lentinus edodes[J]. Carbohydr. Polymers, 2006, 63(1):97-104
[14] Abel G, Czop JK. Stimulation of human monocyte beta-glucan receptors by glucan particles induces production of TNF-alpha and IL-1 beta [J]. Immunopharmacology,1992,14(8):1363-1373
[15]韩澄,聂少平,黄丹菲,等.青钱柳多糖对人胃癌MGC-803细胞生长的影响[J].天然产物研究与开发,2009, 21(6) :952-955
Antioxidant Activity and Anti-cancer Efficacy on Hep G2 Cells of Polysaccharide from Tartary Buckwheat Seeds
LI Shan-shan,CUI Xiao-dong,LI Chen,LI Yu-ying,WANG Zhuan-hua*
(Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education,Institute of Biotechnology,Shanxi University,Taiyuan 030006,Shanxi,China)
Abstract:Tartary buckwheat polysaccharides were isolated by heat extraction and molecular exclusion chromatography,and purity was carried out by UV-visible absorption spectra and SDS-PAGE. The antioxidant activity was evaluated by·OH free scavenging assay. At the same time,anti-cancer efficacy of tartary buckwheat polysaccharides was evaluated. The results showed that the purified polysaccharides contained neither protein nor nucleic acids and had obvious hydroxyl free radical scavenging effect,with an EC50of 0.17 mg/mL. Tartary buckwheat polysaccharides could significantly inhibit the Hep G2 cells proliferation. Moreover,the DNA break of Hep G2 cells occurred after treated with tartary buckwheat polysaccharides. The preparation and the function study of buckwheat polysaccharide have paved the way for the comprehensive research of its biological activity.
Key words:tartary buckwheat;polysaccharide;antitumour;hydroxyl radicals
收稿日期:2014-07-23
DOI:10.3969/j.issn.1005-6521.2016.01.003
*通信作者:王转花(1956—),女,教授,博导,研究方向:蛋白质与生物活性物质。
作者简介:李姗姗(1990—),女(汉),硕士研究生,研究方向:蛋白质与生物活性物质。
基金项目:国家自然/青年科学基金项目(31171659/31300653);山西省科技项目(2014091028)

