有机背景下的高考化学实验试题突破
福建 洪兹田 陈女婷
有机背景下的高考化学实验试题突破
福建 洪兹田 陈女婷
近年全国高考中,有机实验题主要考查有机物的制备实验。其考查背景为大学有机化学实验中常见有机物的制备,出题背景或直接来自于大学基础有机化学实验涉及的苯甲酸、1-溴丁烷、正丁醛、正丁醚、环己酮、乙酸乙酯、硝基苯、乙酰水杨酸、乙酰苯胺、己二酸和环己烯等有机物的制备(如2 0 1 3年全国卷Ⅰ考查环己烯,2 0 1 3年全国卷Ⅱ考查正丁醛);或来自于这些物质的相似化合物的制备(如2 0 1 4年全国卷Ⅰ考查乙酸异戊酯)。试题的落脚点为实验装置和实验仪器的识别、实验操作中的注意事项(如温度计的位置、冷凝水的进出、沸石的作用、水浴加热和防倒吸等)、有机产物的分离与提纯和产率的计算等。
一、有机化学实验常用常考的玻璃仪器
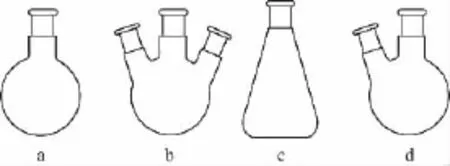
1.反应容器——烧瓶
(1)圆底烧瓶(图a):能耐热和承受反应物(或溶液)沸腾以后所发生的冲击震动。在有机化合物的合成和蒸馏实验中最常使用,也常用作减压蒸馏的接收器。
(2)三口烧瓶(图b):最常用于需要进行搅拌的实验中。中间瓶口装搅拌器,两个侧口装回流冷凝管和滴液漏斗或温度计等。
(3)锥形烧瓶(简称锥形瓶)(图c):常用于有机溶剂进行重结晶的操作,或有固体产物生成的合成实验中,因为生成的固体物容易从锥形烧瓶中取出来。通常也用作常压蒸馏实验的接收器,但不能用作减压蒸馏实验的接收器。
(4)二口烧瓶(图d):常用于半微量、微量制备实验作为反应容器,中间口接回流冷凝管、蒸馏头、克氏蒸馏头等,侧口接温度计、加料管等。
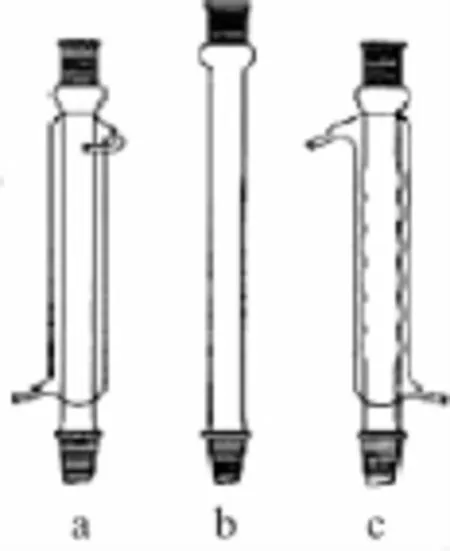
2.冷凝回流仪器——冷凝管
(1)直形冷凝管(图a):蒸馏物质的沸点在1 4 0℃以下时,要在夹套内通水冷却;但超过1 4 0℃时,往往会在内管和外管的接合处炸裂。微量合成实验中,用于加热回流装置上。
(2)空气冷凝管(图b):当蒸馏物质的沸点高于1 4 0℃时,常用它来代替通冷却水的直形冷凝管。
(3)球形冷凝管(图c):其内管的冷却面积较大,对蒸气的冷凝有较好的效果,适用于加热回流的实验。
二、有机化学实验常用的实验装置
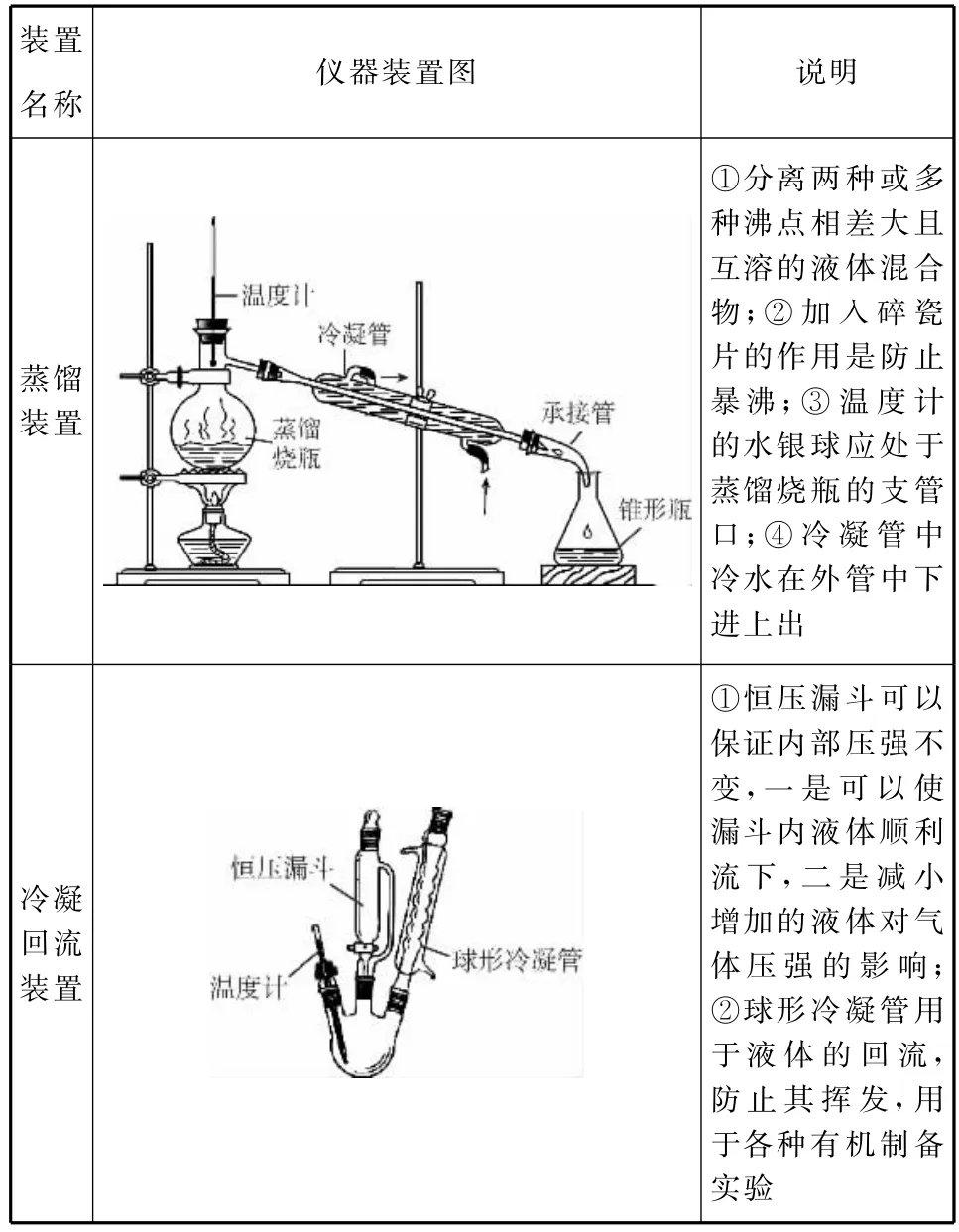
装置名称仪器装置图说明蒸馏装置①分离两种或多种沸点相差大且互溶的液体混合物;②加入碎瓷片的作用是防止暴沸;③温度计的水银球应处于蒸馏烧瓶的支管口;④冷凝管中冷水在外管中下进上出冷凝回流装置①恒压漏斗可以保证内部压强不变,一是可以使漏斗内液体顺利流下,二是减小增加的液体对气体压强的影响;②球形冷凝管用于液体的回流,防止其挥发,用于各种有机制备实验
三、有机制备实验常见的注意事项
1.使用温度计的实验。如实验室制乙烯、苯的硝化反应、石油的分馏、乙酸乙酯的水解(水银球的位置分别是液体中、水中、支管口、水中)。
2.使用冷凝回流装置的实验。如制溴苯、硝基苯等。
3.需要冷凝装置的实验。如制乙酸乙酯、石油的分馏、石油的催化裂化、煤的干馏。
4.需要防止倒吸的实验。如制溴苯、乙酸乙酯、氨气、氯化氢等。
5.需要水浴的实验。如制硝基苯、乙酸乙酯的水解、蔗糖的水解、银镜反应、测定物质的溶解度。
6.需要防止暴沸的实验。如制乙酸乙酯、实验室制乙烯、石油的分馏。
四、中学化学中常见有机物的制备
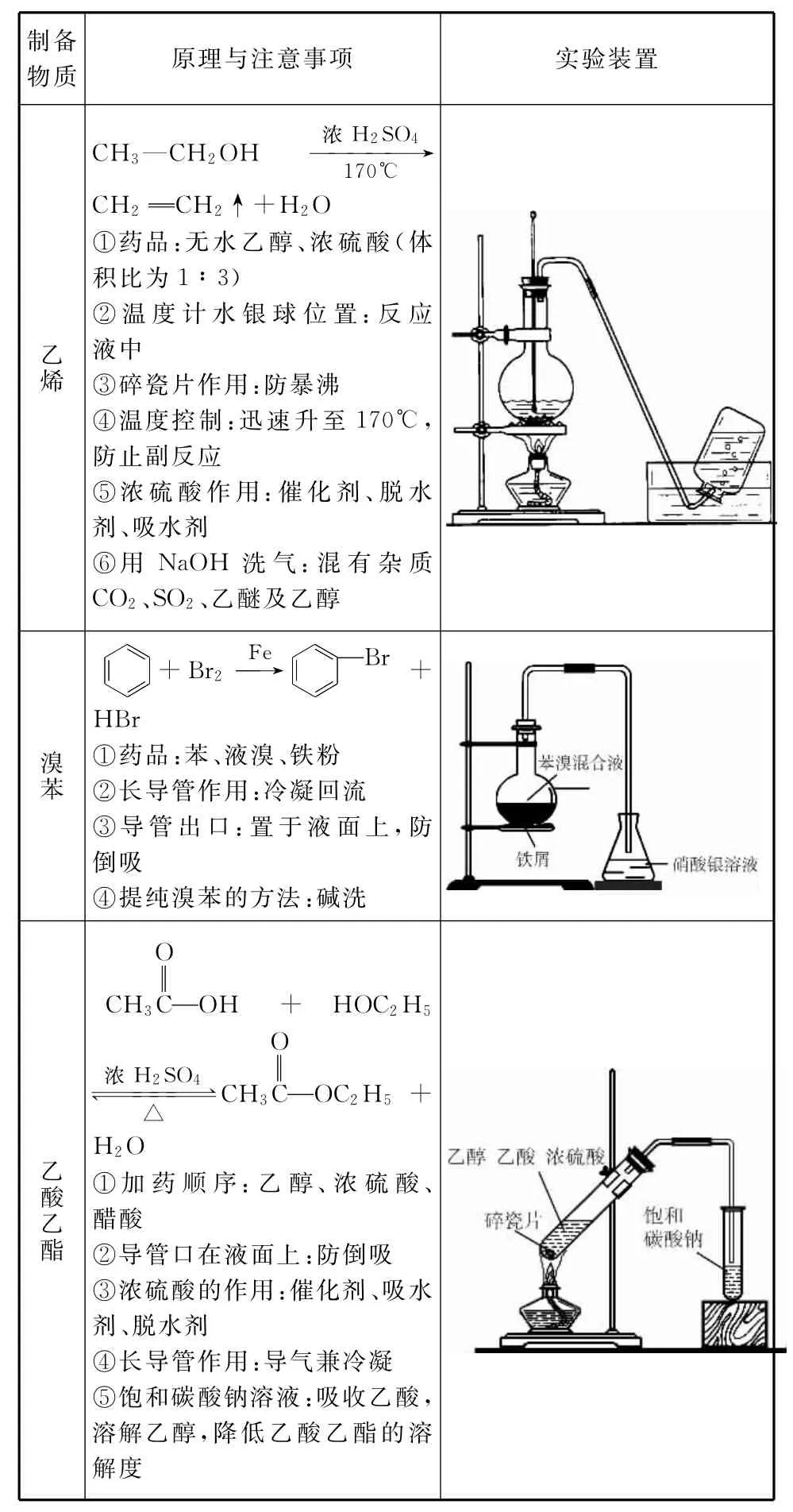
制备物质原理与注意事项实验装置CH3—CH2OH浓H2S O4→1 7 0℃CH乙烯2CH2↑+H2O①药品:无水乙醇、浓硫酸(体积比为1∶3)②温度计水银球位置:反应液中③碎瓷片作用:防暴沸④温度控制:迅速升至1 7 0℃,防止副反应⑤浓硫酸作用:催化剂、脱水剂、吸水剂⑥用N a OH洗气:混有杂质C O2、S O2、乙醚及乙醇帨師FeB r+師+B r2→帨師師溴苯HB r①药品:苯、液溴、铁粉②长导管作用:冷凝回流③导管出口:置于液面上,防倒吸______④提纯溴苯的方法:碱洗O CH3COH+HO C2H5O幑幐5+H2O①加药顺序:乙醇、浓硫酸、醋酸②导管口在液面上:防倒吸③浓硫酸的作用:催化剂、吸水剂、脱水剂④长导管作用:导气兼冷凝⑤饱和碳酸钠溶液:吸收乙酸,溶解乙醇,降低乙酸乙酯的溶解度浓H2S O4帯帯帯帯△CH3CO C2H乙酸乙酯
【高考链接】
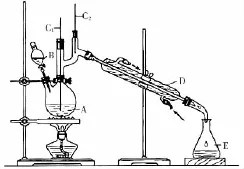
(2 0 1 3全国卷Ⅱ)正丁醛是化工原料。实验小组利用如下装置合成正丁醛。
发生的反应如下:
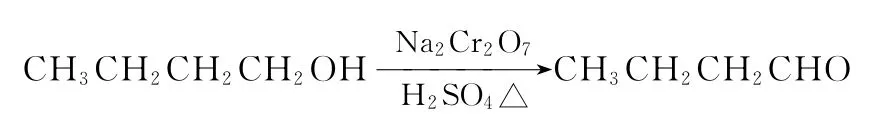
反应物和产物的相关数据列表如下:
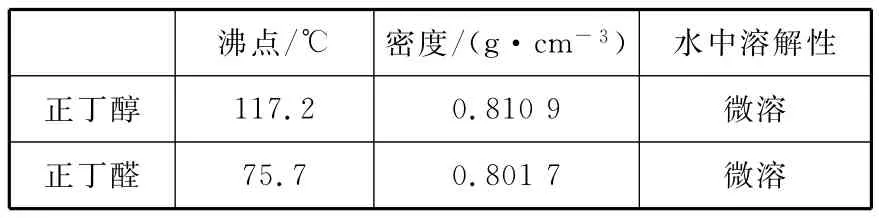
沸点/℃密度/(g·c m-3)水中溶解性正丁醇1 1 7.2 0.8 1 0 9微溶微溶正丁醛7 5.7 0.8 0 1 7
实验步骤如下:
将6.0g N a2C r2O7放入1 0 0m L烧杯中,加3 0m L水溶解,再缓慢加入5m L浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为9 0~9 5℃,在E中收集9 0℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集7 5~7 7℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将N a2C r2O7溶液加到浓硫酸中,说明理由:______________________________________________。
(2)加入沸石的作用是____________________,若加热后发现未加沸石,应采取的正确方法是____________________。
(3)上述装置图中,B仪器的名称是____________,D仪器的名称是____________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿b.干燥
c.检漏d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在________(填“上”或“下”)层。
(6)反应温度应保持在9 0~9 5℃,其原因是_________。
(7)本实验中,正丁醛的产率为________%。
【答案】(1)不能 浓硫酸的密度大,溶于水会放出大量热,容易溅出伤人 (2)防止暴沸 冷却后补加 (3)分液漏斗 直形冷凝管 (4)c (5)下 (6)为了将正丁醛及时分离出来,促使反应正向进行,并减少正丁醛进一步氧化(7)5 1
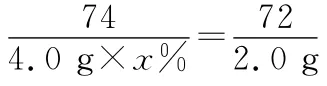
【变式训练】
正溴丁烷是一种重要的化工原料。实验室采用正丁醇与溴化钠、浓硫酸共热制备正溴丁烷(CH3CH2CH2CH2B r),反应原理如下:
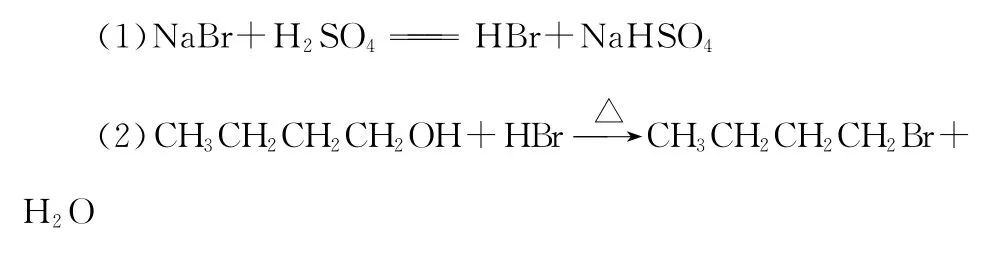
可能存在的主要副反应有:
(3)正丁醇与浓硫酸共热会生成丁烯、正丁醚等;
(4)溴化氢在加热条件下被浓硫酸氧化成溴单质。
实验步骤:
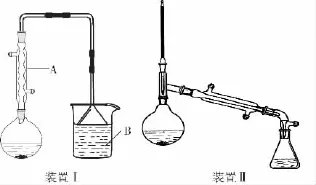
在圆底烧瓶中加入原料,充分振荡后加入几粒沸石,安装装置Ⅰ。加热至沸腾,回流3 0m i n。待反应液冷却后,改装为装置Ⅱ,蒸出粗产品。将所得粗产品倒入分液漏斗中,先用1 0m L水洗涤,除去大部分水溶性杂质,然后依次用5m L的浓硫酸、1 0 m L水、1 0 m L饱和N a HC O3溶液、1 0m L水洗涤。分离出有机层,加入少量无水氯化钙固体,静置1h,过滤除去氯化钙固体后蒸馏,收集9 9~1 0 3℃的馏分,产量5.5g。相关数据如表Ⅰ所示:
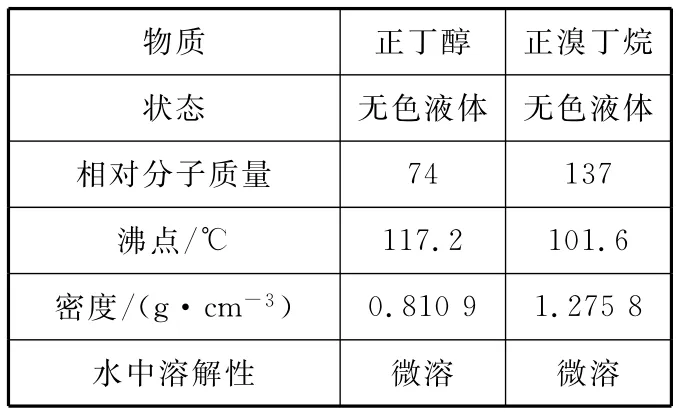
物质正丁醇正溴丁烷状态无色液体无色液体相对分子质量1 1 7.2 1 0 1.6密度/(g·c m-3)7 4 1 3 7___沸点/℃0.8 1 0 9 1.2 7 5 8_水中溶解性微溶微溶
回答下列问题:
(1)装置Ⅰ中仪器A的名称是_________,冷却水从A的________(填“上”或“下”)口通入。
(2)装置Ⅰ中圆底烧瓶加入的原料有:①1 0 m L水;②7.3m L(0.0 8m o l)正丁醇;③1 0.3g(0.1 0m o l)溴化钠;④1 1.7m L(0.2 2m o l)浓硫酸。上述物质的加入顺序合理的是________(填正确答案标号)。
A.①④②③ B.④①②③ C.③④①②
(3)装置Ⅰ中烧杯B盛有N a OH溶液,吸收的尾气主要是___________________(填化学式)。
(4)整个实验至少________次用到沸石,若加热后发现未加沸石,应采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(5)用浓硫酸洗涤粗产品时,有机层从分液漏斗________(填“上口倒出”或“下口放出”);粗产品洗涤操作中,三次用到水洗,最后一次水洗主要是洗掉大部分_______________ ____(填化学式),有人认为第二次水洗的操作可以省略,你的看法是___________________________(填正确答案标号)。
A.可以省略,省略了反而会使实验操作更简单
B.可以省略,省略了可以防止正溴丁烷的水解
C.不能省略,省略了会使N a HC O3溶液的用量增大,浪费药品
D.不能省略,省略了会导致洗涤振摇过程产生大量C O2气体,容易造成活塞蹦出
(6)制备正溴丁烷时,不直接用装置Ⅱ边反应边蒸出产物的方法,其原因是____________________________________。
(7)本实验正溴丁烷的产率为__________(保留三位有效数字)。
【答案】(1)球形冷凝管 下 (2)A (3)HB r(多写B r2、S O2亦可) (4)3 B (5)上口倒出 N a HC O3C D(6)正溴丁烷与正丁醇的沸点相差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出,使产率降低 (7)5 0.2%
【解析】(2)加料时若先使溴化钠与浓硫酸混合,再加正丁醇和水,会导致还没加正丁醇时,已有大量HB r生成。另外,没有正丁醇和水的稀释,浓硫酸的氧化性很强,会将溴化钠氧化成溴,同时放出大量热。再者,正丁醇与浓硫酸共热会有副产物生成。综上所述,加料时的合理顺序为水→浓硫酸→正丁醇→溴化钠。(3)N a OH溶液的作用主要是吸收HB r以及可能生成的少量B r2、S O2,防止污染环境。(4)整个实验涉及1次回流和2次蒸馏,故至少用到3次沸石。(5)用浓硫酸洗涤粗产品时,由于正溴丁烷的密度(1.2 7 5 8g·c m-3)比浓硫酸的密度小,故有机层在上层,从分液漏斗上口倒出;第二次水洗的主要目的是除去大部分硫酸,不仅可以减少下一步洗涤时N a HC O3溶液的用量,还能避免振摇过程产生大量C O2气体,导致压强增大,造成活塞蹦出;最后一次水洗的主要目的是洗掉大部分N a HC O3。(7)n(正丁醇)=0.0 8m o l,n(HB r)=0.1 0m o l,由于二者是1∶1反应,故HB r过量。根据正丁醇可算出理论上生成n(正溴丁烷)=0.0 8 m o l,即m(正溴丁烷)=0.0 8m o l×1 3 7g/m o l=1 0.9 6g,而实际正溴丁烷产量为5.5g,故产率为5.5g÷1 0.9 6g×1 0 0%=5 0.2%。
有机背景下的高考化学实验题一般起点较高,突出能力考查,命题形式上紧扣有机制备实验的命题规律:制备合成→分离提纯→目标产物。试题的落点为实验装置和实验仪器的识别、实验操作中的注意事项、有机产物的分离与提纯和产率的计算等,难度适中,能较好地检测学生的基本实验能力和实验素养。
(作者单位:福建省厦门市翔安第一中学)

