植物生长调节剂及土壤基质对黄秋葵种子萌发与幼苗生长的影响
廖建良,宋冠华,李炜,张志光
(1.惠州学院生命科学学院,广东惠州 516007;2.博罗县杨村镇兄弟农副产品专业合作社,广东惠州 516157)
植物生长调节剂及土壤基质对黄秋葵种子萌发与幼苗生长的影响
廖建良1,宋冠华1,李炜1,张志光2
(1.惠州学院生命科学学院,广东惠州 516007;2.博罗县杨村镇兄弟农副产品专业合作社,广东惠州 516157)
为了探讨植物生长调节剂及土壤对黄秋葵种子萌发与幼苗生长影响.采用NAA(萘乙酸)、生根粉(ABT)、6-BA(6-苄卡基腺嘌呤)3种植物生长调节剂处理黄秋葵种子,红土、沙土、黑土、红土沙土混合种植黄秋葵种子,研究这三种植物生长调节剂及四种土壤对黄秋葵种子萌发与幼苗生长的影响.结果表明:10mg/L NAA具有明显的促进黄秋葵种子生长的作用;45mg/L 6-BA处理的种子发芽率较高;25 mg/L ABT处理的种子发芽势较高.四种土壤栽培的种子沙土的发芽率最高但种子生长迟滞,种子活力低下.黑土的种子发芽较缓慢,但种子后期萌发生长快速,苗高.
黄秋葵种子;植物生长调节剂;土壤基质;种子萌发;幼苗生长
1 前言
本研究的目的意义黄秋葵(Abelmoschus esculentus)为锦葵科秋葵属一年生草本植物,具有发达的根系,黄秋葵果实含有丰富的人体所需的营养物质和膳食纤维[1].黄秋葵是一种具有很高营养价值的药食两用植物[2-7].在广东惠州已经有一批企业和农民种植黄秋葵,如何提高促进黄秋葵的种子萌发与幼苗生长,黄秋葵的种子萌发与幼苗生长情况好坏有关黄秋葵的产量,不同的土壤基质和植物生长调节剂对黄秋葵的生长影响如何?在推广和种植黄秋葵方面显得比较迫切,如何让老百姓都能吃上价格便宜的黄秋葵.因此植物生长调节剂及土壤基质对黄秋葵种子萌发与幼苗生长的影响研究具有实际意义.前人研究基础植物生长调节剂在农业生产及实验中已经广泛的使用,如:李欣欣研究了4种质量浓度的6-BA处理均显著抑制大豆根系生长发育[8],张福平研究了25 mg/L IAA和200 mg/ L GA3的处理对香豌豆种子的萌发及幼苗早期生长效果最好[9],李魏飞研究了植物生长调节剂对刺槐种子萌发及幼苗生长的影响[10],蒙真铖研究了10~20 mg/L的6-BA和NAA处理对毛萼紫薇种子的萌发无促进作用[11].本研究的切入点:目前未见植物生长调节剂及土壤基质对黄秋葵种子萌发与幼苗生长的影响研究报道.拟解决的关键问题:因此本研究旨在找出适合黄秋葵种子生长的土壤基质和植物生长调节剂及其适宜浓度,从而促进黄秋葵种子的萌发与幼苗生长,促进生产与推广.
2 材料与方法
2.1 材料
三种植物生长调节剂萘乙酸(1-Naphthaleneaceticacid,NAA)、6-BA(6-Benzylaminopurine)、生根粉(ABT)、三种土壤基质(惠州学院后山挖取),黑土(具深厚均腐殖质层的黑色土壤)、沙土(由大量的沙和少量的黏土混合而成的土)、红土(发育于热带和亚热带雨林、季雨林或长绿阔叶林植被下的土壤),五福黄秋葵种子,滤纸,游标卡尺(上海恒量量具有限公司),恒温干燥箱(上海实验仪器厂有限公司).
2.2 植物生长调节剂及土壤基质处理
利用盐水选取充实饱满的种子并将选取的种子置于低浓度的NaCl溶液中浸泡半小时,在室温下用不同质量浓度的萘乙酸(10、20、30、40、50 mg/L)、6-BA(15、30、45、60、75 mg/L)、生根粉(ABT)(5、10、15、20、25 mg/L)浸种5 h,每种质量浓度使用一个培养皿处理20粒种子,当浸种结束后用蒸馏水冲洗种子5次,置于垫有滤纸的培养皿中在室温下培养,定时向其中喷水以保持种子生长所需的湿度和足够的水分,重复3次[8].土壤基质处理:盐水选种,将选取的种子浸泡12 h,用长方形厚度为10 cm的花盆育种,每个花盆20粒种子每种土壤基质(黑土、红土、红土沙混合、沙土)栽种5盆.每天定时洒水保持土壤湿度.
每天同一时间观察种子的萌发数,以种子突破种皮为发芽.当种壳脱落,种子萌发数量稳定统计并计算发芽率,干重等萌发指标.土壤基质处理12 d,植物生长调节剂处理9 d.其他生长条件按常规参照文献[1,2,13].
2.3 测定指标
发芽率:到试验截止是发芽种子数占供试种子总数的百分比.发芽率GR=(N0/N*100%(N0为实验终期发芽种子数,N为实验种子总数);芽长:随机选取10根正常生长的幼苗,用游标卡尺测出幼苗的长度,以其平均值作为芽长[9];根长:随机选取10根正常生长的幼苗用游标卡尺测出主根的长度,以其平均值作为根长;发芽势:植物生长调节剂为放入种子的第4 d,土壤基质为放入种子第7 d.发芽势GZ=(n1/N)*100%;对于植物生长调节剂n1为第4 d的种子发芽数,对于土壤基质n1为第7 d的种子发芽数,N为供试种子总数[10];鲜重:将选取的幼苗洗净后用电子天平测得;干重:将选取的幼苗用烘干箱烘干后用电子天平测得;
种子的活力指数:Vt=I*∑Gr/Dt(I为幼苗鲜重、Gr为对应天数(Dt)的发芽种子数,Dt为发芽天数)[13];
2.4 数据处理
用excel2003软件及spss19.0软件进实验处理,对处理后的图表进行分析.
3 结果与分析
3.1 NAA对黄秋葵种子萌发及幼苗生长的影响
从表1、表2、图1可知,质量浓度10 mg/L的NAA对黄秋葵种子发芽率、活力指数较高.10 mg/L质量浓度NAA能够显要促进黄秋葵种子萌发及幼苗生长.在10 mg/L的NAA作用下,发芽率提高了16%,种子活力指数提高了34%,根长提高了64%,而50 mg/L质量浓度NAA则明显阻碍黄秋葵种子萌发及幼苗生长,对黄秋葵种子发芽势的阻碍最为严重降低了30%,活力指数降低了26%.10 mg/L、20 mg/L质量浓度NAA,黄秋葵种子的鲜重较高,种子的活力指数较高.50 mg/L质量浓度NAA则严重抑制了黄秋葵种子的生长活力,活力指数表现为下降趋势.

表1 植物生长调节剂对黄秋葵幼苗根长与芽长的影响

表2 植物生长调节剂对黄秋葵活力指标的影响
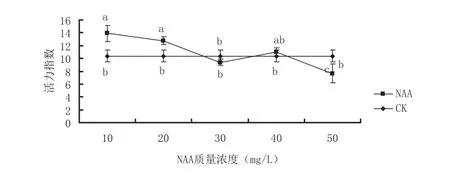
图1 NAA对黄秋葵种子活力指数的影响
3.26 -BA对黄秋葵种子萌发及幼苗生长的影响
由表1、表2、图2可知,对比CK组,五种质量浓度的6-BA均能提高黄秋葵种子发芽率、发芽势与活力指数均提高了10%以上.45 mg/L、75 mg/L质量浓度6-BA黄秋葵种子发芽率较高;15~60 mg/L质量浓度6-BA对黄秋葵种子的芽长和发芽势提高了12%~29%.15 mg/L质量浓度6-BA对黄秋葵幼苗鲜重和芽长的提高较为明显分别达到了16%和30%.60 mg/L质量浓度6-BA黄秋葵种子活力指数最高,对比CK组增长了23%.从图2可以看出15~60 mg/L质量浓度6-BA对黄秋葵种子活力指数全都表现为促进作用.综合分析,45 mg/ L质量浓度6-BA对黄秋葵种子发芽率、鲜重明显较高,生长比整齐.

图26 -BA对黄秋葵种子活力指数的影响
3.3 ABT对黄秋葵种子萌发及幼苗生长的影响
由表1、表2、图3可知,对比CK组五种浓度的ABT对黄秋葵种子的发芽率、发芽势以及活力指数都有提高,其中以20 mg/L和25 mg/L质量浓度ABT促进最为显要.15~25 mg/L质量浓度ABT发芽率均达到了95%,其中25 mg/L质量浓度ABT活力指数最高相比CK组提升了30%.10 mg/L质量浓度ABT对黄秋葵生根、发芽促进在实验组中最为突出,并且鲜重提高了16%为所有组中最高.25 mg/L质量浓度ABT有效提高了种子的发芽势,对比CK组提高了50%.由图3可以看出15 mg/L质量浓度ABT活力指数与20 mg/L质量浓度ABT相接近并且该质量浓度对芽长有明显的促进作用,五种浓度对种子活力指数大致表现为促进作用,并且由曲线可判断在一定浓度范围内,随着浓度的提高活力指数有增高的趋势.

图3 ABT对黄秋葵种子活力指数的影响
3.4 三种植物生长调节剂对黄秋葵根长的影响
图4可知在10 mg/L~50 mg/L的质量浓度范围内,当NAA的质量浓度不断增大,黄秋葵种子的根长降低;当NAA浓度超过30 mg/L根长就保持在一定水平,并且这一水平低于CK组的均值.以CK组均值为对照,10 mg/L、20 mg/L质量浓度NAA对黄秋葵种子根长有促进.由图5可知,促进黄秋葵种子根长最适浓度为45 mg/L 6BA,高于质量浓度45 mg/L6-BA黄秋葵种子的根长降低并且随浓度的增高而减小.由图6可知,当ABT质量浓度为10 mg/L黄秋葵种子根长最高;当随着ABT质量浓度不断升高,根长表现为不断降低.

图4 NAA对黄秋葵根长的影响

图56 -BA对黄秋葵根长的影响

图6 ABT对黄秋葵根长的影响
3.5 不同土壤基质对黄秋葵种子萌发与幼苗生长的影响
实验结果从表3、表4、图7表明沙土能够促进种子萌发并且种子萌发率接近饱和,发芽势也是所有组分中最高.而红土萌发率为四组中最低差,发芽势也最低.虽然黑土的种子萌发率和种子发芽势低于沙土;但在后期的幼苗生长过程中黑土基质的促进作用明显,干重高出沙土近79%、鲜重高出沙土75%、芽长提高40%、根长提高61%;相对于沙,土黑基质有明显的促进种子生长的作用.红土种植的黄秋葵与沙土种植的黄秋葵在芽长、根长、鲜重、干重上相接近,而红土种植的黄秋葵发芽势和发芽率则分别低于沙土61%和41%,差异明显;混合红土、沙土两种土壤比单独两种土壤能够更好的促进幼苗的生长,根长、芽长、鲜重、干重指标提升明显.通过图7可以看到黑土促进幼苗生根发芽明显优于其他三组,沙土和红土相接近;黄秋葵幼苗生根发芽分析,混合土壤则比单独两种土壤生长表现较好.

表3 土壤基质对黄秋葵活力指标的影响
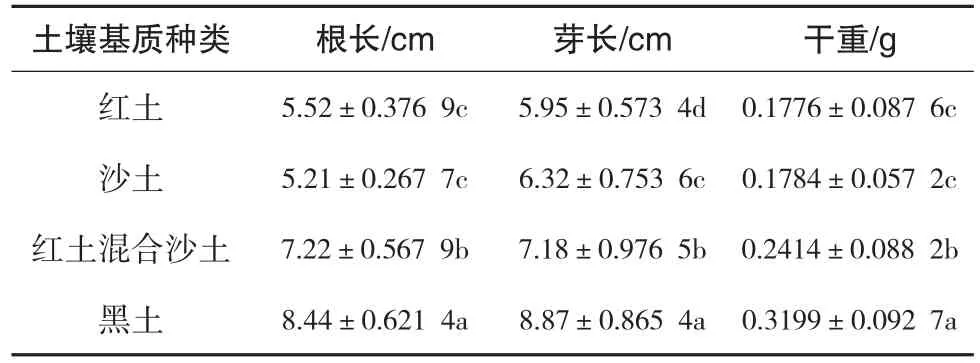
表4 土壤基质对黄秋葵幼苗生长指标的影响
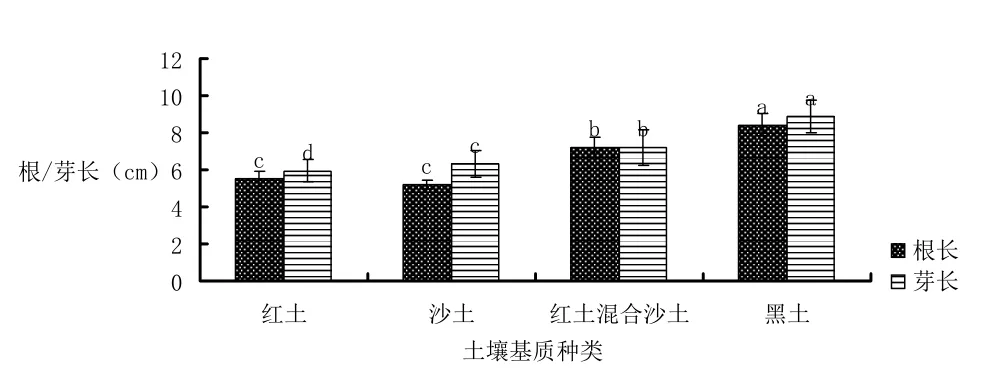
图7 土壤基质对黄秋葵根长与芽长的影响
4 讨论与结论
实验结果表明,10mg/L浓度NAA促进黄秋葵种子萌发及幼苗生长.10mg/L浓度NAA,黄秋葵种子的鲜重较高,种子的活力指数较高.ABT对黄秋葵种子的发芽率、发芽势以及活力指数都有提高,其中以25mg/L浓度ABT较好.10mg/L浓度ABT对黄秋葵生根、发芽促进在实验组中表现较好.45mg/L浓度6-BA对黄秋葵种子发芽率、鲜重较高,生长比整齐;但本实验中6-BA浓度从15mg/L到75mg/L的变化中黄秋葵种子的活力指数相互之间没有差异很大,与李魏飞[10]的文献中6-BA浓度从40mg/L到100mg/L对刺槐种子的活力指数的标准差也同样类似,在孙俊威[12]的文献中不同浓度6-BA对黄秋葵组织的根的生长不显著,但对侧芽的生长表现一定的促进作用,也类似;本实验中6-BA组根的生长与CK组也表现非常接近.浓度为30mg/L到60mg/L的NAA分别在多个指标上低于CK组,这与蒙真铖[11]研究植物生长调节剂对毛萼紫薇种子萌发及幼苗生长的影响实验结果相似.
四种土壤基质栽培的种子,沙土的发芽率最高但种子生长迟滞,种子活力低下.黑土的种子发芽较缓慢,但种子后期生长快速、苗高,土壤基质的培养中黑土表现最为优异,种子的质量提高显著,种子的根长芽长均为最高.而沙土虽然有很高的发芽率但后期苗株长势明显不如其他各组;而红土种子的萌发率低并且其他指标对比黑土差距明显,沙土和红土两种土壤都不适合种植黄秋葵种子;混合土壤对比红土芽长提高了40%左右,根长提高了15以上,鲜重提高了20%,干重提高了41%以上,虽然发芽率与发芽势不及沙土,但对幼苗生长的促进作用明显优于两种单一的土壤,但与黑土相比仍然存在较大差距,在黑土条件下生长最好.
[1]谭永强、胡立勇、赵翠荣,等.不同植物生长调节剂对油菜种子发芽的影响[J].湖北农业科学,2009,48(12).
[2]廖建良等CCFL补光对黄秋葵种子萌发和幼苗生长的影响[J].广东农业科学,2015,42(21):35-39.
[3]刘娜.黄秋葵的综合利用及前景[J].中国食物与营养,2007,21(6).
[4]高振茂、高冠亚、杜丽红.天然佳蔬黄状葵的营养毛食用方法法[J]上海蔬菜,2005,31(2).
[5]宫慧慧、于倩、王恩军,等.黄秋葵的应用价值和产业化开发前景[J]山东农业科学,2013,45(10).
[6]OPPONG-SEKYERE D,AKROMAH R,NYAMAH E Y,et al.Evaluation of some okra(Abelmoschusspp L.)germplasm in Ghana[J].African Journal of PlantScience,2012,6(5):166-178.
[7]胡韬、许震寰、韩菊兰,等.黄秋葵袋泡茶营养成分的测定与分析[J].安徽农业科学,2015,19(3).
[8]李欣欣、廖红、赵静.GA3、ABA和6-BA对大豆根系生长的影响[J].华南农业大学学报,2014,35(3).
[9]张福平、李洁琼.植物生长调节剂对香豌豆种子发芽的影响[J].种子,2011,30(1).
[10]李魏飞.植物生长调节剂对刺槐种子萌发及幼苗生长的影响[J].贵州农业科学,2014,42(4).
[11]蒙真铖,丁琼,宋希强,等.植物生长调节剂对毛萼紫薇种子萌发及幼苗生长的影响[J].热带作物学报,2014,35(9).
[12]孙俊威,方晓峰,陈珍.不同植物生长调节剂对黄秋葵组织培养的影响[J].北方园艺,2012,13(7).
[13]廖建良,陈龙强,廖仕忠.CCFL补光对四季豆栽培的影响研究[J].惠州学院学报,2014,34(3):40-45.
【责任编辑:吴跃新】
Effect of Plant Growth Regulator and Soil Matrix on Seed Germination and Seedling Growth of Abelmoschus Esculentus
LIAO Jian-liang1,SONG Guan-hua1,LI Wei1,ZHANG Zhi-guang2
(1.School of Life Science,Huizhou University,Huizhou 516015,Guangdong china;2.Brothers’Agricultural and Sideline Products Cooperatives,Yangcun,Boluo,Huizhou 516517,Guangdong China)
[Objcetive]To study on the seed germination and seedling growth of Abelmoschus Esculentus;[Mehtod]Dealing with Abelmoschus esculentus seeds in using of three kinds of plant growth regulators including 1-Naphthaleneaceticacid(NAA),6-Benzylaminopurine(6-BA)and ABT,and planting Abelmoschus esculentus seeds in using of four kinds of soil matrix including clay,sand,black soil,and mixed clay with sand,to study how the three kinds of plant growth regulators and the four kinds of soil matrix work on Abelmoschus esculentus seeds.[Result]Results show,NAA of 10mg/L can obviously promote the seed growth,it clearly promotes seed germination in 6-BA of 45mg/L,and it reaches the highest seed germination potential in ABT of 25 mg/L;in the four soil matrixes,the Abelmoschus esculentus seeds have the highest seed germination but slow growth in the sand,and on the contrary,the black soil accelerates the seedling growth but germinates slowly.
Abelmoschus esculentus seeds;plant growth regulator;soil matrix;seed germination;seedling growth
S649
A
1671-5934(2016)06-0035-05
2016-11-11
惠州科技计划项目(2014B040008007);博罗科技计划项目(2014B011401005);惠州学院植物学课程群教学团队(TD2016003)
廖建良(1965-),男,广东紫金人,教授,硕士,研究方向为植物学.

