3种方法检测白假丝酵母菌对氟康唑、伏立康唑的敏感性对比
陈文伟 黄良珍 彭钢文
临床研究
3种方法检测白假丝酵母菌对氟康唑、伏立康唑的敏感性对比
陈文伟 黄良珍 彭钢文
目的比较抗真菌药敏试验纸片扩散法、ATB FUNGUS3(ATB F3)微量稀释法和E-试验(Epsilometer test)检测白假丝酵母菌对氟康唑、伏立康唑的结果,探讨3种方法的可比性和一致性。方法使用纸片扩散法和ATB F3法对中山市古镇人民医院住院患者分离的58株白假丝酵母菌进行药敏试验,同时用E-试验作为对照。结果纸片扩散法与E-试验的符合率在氟康唑为69.0%(40/58),在伏立康唑为98.2%(57/58);ATB F3法与E-试验的符合率在:氟康唑为89.7%(52/58),在伏立康唑为96.6%(56/58)。结论纸片扩散法检测白假丝酵母菌对氟康唑敏感性与E-试验符合率不甚理想,ATB F3法比较理想;而伏立康唑无论纸片法还是ATB F3法与E-试验结果符合率非常一致。ATB F3法检测白假丝酵母菌敏感性操作简便,使用成本低,大多数医院特别是基层医院应该推广普及。
ATB FUNGUS3;E-试验;抗真菌药敏试验
虽然真菌感染是机会性感染性疾病,但威胁人类生命的真菌感染每年都在不断地增多,其中念珠菌感染占了很大一部分比例[1],并已成为医院重症加强治疗病房(ICU)最严重的感染源之一[2]。由于广谱抗菌药物的长期和大量使用、血液透析及肿瘤化疗药物的使用,静脉导管的介入治疗及细胞免疫低下的人群不断增多,导致真菌败血症的发病率逐渐增高[3],国外有报道器官移植的患者念珠菌感染达到了3.5%[4],对肝移植术后患者应注意预防真菌感染[5]。氟康唑、伏立康唑均为临床上应用的比较多的抗真菌药物,随着抗真菌药物的使用增多,耐药率也在不断地上升[6-7],其中白假丝酵母菌在人体分离的念珠菌中占的比例达到了55.9%[8],因此,其药敏测试也显得十分重要。本研究将纸片扩散法、ATB FUNGUS3(ATB F3)法和E-试验(Epsilometer test)检测白假丝酵母菌对氟康唑、伏立康唑敏感性结果进行对比分析,报告如下。
1 材料与方法
1.1 菌株来源 2015年1月至8月,从中山市古镇人民医院各临床科室住院患者的痰液、血液、中段尿及伤口分泌物等标本中分离出的白假丝酵母菌58株(剔除同一患者同一部位连续分离的菌株,其中呼吸内科20株、骨科6株、普外科5株、重症监护室18株、心肾神经内科9株)用于测试药敏试验。
1.2 分离与鉴定 酵母菌分离采用沙保氏琼脂平板28℃培养48 h;鉴定采用法国生物梅里埃公司生产的API Candida鉴定分离菌株。
1.3 抗真菌药敏试剂
1.3.1 药敏纸片 由英国Oxoid公司生产。氟康唑每片25 μg,伏立康唑每片1 μg。
1.3.2 ATB F3试剂盒 由法国生物梅里埃公司生产。抗菌药物浓度:氟康唑1~128 mg/L、伏立康唑0.06~8 mg/L。
1.3.3 E-试验试纸条 由瑞典AB-Biodisk公司生产,氟康唑0.016~256 mg/L、伏立康唑0.016~256 mg/L。药敏培养基成分:RPMI 1640(由广州迪景公司生产),0.165mol/L MOPS(由美国sigma公司生产),1.5%BACTO琼脂(由美国DIFCO公司生产),2%葡萄糖121℃、15 min,制成直径150 mm的平板。
1.4 方法
1.4.1 纸片扩散法 将调好的0.5 mU白假丝酵母菌纯菌液用棉拭子均匀徒布于改良SHADOMY琼脂平板,将相应纸片贴于平板培养18~24 h后读结果,若菌落生长不良则再多培养24 h,在约80%抑制区判读氟康唑的抑菌直径,在100%抑制区读取伏立康唑的抑菌直径。
1.4.2 ATB F3法 将调好的2 mU白假丝酵母菌纯菌液20 μL加入ATB F3培养基中混匀,再从每孔吸取135 μL混有菌液的培养基加入药敏板中,置30℃孵育24~48 h。以生长对照孔生长良好,而含药最高稀释孔不生长者为最小抑菌浓度(MIC)的终点。
1.4.3 E-试验 将试验菌株用沙保氏琼脂平板纯化,挑起菌落溶于生理盐水中,制备成浊度为0.5 mU的菌悬液。用无菌棉拭蘸取菌悬液,均匀涂布于药敏专用培养基上,平板干燥15 min后将2种E-试验试纸条紧贴附于培养基上,30℃下培养24 h,在抑菌环与纸条上药物浓度交界处下方读取MIC值。
1.5 判断标准
1.5.1 纸片扩散法 参照临床和实验室标准协会(CLSI)M51-A抗真菌药敏试验标准。氟康唑:培养18~24 h,抑菌环直径≥19 mm为敏感,15~18 mm为中介,≤14 mm为耐药。伏立康唑:培养18~24 h,抑菌环直径≥17 mm为敏感,14~16 mm为中介,≤13 mm为耐药。
1.5.2 ATB F3法 参照CLSI M38-A2抗真菌药敏试验标准:氟康唑≤8 mg/L、伏立康唑≤1 mg/L为敏感;氟康唑MIC≥64 mg/L、伏立康唑MIC≥4 mg/L为耐药;氟康唑MIC在16~32 mg/L、伏立康唑MIC 在=2 mg/L为剂量依赖敏感或中介。
1.5.3 E-试验 参照CLSI M38-A2抗真菌药敏试验标准:氟康唑≤8 mg/L、伏立康唑≤1 mg/L为敏感;氟康唑MIC≥64 mg/L、伏立康唑MIC≥4 mg/L为耐药;氟康唑MIC在16~32 mg/L、伏立康唑MIC 在=2 mg/L为剂量依赖敏感或中介。
1.6 质量控制 试验以白假丝酵母菌ATCC90028为对照同时进行测定。
2 结果
2.1 质控纸片扩散法 白假丝酵母菌ATCC90028对氟康唑和伏立康唑的抑菌环直径为23 mm和22 mm均为敏感,质控范围来源于Oxoid公司提供的说明书。ATB F3法与E-试验检测白假丝酵母菌ATCC90028对氟康唑的MIC分别为2 mg/L和1 mg/L,对伏立康唑的MIC分别为0.125 mg/L和0.125 mg/L。
2.2.1 纸片扩散法与E-试验检测白假丝酵母菌对氟康唑和伏立康唑的敏感性比较 纸片扩散法检测58株白假丝酵母菌,对氟康唑的敏感性敏感(S)为55.2%、依赖(SDD)为31.0%、耐药(R)为13.8%; E-试验S为86.2%、SDD为10.4%、R为3.4%;对伏立康唑的敏感性S为91.3%、SDD为5.2%、R为3.4%;E-试验S为89.7%、SDD为6.9%、,R为3.4%。纸片扩散法与E-试验药敏结果符合率在氟康唑为69.0%(40/58);在不符合的18株中,6株纸片扩散法为SDD、E-试验为S,6株纸片扩散法为R、E-试验为SDD。纸片扩散法与E-试验药敏结果符合率在伏立康唑98.2%(57/58);在不符合的1株中,纸片扩散法为S,E-试验为SDD。见表1。
2.2.2 ATB F3法与E-试验检测白假丝酵母菌对氟康唑和伏立康唑的敏感性比较 ATB F3法检测58株白假丝酵母菌对氟康唑的敏感性S为75.9%、SDD为17.2%、R为6.9%;E-试验S为86.2%、SDD为10.4%、R为3.4%;ATB F3法对伏立康唑的敏感性为S为93.1%、SDD为5.2%、R为1.7%;ATB F3法与E-试验药敏结果符合率在氟康唑为89.7% (52/58);在不符合的6株中,2株ATB F3法为R、E-试验为SDD;4株ATB F3法为SDD、E-试验为S。伏立康唑符合率96.6%(56/58),在不符合的2株中ATB F3法为S、E-试验为SDD。见表2。
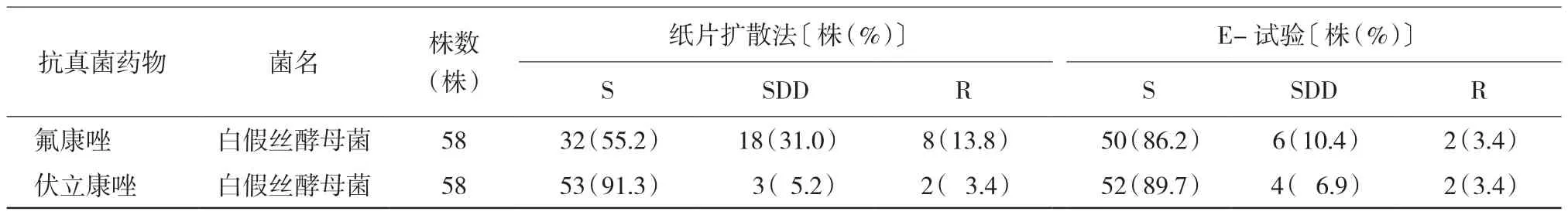
表1 纸片扩散法与E-试验检测白假丝酵母菌的耐药性比较

表2 ATB F3法与E-试验检测白假丝酵母菌的耐药性比较
3 讨论
氟康唑属于三唑类抗真菌药物具有广谱的抗菌活性,毒性低,既可口服又可注射,适用于老人和儿童,是治疗深部真菌感染的首选药物。但随着氟康唑使用增多的同时耐药率也上升,新一代三唑类广谱抗真菌药物伏立康唑已经上市。目前在全世界范围的念珠菌耐药的报道也在不断地增多,当中不乏报道有伏立康唑的耐药。我国学者的研究表明,假丝酵母菌对氟康唑的耐药在3.3%~42.3%[9]; Cuenca-Estrella等[10]在西班牙当地医院分离的4 226株白假丝酵母菌对伏立康唑的耐药率为5%,而伏立康唑在国内耐药则较少报道。本试验结果显示,氟康唑对白假丝酵母菌敏感性纸片扩散法为55.2%,ATB F3法75.9%,参考对照E-试验为86.2%,纸片扩散法与ATB F3法差异有统计学意义(P < 0.05),伏立康唑纸片扩散法和ATB F3法敏感性超过90%,差异无统计学意义(P > 0.05)。
目前,我国纸片扩散法、E-试验念珠菌的药敏试验所用标准是CLSI 2010年的CLSI M51-A[11],微量稀释法采用的标准是CLSI M38-A2[12],其中CLSI纸片扩散法操作简便,但本试验显示,纸片扩散法测试氟康唑的敏感性与E-试验相比符合率不甚理想,而测试伏立康唑则与E-试验非常一致。ATB F3法操作简单、判读方便,成本相对较低,严格按照操作规程操作即可得到合适浓度范围内的MIC
值,所以ATB F3法目前是我国应用最广的念珠菌药敏测试的方法。但使用ATB F3法必须注意两点: ① ATB F3法试剂板上抗菌药物浓度稀释孔孔数比较少,由此得出的MIC值不如E-试验准确,因而其检测MIC折点值有一定误差,对于区分SDD株和R株存在不足。② 在机器自动判读白假丝酵母菌的氟康唑和伏立康唑MIC折点值,如果存在拖尾现象时会将S或SDD读成R,建议用人工肉眼判读[13]。E-试验目前是最佳的测试念珠菌药敏的方法,它结合了扩散法的原理和特点,与肉汤稀释法和微量稀释法有良好的符合率[14],判断MIC折点值较准确,但试纸条价格昂贵,目前临床应用受限而更多地用于科研。综上所述,大多数医院应该普及ATB F3法测试白假丝酵母菌敏感性,当实验室得出的药敏结果与临床不符合或治疗效果不佳时,有条件的实验室应用E-试验复检,更好地指导临床用药。
1 Pfaller MA, Diekema DJ, Gibbs DL, et al.Resultsfrom the ARTEMIS DISK Global Antifungal Surveillance study, 1997 to 2005: an 8.5-year analysis of susceptibilities of Candida species and other yeast species to fluconazole and voriconazole determined by CLSI standardized disk diffusion testing. J Clin Microbiol, 2007,45:1735-45.
2 贾磊,郁慧杰,陆锦琪,等.重症监护病房念珠菌感染情况及药敏分析.中国中西医结合急救杂志,2014,21:449-452.
3 赵俊英,王毓新,张文娟.真菌病诊断与治疗.北京:人民卫生出版社,2007.
4 Gavaldà J, Meije Y, Fortún J, et al. Invasive fungal infections in solid organ transplant recipients. Clin Microbiol Infect, 2014,20 Suppl 7: 27-48.
5 郑卫萍.肝移植术后预防性抗真菌治疗的系统性回顾和网状Meta分析.实用器官移植电子杂志,2015,2:58-58.
6 姜小国,胡森.抗真菌药氟康唑改善脓毒性休克患者的存活率.中华危重病急救医学,2003,15:454.
7 王晓玲,侯佳宜,高颖,等.白假丝酵母菌简便培养方法的建立及临床应用研究.实用检验医师杂志,2014,6:133-136.
8 王顺,王永涛,贾征夫.感染性标本中检出的假丝酵母菌属种类及药物敏感性分析.中华医院感染学杂志,2013,23:5367-5368,5371.
9 Zhang L, Wang H, Xiao M, et al. The widely used ATB FUNGUS 3 automated readings in China and its misleading high MICs of Candida spp. to azoles: challenges for developing countries' clinical microbiology labs. PLoS One, 2014,9:e114004.
10 Cuenca-Estrella M, Gomez-Lopez A, Cuesta I, et al. Frequency of voriconazole resistance in vitro among Spanish clinical isolates of Candida spp. According to breakpoints established by the Antifungal Subcommittee of the European Committee on Antimicrobial Susceptibility Testing. Antimicrob Agents Chemother,2011,55: 1794-1797.
11 CLSI. Method for antifungal disk diffusion susceptibility testing of non-dermatophyte filamentous fungi; Approved Guideline,CLSI document M51-A. Wayne, PA: Clinical and Laboratory Standards Institute, 2010.
12 CLSI. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi; Approved standard-Second edition. CLSI document M38-A2. Wayne, PA: Clinical and Laboratory Standards Institute, 2008.
13 黄会,吴多荣,韩小胜,等.1312株酵母菌的鉴定及其药敏分析.实用预防医学,2012,19:1536-1537.
14 Gupta P,Khare V,Kumar D,et al. Comparative Evaluation of Disc Diffusion and E-test with Broth Micro-dilution in Susceptibility testing of Amphotericin B, Voriconazole and Caspofungin against Clinical Aspergillus isolates. J Clin Diagn Res, 2015,9:DC04-7.
(本文编辑:李银平)
Comparative evaluation of three methods in susceptibility testing of fluconazole and voricanazole against candida albicans
CHEN Wen-wei, HUANG Liang-zhen, PENG Gang-wen. Department of Clinical Laboratory, Guzhen People's Hospital of Zhongshan , Zhongshan 528400 , Guangdong , China
ObjectiveTo compare white candida yeast susceptibility detection to fluconazole , voriconazole by Disc Diffusion and ATB FUNGUS3 (ATB F3) Micro-diffusion and Epsilometer test (E-test) method , discuss comparability and consistency of three methods .Methods58 strains white candida yeast isolated from hospitalized patients in Guzhen people's hospital were tested for drug sensitive by Disc Diffusion, ATB F3 method and as a control by the E-test method .ResultsThe accuracy of disc diffusion method and E-test method for fluconazole and voricanazole were 69.0% (40/58) and 98.2% (57/58) , respectively . The accuracy of ATB F3 method and E-test method for fluconazole and voricanazole were 89.7% (52/58) and 96.6% (56/58) , respectively .ConclusionsThere was not higher coincidence rate of Disc Diffusion method with E-test method for candida albicans susceptibility to fluconazole , the ATB F3 method was more ideal. There was highter coincidence rate with E-test method for voricanazole, no metter Disc Diffusion method or ATB F3 method . ATB F3 method promises to be easier and cheaper, ATB F3 method can be chosen as a primary hospital in widespread use testing method .
ATB FUNGUS3 . Epsilometer test . antifungal susceptibility
528400 广东中山,中山市古镇人民医院检验科
陈文伟,Email:401753338@qq.com
10.3969/j.issn.1674-7151.2016.04.004
2016-06-27)

