碳酸钙对潮土Cd2+的固定及土壤酶活性的影响*
黄 擎 刘博睿 王梦远 贾 茹 郭 相 邰丽梅 桂明英(.北京理工大学材料学院,北京 0008;.中华全国供销合作总社昆明食用菌研究所,云南 昆明 6503)
随着工业化和城市化进程的加快,大气沉降和污水、污泥、畜禽粪便的排放以及农业化肥的使用造成了严重的土壤重金属污染[1-3]。土壤重金属污染的修复方法有多种,其中化学固定技术最常见,即通过化学添加剂降低土壤中重金属元素的离子态含量,抑制其向农作物体内迁移,从而降低环境风险[4-5]。研究表明,多种化学物质可以作为土壤重金属固定剂使用,包括粉煤灰[6-7]、石灰[8]653,[9]、沸石[10]、碳酸钙[11]、乙二胺四乙酸(EDTA)[12]以及有机酸[13]等,其中碳酸钙的固定效果较好[14]24,且易获取、成本低,具有广泛应用的潜力。此外,化学固定剂的使用可能伴随产生相应的土壤理化性质及微生物代谢过程变化(重点表现在土壤酶活性改变)。脲酶、碱性磷酸酶和过氧化氢酶常用于表征土壤氮素、磷素转化及化合物氧化过程,在一定程度上反映了土壤微生物过程的强度以及肥力水平[15]96,[16]1142,[17]246。本研究以潮土Cd2+为研究对象,探究在种植小白菜的情况下,碳酸钙施加对潮土中Cd2+的固定作用,以及该过程中土壤理化指标、植物生物量和土壤酶(脲酶、碱性磷酸酶、过氧化氢酶)活性变化,综合评价碳酸钙作为土壤重金属离子固定剂的使用效果,为土壤重金属污染防治工作提供理论依据。
1 材料与方法
1.1 实验材料
供试土壤为采集自北京市房山区的潮土(采集深度为0~20 cm,其理化性质参数如表1所示),在室温下风干2 d,研磨并过2 mm筛,待用。Cd2+固定剂采用碳酸钙(分析纯);小白菜种子购买于中国农业科学院花卉市场。

表1 供试土壤的理化性质参数Table 1 Background properties of experimental soil

表2 每组处理的CdCl2及碳酸钙施加量Table 2 Concentrations of CdCl2 and calcium carbonate for each treatment
1.2 种植实验
每组处理的CdCl2(以Cd2+浓度表征)及碳酸钙施加量如表2所示。种植实验采用12 cm×Φ10 cm的花盆,每盆装入风干土壤样品330 g。种植前,向每盆加入尿素、磷酸二氢钠和硫酸钾溶液,使土壤总氮、总磷、总钾质量浓度分别达到3.067、1.027、0.157 g/kg[18]。物料添加完成后的土壤样品需陈化1周,待各物质性质稳定后开始种植实验。每个处理均设置3个平行样。实验过程中所有花盆均采用玻璃胶封底,防止Cd2+及营养物质流失。
种植实验按照5组(A~E组)进行。其中A组不播种,直接对土壤样品进行采集,作为种植0 d的分析样本;B~E组直接播种,播种量为5颗/盆。播种后,采用蒸馏水进行浇灌以防止外源Cd2+引入。种植过程保证充足的光照,温度设定为28 ℃(14 h)、15 ℃(10 h)循环进行[19]。小白菜的生长周期为40 d,在第10天进行间苗操作。B~E组分别于播种后第10、20、30、40天停止实验,并对土壤样品进行采集,同时对E组成熟的小白菜植株进行整体采集,待测。
1.3 测定方法
1.3.1 待测样品预处理
所有土壤样品在室温下风干2 d后进行研磨操作,并过1 mm筛,待测;用蒸馏水对植物样品进行清洗,并分离为根部、茎部、叶片,随后在105 ℃条件下进行烘干,研磨,并过2 mm筛,待测。
1.3.2 指标分析方法
植物样品分析指标为不同部位(根部、茎部、叶片)的生物量以及Cd2+浓度。生物量分析采用直接称重法,以各部位的鲜质量表示;Cd2+浓度分析采用硝酸-高氯酸-氢氟酸(体积比8∶2∶8)联合消解法,选用安捷伦7500C型电感耦合等离子质谱仪(ICP-MS)。
土壤样品的分析指标包括pH、有机碳浓度、脲酶活性、碱性磷酸酶活性、过氧化氢酶活性。pH采用玻璃电极法测定;有机碳浓度采用重铬酸钾氧化—分光光度法测定;脲酶活性采用靛酚蓝比色法测定;碱性磷酸酶活性采用磷酸苯二钠比色法测定;过氧化氢酶活性采用高锰酸钾滴定法测定[17]246-247,[20-21]。
1.3.3 数据处理方法
所有指标测定结果均以平均值±标准偏差表示,所得数据的绘图采用Origin 9.1软件。数据的统计分析处理,包括单因素方差分析、相关分析以及回归分析,均采用SPSS 20.0软件。
2 结果与讨论
2.1 碳酸钙对潮土中Cd2+的固定作用
不同CdCl2和碳酸钙施加量下植株各部位的Cd2+浓度如图1所示。由图1(a)可知,在无外源Cd2+的条件下,碳酸钙施加不会对植物体内的Cd2+浓度产生显著影响;而CdCl2施加量越大,植物体内的富集水平越高(P<0.05),其在根部和叶片中的浓度显著高于茎部中的浓度(P<0.05),与陈青云等[22]的研究结果一致。存在外源Cd2+的条件下,碳酸钙的施加会显著降低植株各部位的Cd2+浓度(P<0.05),其原因可能在于两方面:(1)碳酸钙会促进土壤中CdCO3沉淀的形成,抑制其向植物体内迁移[23];(2)碳酸钙的施加提高了土壤中的Ca2+浓度,在植物吸收方面加强了与Cd2+的竞争,降低了Cd2+在植物中的富集水平[8]654。而随着碳酸钙施加 注:图中的字母标记为单因素方差分析多重比较结果,同组字母标记完全不同者表示具有显著差异(P<0.05),标有相同字母者表示差异不显著,图2至图7同。

图1不同CdCl2和碳酸钙施加量下植株各部位的Cd2+质量浓度
Fig.1 Dynamic change of Cd2+concentration in each part of mature pakchoies under different CdCl2and calcium carbonate treatments
量的增加,植株各部位的Cd2+浓度呈先减小后增大的趋势(P<0.05),原因可能在于碳酸钙施加量较大时,Ca2+引入过多,与土壤中的结合态Cd2+竞争吸附点位,导致过多的Cd2+得到释放并向植株体内迁移[24-25]。由此可推断植株体内Cd2+浓度极小值出现在碳酸钙施加量为6~9 g/kg,与张亮[14]25的研究结果一致。
2.2 施加碳酸钙对潮土理化性质及植物生物量的影响
在不同的Cd2+浓度下,碳酸钙施加量与土壤样品pH及有机碳浓度的关系如图2和图3所示。由图2可知,土壤pH不会随Cd2+浓度、碳酸钙施加量和种植时间发生显著变化,均在7.5~8.5,表明实验过程中潮土呈碱性环境。如图3(a)所示,在无外源Cd2+的条件下,土壤样品有机碳浓度不随碳酸钙施加量及种植时间发生显著变化;根据图3(b)和图3(c)可知,外源Cd2+的施加达到一定浓度会降低土壤样品中的有机碳浓度(P<0.05),原因可能在于土壤有机碳浓度与微生物活性存在正相关关系[15]99,而Cd2+的施加抑制了土壤微生物活性,造成有机碳浓度降低。存在外源Cd2+的条件下,随碳酸钙施加量的增加,土壤有机碳浓度呈先增加后减小的趋势,且极大值出现在施加量为6~9 g/kg(P<0.05)。由图1可知,随碳酸钙施加量的增加,植株中Cd2+浓度呈先减小后增大的趋势,即土壤中Cd2+的植物有效性呈同样的变化趋势[26-28];而根据WANG等[29]和SUN等[30]的研究结果,土壤中重金属离子的植物有效性等同于微生物有效性(毒性)。因此,可以判断随碳酸钙施加量的增加,土壤中Cd2+的微生物毒性同样呈先减小后增大的趋势,影响了微生物活性,造成了土壤有机碳浓度的改变。
存在外源Cd2+污染时,在碳酸钙施加一定量的情况下,种植40 d后土壤有机碳浓度显著提高(P<0.05)。根据张亮[14]37的研究结果,在碳酸钙施加后,潮土中Cd2+的植物有效性随培养时间的增加而降低,即在种植过程中Cd2+对土壤微生物的毒性会逐渐降低,由此产生了土壤有机碳浓度的动态变化。
在不同的Cd2+浓度下,碳酸钙施加量与植株各部位生物量的关系如图4所示。由图4可知,茎部、叶片的生物量显著高于根部生物量(P<0.05)。在无外源Cd2+污染的情况下,植株各部位的生物量无显著变化;而外源Cd2+的引入使得生物量显著降低,且随碳酸钙施加量的增加呈先增大后减小的趋势,与植物体内Cd2+浓度的变化趋势完全相反。相关分析结果表明(如表3所示),植株各部位的生物量与碳酸钙施加量并无显著相关关系,而与各部位对应的Cd2+浓度呈显著负相关(与根部、茎部、叶片的R2分别为-0.972、-0.963和-0.942,P<0.01)。实验结果与郭利敏等[31]和陈晓婷等[32]的研究结果相对应,Cd2+在植物体内的富集会抑制其生长,碳酸钙施加量较小时,Cd2+的富集受到抑制从而促进了植物生长;而当碳酸钙施加量较大时,植物中Cd2+浓度反而增加,由此造成生物量降低。

图2 不同CdCl2和碳酸钙施加量下的土壤样品pH动态变化Fig.2 Dynamic change of soil pH under different CdCl2 and calcium carbonate treatments
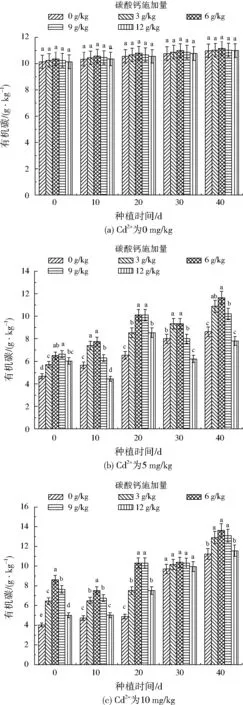
图3 不同CdCl2和碳酸钙施加量下的土壤样品有机碳质量浓度动态变化Fig.3 Dynamic change of soil organic carbon concentration under different CdCl2 and calcium carbonate treatments

图4 不同CdCl2和碳酸钙施加量下的植物生物量变化Fig.4 Biomass of plants under different CdCl2 and calcium carbonate treatments

表3 不同Cd2+下植物各部位生物量与碳酸钙施加量的相关系数1)Table 3 Correlation coefficient between biomass of each part of the plants and calcium carbonate concentration under various Cd2+ levels
注:1)rroot,y表示根部与碳酸钙施加量的相关系数,rstem,y表示茎部与碳酸钙施加量的相关系数,rleaf,y表示叶片与碳酸钙施加量的相关系数,表4同。
2.3 碳酸钙施用对潮土酶活性的影响
不同CdCl2及碳酸钙施加量下,土壤样品脲酶、碱性磷酸酶和过氧化氢酶活性变化如图5至图7所示。在外源Cd2+的条件下,3种酶活性均会明显降低(P<0.05),与KIZILKAYA等[15]100和DENG等[33]的研究结果基本一致。在无外源Cd2+的条件下,碳酸钙的施加不会对土壤中3种酶活性产生显著影响;而在有外源Cd2+污染土壤中,3种酶活性均会随碳酸钙施加量的增加呈先增大后减小的趋势,且极大值出现在施加量为6~9 g/kg(P<0.05)。
造成这种现象的原因,同上文所述,可能与Cd2+的微生物毒性变化有关。实验中的土壤脲酶、碱性磷酸酶和过氧化氢酶活性均与土壤有机碳浓度呈显著正相关关系(R2分别为0.823、0.821、0.762,P<0.05)。土壤有机碳浓度与微生物活性存在正相关关系[15]99,由此可见,土壤微生物活性变化会引发酶活性改变;而随碳酸钙施加量的增加,Cd2+的微生物毒性呈先减小后增大的趋势,由此造成土壤微生物活性及酶活性呈相同变化趋势。由图5至图7可知,在种植过程中,土壤样品中3种酶活性均会随种植时间的增加而明显增大(P<0.05),与有机碳浓度动态变化趋势一致,其原因同样可能在于Cd2+的微生物毒性随种植时间的增加而减小,进而造成土壤酶活性改变。
实验中土壤酶活性与小白菜的生长情况存在一定的相关关系。成熟小白菜各部位生物量与相应种植土(E组)中的3种酶活性相关系数如表4所示。实验中成熟小白菜根部、茎部、叶片的生物量与土壤脲酶、碱性磷酸酶和过氧化氢酶活性均呈显著正相关关系(P<0.01),其原因可能与土壤肥力有关。土壤脲酶、碱性磷酸酶和过氧化氢酶可以在一定程度上反映土壤微生物过程及肥力水平[15]96,[16]1142,[17]246,3者的活性越大,土壤中微生物的代谢机能越强,土壤肥力得到相应提高,促进植物体的生长过程,因而小白菜的生物量也会相应增加。

图5 不同CdCl2和碳酸钙施加量下的土壤样品脲酶活性变化Fig.5 Dynamic change of soil urease activity under different CdCl2 and calcium carbonate treatments

图6 不同CdCl2和碳酸钙施加量下的土壤样品碱性磷酸酶活性变化Fig.6 Dynamic change of soil alkaline phosphatase under different CdCl2 and calcium carbonate treatments
2.4 碳酸钙的最佳用量分析
为分析实验中碳酸钙的最佳用量,以碳酸钙施加量为自变量,植株体内Cd2+及土壤酶活性分别作为因变量进行回归分析,如表5和表6所示。由表5可知,碳酸钙施加量为7.5~8.2 g/kg时,植物体内的Cd2+浓度达到最低水平。由表6可知,碳酸钙施加量为4.0~8.4 g/kg时,土壤样品脲酶活性达到最大值;碳酸钙施加量为4.0~8.6 g/kg时,碱性磷酸酶活性达到最大值;碳酸钙施加量为3.2~9.5 g/kg时,过氧化氢酶活性达到最大值。综合分析可知,碳酸钙施加量为7.5~8.2 g/kg时,Cd2+的固定效果最佳,同时土壤酶活性达到最佳水平。

图7 不同CdCl2和碳酸钙施加量下的土壤样品过氧化氢酶活性变化Fig.7 Dynamic change of soil catalase under different CdCl2 and calcium carbonate treatments

表4 植株各部位生物量与土壤酶活性的相关系数1)Table 4 Correlation coefficient between biomass of each part of the plants and soil enzyme activities
注:1)“**”表示具有极显著相关性,P<0.01。
3 结 论
(1) 在Cd2+污染潮土中施加碳酸钙可以对Cd2+产生固定作用,同时也会影响潮土自身的性质。碳酸钙施加不会显著改变潮土pH,而潮土有机碳浓度随碳酸钙施加量的增加呈先增大后减小的趋势。碳酸钙施加会降低植株各部位对Cd2+的富集水平,且随碳酸钙施加量的增大而呈先减小后增大的趋势。

表5 植株各部位的Cd2+与碳酸钙施加量的回归分析结果1)Table 5 Regression analysis results of Cd2+ concentrations in each part of the plants and calcium carbonate concentration
注:1)回归方程为y=ax2+bx+c,其中:a、b、c均为常数;y为Cd2+质量浓度,mg/kg;x为碳酸钙施加量,g/kg;极值点表示植株体内Cd2+浓度最低时的碳酸钙施加量。

表6 潮土酶活性与碳酸钙施加量的回归分析结果1)Table 6 Regression analysis results of soil enzyme activities and calcium carbonate concentration
注:1)回归方程为y1=ax2+bx+c,其中:y1为土壤酶活性,单位根据酶类型确定,其余同表5。
(2) 碳酸钙同样会影响潮土中脲酶、碱性磷酸酶和过氧化氢酶的活性,3者的活性均会随碳酸钙施加量的增加而呈先增大后减小的趋势。随着种植时间的增加,土壤有机碳浓度及3种酶活性均呈不断增加的趋势。
(3) 各项指标与碳酸钙施加量的回归分析结果表明,碳酸钙作为潮土Cd2+固定剂的最佳施加量为7.5~8.2 g/kg,既可以达到最佳的Cd2+固定效果,同时保证微生物酶活性达到最大值,以保证土壤肥力水平。
[1] WONG S C,LI X D,ZHANG G,et al.Heavy metals in agricultural soils of the Pearl River Delta,South China[J].Environmental Pollution,2002,119(1):33-44.
[2] NICHOLSON F A,SMITH S R,ALLOWAY B J,et al.An inventory of heavy metals inputs to agricultural soils in England and Wales[J].Science of the Total Environment,2003,311(1/2/3):205-219.
[3] XIA Yunsheng,LI Fangbai,WAN Hongfu,et al.Spatial distribution of heavy metals of agricultural soils in Dongguan,China[J].Journal of Environmental Sciences,2004,16(6):912-918.
[4] GUO Guanlin,ZHOU Qixing,MA L Q.Availability and assessment of fixing additives for the in situ remediation of heavy metal contaminated soils:a review[J].Environmental Monitoring and Assessment,2006,116(1/2/3):513-528.
[5] ASHRAFI M,MOHAMAD S,YUSOFF I,et al.Immobilization of Pb,Cd,and Zn in a contaminated soil using eggshell and banana stem amendments:metal leachability and a sequential extraction study[J].Environmental Science and Pollution Research,2015,22(1):223-230.
[6] JALA S,GOYAL D.Fly ash as a soil ameliorant for improving crop production-a review[J].Bioresource Technology,2006,97(9):1136-1147.
[7] HU Xingming,YUAN Xinsong,DONG Ling.Coal fly ash and straw immobilize Cu,Cd and Zn from mining wasteland[J].Environmental Chemistry Letters,2014,12(2):289-295.
[8] GUO X F,WEI Z B,WU Q T,et al.Cadmium and zinc accumulation in maize grain as affected by cultivars and chemical fixation amendments[J].Pedosphere,2011,21(5).
[9] CIECKO Z,WYSZKOWSKI M,KRAJEWSKI W,et al.Effect of organic matter and liming on the reduction of cadmium uptake from soil by triticale and spring oilseed rape[J].Science of the Total Environment,2001,281(1/2/3):37-45.
[10] GHESHLAGHI Z T,MCLAREN R G,ADAMS J A.Effect of treated zeolite,iron waste,and liming on phytoavailability of Zn,Cu,and Ni in long-term biosolids-amended soils[J].Australian Journal of Soil Research,2008,46(7):509-516.
[11] LEE S H,LEE J S,JEONG C Y,et al.In situ stabilization of cadmium-,lead-,and zinc-contaminated soil using various amendments[J].Chemosphere,2009,77(8):1069-1075.
[12] UDOVIC M,LESTAN D.Pb,Zn and Cd mobility,availability and fractionation in aged soil remediated by EDTA leaching[J].Chemosphere,2009,74(10):1367-1373.
[13] WASAY S A,BARRINGTON S,TOKUNAGA S.Organic acids for the in situ remediation of soils polluted by heavy metals: soil flushing in columns[J].Water,Air & Soil Pollution,2001,127(1/2/3/4):301-314.
[14] 张亮.北京潮土中镉的生物有效性调控及其机理研究[D].北京:北京理工大学,2010.
[15] KIZILKAYA R,AKIN T,BAYRAKLI B,et al.Microbiological characteristics of soils contaminated with heavy metals[J].European Journal of Soil Biology,2004,40(2).

[17] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[18] LONG X X,YANG X E,NI W Z,et al.Assessing zinc thresholds for phytotoxicity and potential dietary toxicity in selected vegetable crops[J].Communications in Soil Science & Plant Analysis,2003,34(9/10):1421-1434.
[19] LIU Weitao,ZHOU Qixing,ZHANG Zhineng,et al.Evaluation of cadmium phytoremediation potential in Chinese cabbage cultivars[J].Journal of Agricultural and Food Chemistry,2011,59(15):8324-8330.
[20] 刘齐.复合重金属对土壤酶活性及生菜富集量影响研究[D].西安:西安科技大学,2009.
[21] 王志楼.典型矿区重金属污染特性及其土壤酶活性研究[D].上海:东华大学,2010.
[22] 陈青云,张晶,谭启玲,等.4种磷肥对土壤-叶菜类蔬菜系统中镉生物有效性的影响[J].华中农业大学学报,2013(1):78-82.
[23] ZHAO Xiulan,MASAIHIKO S.Fractionation and solubility of cadmium in paddy soils amended with porous hydrated calcium silicate[J].Journal of Environmental Sciences,2007,19(3):343-347.
[24] NAIDU R,KOOKANA R S,SUMNER M E,et al.Cadmium sorption and transport in variable charge soils:a review[J].Journal of Environmental Quality,1997,26(3):602-617.
[25] BOLAN N S,DURAISAMY V P.Role of inorganic and organic soil amendments on immobilisation and phytoavailability of heavy metals:a review involving specific case studies[J].Australian Journal of Soil Research,2003,41(3):533-555.
[26] MA L Q,RAO G N.Chemical fractionation of cadmium,copper,nickel,and zinc in contaminated soils[J].Journal of Environmental Quality,1997,26(1):259-264.
[27] HE Z L L,YANG X E,STOFFELLA P J.Trace elements in agroecosystems and impacts on the environment[J].Journal of Trace Elements in Medicine and Biology,2005,19(2/3):125-140.
[29] WANG Yuanpeng,SHI Jiyan,LIN Qi,et al.Heavy metal availability and impact on activity of soil microorganisms along a Cu/Zn contamination gradient[J].Journal of Environmental Sciences,2007,19(7):848-853.
[30] SUN Shujuan,XU Jian,DAI Shugui,et al.Influences of copper speciation on toxicity to microorganisms in soils[J].Biomedical and Environmental Sciences,2006,19(6):409-413.
[31] 郭利敏,艾绍英,唐明灯,等.不同改良剂对镉污染土壤中小白菜吸收镉的影响[J].中国生态农业学报,2010,18(3):654-658.
[32] 陈晓婷,王果.石灰与泥炭配施对重金属污染土壤上小白菜生长和营养元素吸收的影响[J].农业环境科学学报,2002,21(5):453-455.
[33] DENG S P,TABATABAI M A.Effect of tillage and residue management on enzyme activities in soils:Ⅲ.Phosphatases and arylsulfatase[J].Biology and Fertility of Soils,1997,24(2):141-146.

