不同硫酸蒽酮比色定糖法的比较


摘 要:为选定适合的实验室测糖方法,分别采用浓硫酸外加热法、稀硫酸外加热法及水合热法等设置的不同加热时间对蔗糖标准样品进行测试,并对其易操作性、数据稳定性等方面进行综合比较。结果表明,稀硫酸外加热法由于具有测定数据稳定性好、易于操作、药品用量少、吸光度值范围适宜、显色反应完全等优点,被确定为最合适的实验方法。
关键词:硫酸蒽酮法;比色定糖;实验方法
中图分类号:TG115.3+2 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.03.002
硫酸蒽酮比色法是植物营养和生理代谢中最常用的测糖方法[1-6],其原理是糖类(包括多糖)在硫酸的作用下,脱水生成糠醛或羟甲基糠醛,然后蒽酮与糠醛或羟甲基糠醛经脱水缩合产生蓝绿色的糠醛衍生物,在620 nm处有最大吸收。颜色深浅可作为定量的标准。该法由于所需试剂简单,操作方便,并具有较高的灵敏度,适于微量测定,已得到普遍应用。
在很多文献资料中,都有关于蒽酮比色法的介绍。但是不同作者所介绍的方法中,蒽酮试剂的用量、硫酸的浓度以及不同试剂与糖显色所需的时间等差异很大。总的来讲,可以概括为两大类,即外加热法和水合热法[7],外加热法又分为稀硫酸外加热法[8]和浓硫酸外加热法[9]。
本试验通过对3种常见的蒽酮比色定糖法进行比较,旨在找到最适合本化验室应用的实验方法。
1 材料和方法
1.1 试剂与仪器
标准样品:浓度分别为0,10,20,30,40,50,60 g·mL-1的葡萄糖标准溶液。
实验仪器:万分之一天平,日本岛津紫外分光光度计,离心机(4 000 r·min-1),三用恒温水浴锅。
实验试剂:分析纯硫酸,分析纯蒽酮。
1.2 方 法
方法1 浓硫酸外加热法:蒽酮试剂以浓硫酸加蒽酮配制,在冰水浴中加入浓硫酸,反应体系中水和硫酸的比例为1∶2.1,沸水浴中加热进行显色反应。
方法2 稀硫酸外加热法:蒽酮试剂以稀硫酸加蒽酮配制,在冰水浴中加入浓硫酸,本体系中水和硫酸的比例为1∶1.73。沸水浴中加热进行显色反应。
方法3 水合热法:蒽酮试剂用浓硫酸加蒽酮配制,在正常室温下加入浓硫酸,本反应体系中水和硫酸的比例为1∶2.6。显色反应利用蒽酮试剂中浓硫酸遇水放出的热。
以上3种方法均以0 μg的糖与蒽酮试剂的室温显色液作为零基准。每个试验方法重复3次,取3次重复的平均值进行分析。具体试剂配比见表1。
2 结果与分析
2.1 浓硫酸外加热法
在浓硫酸蒽酮试剂的反应体系中,水和浓硫酸的比值是1∶2.11,浓硫酸比例较大,因而水反应较易进行。虽然冰水浴温度低,但试剂仍可进行显色反应。在冰水浴中摇匀试管时,试剂溶液明显变绿,表明反应已经开始。每个样品加入硫酸蒽酮试剂的操作耗时约0.5 min。当实验中几个样品作为同一个批次加热时,操作必须严格按规程进行,在所有样品都加入试剂后再同时摇匀,以减少加样时间差异给显色反应带来的误差。
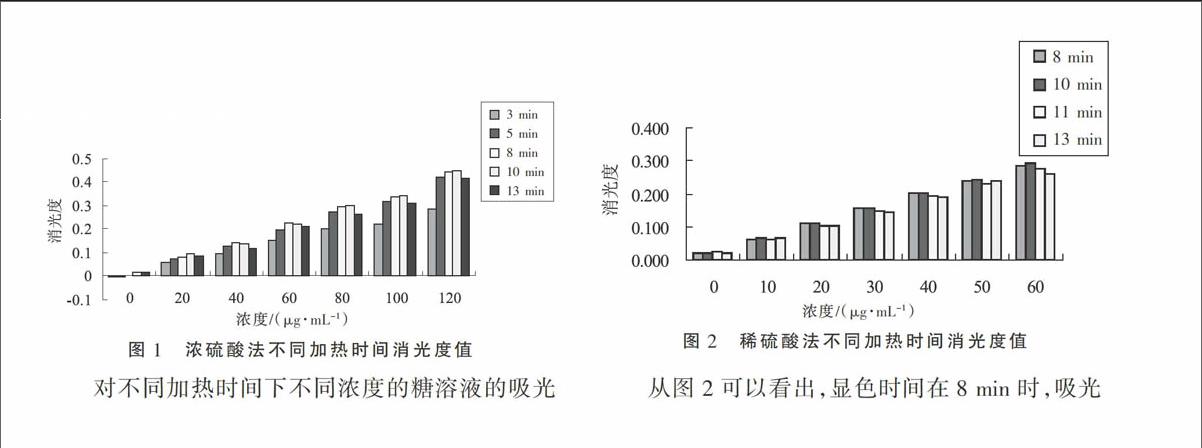
对数据进行整理后可以看出(图1),加热时间在3~5 min时,脱水显色反应尚未进行完全,消光值较小。当加热时间持续到8~10 min时,显色已完成,此时消光值最大。当加热时间延长到13 min时,消光值又变小了。实验中也观察到随着加热时间的延长,反应试液的颜色由8 min时的蓝绿色变为15 min时的灰绿色。这可能是由于过长的加热时间引起了糠醛衍生物的破坏,所以颜色逐渐消退[7]。
对不同加热时间下不同浓度的糖溶液的吸光度值进行相关分析后发现,5~8 min的加热时间具有较高的相关系数(表2),这说明在5~8 min时反应物比较稳定,数据的重现性好,但5 min时吸光度值较低,说明反应不完全,因此认为,对于浓硫酸加热法而言,以8 min的加热时间为最好,而林炎坤[7]、雷刚[10]等则认为3 min的加热时间吸光度值较高。
2.2 稀硫酸外加热法
在试验中我们看到,当稀硫酸蒽酮试剂加入到试管中时,试管中与试剂接触的糖溶液的颜色没有发生显色反应,摇匀后溶液的颜色仍为硫酸蒽酮试剂的颜色。这是因为稀硫酸蒽酮试剂的反应体系中,浓硫酸比例小,水和浓硫酸的比例是1∶1.73,在不加热的情况下,不会发生脱水反应。因此在加样过程中的时间差异,不会对显色反应产生影响,使试验操作易于控制,减少了误差的产生。
从图2可以看出,显色时间在8 min时,吸光度值仍较低,等到10 min时,消光值最高,11 min以后,消光值又开始下降。以上数据表明,稀硫酸外加热法加热10 min时,显色反应完全。
从表3可以看出,8~10 min的加热时间具有较高的相关系数,这说明在8~10 min时反应物比较稳定,数据的重现性好。但8 min时吸光度值稍低,显色反应不完全,因此认为对于稀硫酸加热法而言,以10 min的加热时间为最好。
2.3 硫酸水合热法
在水合热法中我们看到,当硫酸蒽酮试剂加入到试管中时,室温下即使不摇匀,试管内溶液也会立即发生显色反应。这是由于在水合热的反应体系中,浓硫酸比例大,水和浓硫酸的比例是1∶2.5,因此在不加热的情况下,硫酸就会与水发生水合作用放出热能,使反应系统自行升温达到充分显色。与前面两种实验方法比较起来,水合热法虽然操作相对方便些(不需加热),但对操作技术要求高,稍有疏忽,极易造成误差,测定结果准确性差、不稳定,易受室温变化的影响[10]。
从图3可以看出,水合热法不同浓度糖溶液的吸光度值与反应时间之间的规律性不明显,含糖量100 μg的糖溶液,反应在进行到15 min时吸光度值最大,而75 μg的糖溶液则13 min时吸光度值最低,但从整体上看以15 min时吸光度值最大。
从表4可以看出,在水合热法中,不同反应时间下标准样品中糖含量与吸光度值之间的相关系数比较低,这可能与加样时间的控制及水合放热反应不完全有关。
3 讨 论
根据上述的实验结果,可以从以下几个方面来比较3种实验方法的优劣。
3.1 操作条件易于控制
稀硫酸与糖溶液样品混合后,在冰水浴中没有水合现象,混合后不放热,试剂不反应,直到放入沸水浴后,才开始显色,这样在反应时间上每个试样就比较统一,实验条件易于控制,加样时间的先后,不会对测定结果产生影响。而另两种实验方法由于浓硫酸比例大,试剂与糖溶液混合后水合反应剧烈,立即发生显色反应,试剂加入的先后顺序影响到计时,使蒽酮试剂与糖样的显色时间难于掌握,因而直接影响到测定结果的准确性。
3.2 测定数据稳定性好
从测定的数据中可以看出,稀硫酸加热法的最大吸光度值稳定在10 min的加热时间上,重现性好。从对数据进行的相关分析上也可以看出,不同加热时间下,不同浓度糖溶液与吸光度值之间的相关系数均达到0.999以上。而其他两种试剂的最大吸光度值不稳定,重现性差,相关系数偏低。这也说明了稀硫酸加热法10 min时测定的数据稳定性最好。
3.3 药品用量经济
3种试验方法中,水与浓硫酸的比例分别为1∶2.11、1∶1.73和1∶2.6。每配制100 mL硫酸蒽酮试剂,硫酸用量分别为95,76,100 mL。因此,配制同样体积的试剂,稀硫酸外加热法硫酸消耗量最少,从试验成本上来讲最经济。
3.4 样品体积方便比色
3种试验方法中,显色后溶液的体积都不大,分别为7,6,9 mL。因此,每次润洗比色杯时都要小心进行,既要充分润洗,又要保证有充足的样品体积进行比色。相对而言,稀硫酸法体积量最小,比色时对操作技术要求最高。
3.5 显色反应进行完全
从测定的数据可以看出,外加热法显色反应的吸光度值要普遍高于水合热法。这说明水合热法水合放热的能量有限,显色反应不够完全。
按上述条件综合比较后认为,稀硫酸外加热法虽然样品体积量小,比色时要控制样品用量,但由于具有测定数据稳定性好、易于操作、药品用量少、吸光度值范围适宜、显色反应完全的优点,仍然是最适合本实验室应用的测糖方法[11]。
参考文献:
[1] 戴永平.不同添加剂对高水分一年生黑麦草青贮品质的影响[J].天津农业科学,2014,20(6):60-65.
[2] 黄国嫣,唐宗福,彭雅婷,等.不同树形对“丽江雪桃”光合作用强度及果实品质的影响[J].天津农业科学,2015,21(4):103-106.
[3] 周箬涵,郁继华,杨兵丽,等.不同氮素形态及配比对娃娃菜产量、品质及其养分吸收的影响[J].华北农学报,2015(3):216-222.
[4] 甘万祥,高巍,刘红恩,等.锌肥施用量及方式对夏玉米籽粒淀粉含量和产量的影响[J].华北农学报,2014(6):202-207.
[5] 张丽霞.不同光照强度对半夏生长的影响[J].天津农业科学,2015,21(4):110-112.
[6] 徐健程,黄海裙,张源生,等.干旱胁迫和复水对金沙柚生理变化的影响[J],广东农业科学,2015(16):12-18.
[7] 林炎坤.常用的几种蒽酮比色定糖法的比较和改进[J].植物生理学通讯,1989(4):53-55.
[8] 西北农业大学植物生理生化教研组.植物生理学实验指导[M].西安:陕西科学技术出版社,1987:113-116.
[9] 张志良.植物生理学实验指导员[M].北京:高等教育出版社,1990:160-162.
[10] 雷刚,胡志辉,陈禅友.蒽酮比色定糖法实验条件的改进探讨[J].长江蔬菜,2001(8):38-39.
[11] 刘桂茹.毛泡桐开花对树体营养消耗的影响[J].天津农业科学,2003,9(2):36-40.

