可见光下亚微米Cu2O微球光催化去除铜绿微囊藻*
赵 远 谷 娜# 李 恒 谢倩婷 吴云霞 秦会会
(1.河北科技大学理学院,河北 石家庄 050018;2.河北省药用分子化学重点实验室,河北 石家庄 050018;3.河北省药物化工工程技术研究中心,河北 石家庄 050018)
从20世纪80年代以来,全国各地的湖泊出现了不同程度的水质富营养化问题[1]。湖泊富营养化的直接后果就是导致蓝藻暴发,引发水华[2],降低水资源利用效能,引起严重的生态破坏及巨大的经济损失[3]。水华发生时,藻类物质浮在水体表面,形成浮渣,水体透明度下降,溶解氧降低,使整个水体生态平衡发生改变,对水生生物、人类健康、旅游业、沿岸的景观产生威胁[4]。
近些年,光催化技术开始用于蓝藻治理[5]1934,[6],[7]457。光催化半导体金属氧化物产生的·OH可以氧化藻细胞中的蛋白质、脂质和核酸,破坏藻细胞的胞囊,引起藻细胞解体[5]1937。Cu2O是一种重要的p型半导体材料,禁带宽度约为2.0 eV,在可见光区的吸收系数较高[8],能在可见光激发下催化降解有机物[9],而目前使用Cu2O光催化降解藻类物质的研究还鲜有报道。
铜绿微囊藻在我国富营养化水体中占据一定优势,是引起蓝藻水华的特征藻种[10]。本研究以铜绿微囊藻为研究对象,采用溶剂热法制备亚微米Cu2O微球,并研究该微球在可见光作用下去除铜绿微囊藻的性能,考察了其在可见光作用下去除藻细胞和藻细胞内含物的效果以及对藻类生长和藻细胞活性的影响。
1 实验部分
1.1 材料和仪器
材料:铜绿微囊藻,购自中科院水生生物研究所,编号为FACHB-942;乙酸铜、乙二醇、无水乙醇、葡萄糖、氢氧化钠、Cu2O、NaNO2、考马斯亮蓝、牛血清白蛋白、三氯乙酸、硫代巴比妥酸、抗坏血酸。实验中使用的化学试剂均为分析纯。
仪器:人工气候箱(MGC-300H)、生物显微镜(DMS600)、紫外—可见分光光度计(TU-1810PC)、低速台式离心机(TDZ5-WS)、高速冷冻离心机(GL-21M)、超净工作台(SW-CJ)、高压灭菌锅(YX-280A)、光化学反应仪、超声波细胞粉碎机(Scientz-Ⅱ)、溶解氧检测仪(美国HACH)、透射电子显微镜(TEM)(JEM-2100,日本JEOL)、X射线衍射(XRD)仪(SmartLab系列,日本Rigaku)、原子吸收光谱仪(AAS-100,美国Perkin Elmer)。
1.2 藻的培养及预处理
用BG-11培养基,在人工气候箱中进行培养,温度控制在(24±1) ℃,光照强度为2 000 lx,光暗比12 h∶12 h。实验所用仪器和配制的液体培养基均经过120 ℃的高温高压灭菌。在超净工作台中接种铜绿微囊藻,然后置于人工气候箱中培养。当铜绿微囊藻生长到对数期时,离心收取藻细胞,弃去上清液,再用去离子水配制成一定浓度的藻悬液(2.81×107个/mL),此浓度高于水华发生时水体中的藻细胞浓度(4.78×106个/mL)[11-12]。
1.3 Cu2O的制备
Cu2O的制备参考ZHANG等[13]337的方法,并进行了改进,具体操作如下:取1.0 g乙酸铜,溶解于10 mL去离子水、20 mL乙二醇、50 mL无水乙醇的混合溶液中,水浴加热至80 ℃,加入1.4 g氢氧化钠继续搅拌30 min,加入1.2 g葡萄糖反应3~4 min,冷却至室温,离心过滤,固体在70 ℃真空干燥5 h即得Cu2O。
1.4 除藻实验
在50 mL藻悬液中加入不同量的Cu2O,在光化学反应仪(300 W,氙灯)中模拟可见光下的除藻实验。放置灯管的冷阱外夹层填充2 mol/L的NaNO2溶液,以滤去波长<400 nm的紫外光,同时以未投加Cu2O的藻液作为空白对照。反应结束后,取样进行藻生理指标的测定。在黑暗条件下,采用相同用量的藻液和Cu2O进行除藻实验。每个处理设置3个平行。将反应后的藻液静置30 min,于液面下3 cm取样,测定叶绿素a浓度(采用乙醇萃取法[14])。
1.5 藻类的去除率计算方法
藻类的去除率以叶绿素a的去除率表征,计算如下[15]:
η=(1-c/c0)×100%
(1)
式中:η为叶绿素a的去除率,%;c0、c分别为实验前和实验后样品的叶绿素a质量浓度,μg/L。
1.6 藻类生理指标测定方法
可溶性蛋白含量的测定采用考马斯亮蓝法,参考BRADFORD[16]采用的方法进行;丙二醛(MDA)的含量采用硫代巴比妥酸法,参考UCHIYAMA等[17]采用的方法进行;藻细胞的生长代谢活性以藻细胞的光合放氧速率和呼吸耗氧速率表示,采用改良后的黑白瓶法[7]458,[18]测定。
1.7 Cu2+浓度的测定
采用原子吸收法测定体系中Cu2+浓度。
2 结果与讨论
2.1 亚微米Cu2O微球的微观表征
图1(a)为制备的亚微米Cu2O微球的XRD图,其在29.7°、36.7°、42.7°、61.6°和73.9°出现5个衍射峰,分别归属于立方相Cu2O的(110)、(111)、(200)、(220)和(311)晶面衍射[13]338。该XRD图中未出现Cu、CuO等的XRD特征峰,说明合成的Cu2O晶体很纯[19]。采用Debye-Scherrer方程,根据(111)晶面衍射峰计算Cu2O纳米粒子的平均粒径为10 nm。
图1(b)、图1(c)、图1(d)为制备的Cu2O的TEM图及电子衍射图。由图1(b)可以看出,制备的亚微米Cu2O微球具有较均一的形态,尺寸分布在400~500 nm;由图1(c)可以观察到Cu2O的晶格条纹,晶格间距为0.26 nm,对应Cu2O(111)晶面[20];图1(c)还可看出,单个Cu2O纳米粒子的粒径为10 nm左右,说明亚微米Cu2O微球是由粒径10 nm左右的Cu2O纳米粒子聚集而成;图1(d)可以看到,Cu2O有明显的(110)、(111)、(200)、(220)和(311)晶面衍射条纹。
2.2 Cu2O去除铜绿微囊藻的性能
2.2.1 藻类的去除率
叶绿素a的变化是表征除藻效果的重要参数。图2为在可见光及黑暗条件下加入不同量的Cu2O作用3 h后铜绿微囊藻的叶绿素a去除率。由图2可以看出,未添加Cu2O时,可见光照射3 h和黑暗条件下放置3 h,铜绿微囊藻的叶绿素a去除率为5.2%和1.3%,说明短时间可见光照射或黑暗条件下放置对铜绿微囊藻的影响较小。当铜绿微囊藻中加入Cu2O时,在黑暗条件下,叶绿素a去除率随Cu2O加入量的增加而增加,当Cu2O加入量达到0.5 g/L时,叶绿素a去除率为49.3%。在黑暗条件下,加入Cu2O后,铜绿微囊藻叶绿素a的降低可能是由于亚微米Cu2O微球对铜绿微囊藻细胞的吸附絮凝作用产生的,也可能是由于Cu2O溶解释放Cu2+[21]对藻细胞生长活性产生影响[22]。在可见光下,叶绿素a去除率随Cu2O加入量的增加而增加,高于黑暗条件下的去除率,当Cu2O加入量达到0.4 g/L时,叶绿素a去除率为80.4%,说明在可见光作用下,Cu2O受到激发,产生光催化降解藻细胞的作用;当Cu2O加入量达到0.5 g/L时,叶绿素a去除率反而有所下降,这可能是由于催化剂用量过大会影响光催化反应时催化剂吸收光的能力,进而影响光催化反应的效率。

图1 Cu2O的XRD图和TEM图Fig.1 XRD pattern and TEM images of Cu2O

图2 铜绿微囊藻的叶绿素a去除率Fig.2 Chlorophyll a removal rate of Microcystis aeruginosa
2.2.2 可溶性蛋白
图3为在可见光及黑暗条件下加入不同量的Cu2O作用3 h后铜绿微囊藻藻液的可溶性蛋白含量的变化。在可见光和黑暗条件下,与初始藻液的可溶性蛋白(120.2 mg/L)相比,不添加Cu2O时,可溶性蛋白含量变化不大,说明短时间可见光照射或黑暗放置对铜绿微囊藻影响不大。在黑暗条件下,加入不同量的Cu2O时,铜绿微囊藻的可溶性蛋白含量缓慢下降,说明在黑暗条件下,Cu2O对藻细胞的活性有一定影响,这可能是由于Cu2O溶解产生的少量Cu2+具有杀藻作用造成的。在可见光下,加入Cu2O后,铜绿微囊藻藻液的可溶性蛋白含量大幅下降,说明Cu2O的光催化作用可以降解藻细胞内含物。并且可见光下加入Cu2O后的可溶性蛋白含量低于黑暗条件下加入等量Cu2O时的可溶性蛋白含量,说明Cu2O的光催化产生了更强的抑藻作用。另外,由图3还可以看出,随Cu2O加入量的增加,可溶性蛋白含量减少,加入量为0.4 g/L时,可溶性蛋白含量最低,这种变化与叶绿素a去除率变化规律一致。因此,后续实验研究铜绿微囊藻的其他生长指标时,Cu2O加入量均为0.4 g/L。
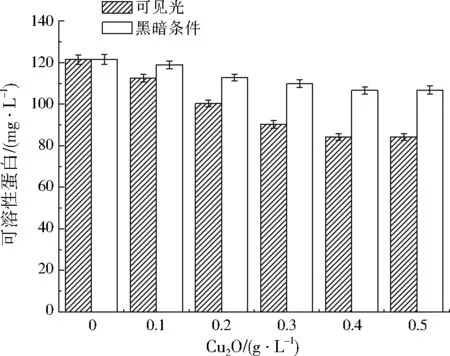
图3 铜绿微囊藻的可溶性蛋白变化Fig.3 Concentration variation of total soluble protein in Microcystis aeruginosa
2.2.3 细胞膜脂质过氧化
MDA是不饱和脂肪酸过氧化产物之一,其浓度可用作藻细胞膜脂质过氧化指标,体系中MDA浓度增加,说明藻细胞膜受到破坏。图4为可见光和黑暗条件下添加0.4 g/LCu2O不同时间后藻液中MDA浓度变化。由图4可以看出,在可见光下,随光催化反应时间的增加,MDA浓度不断增加;当反应进行到2 h时,MDA浓度达到最大值;当反应时间超过2 h以后,铜绿微囊藻MDA浓度下降。这主要是因为随反应时间的延长,藻细胞膜破坏释放出来的MDA继续被Cu2O光催化作用产生的活性自由基氧化,导致MDA浓度减少。在黑暗条件下,随着反应时间延长,MDA浓度逐渐增加,说明Cu2O本身对铜绿微囊藻细胞的细胞膜有一定破坏作用,但MDA浓度低于可见光下的MDA浓度,说明在光辅助下Cu2O对藻细胞膜的破坏作用较强,Cu2O的光催化作用促进了藻细胞的深度降解。
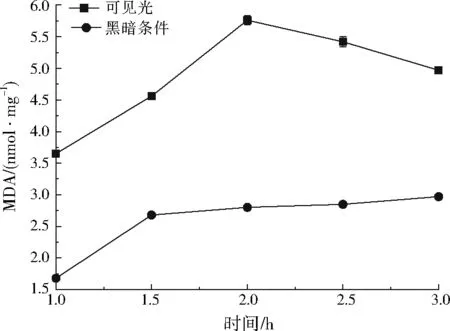
图4 铜绿微囊藻MDA变化Fig.4 MDA variation of Microcystis aeruginosa
2.2.4 藻细胞的光合放氧速率和呼吸耗氧速率
表1为实验中铜绿微囊藻的光合放氧速率和呼吸耗氧速率。由表1可知,经过0.4 g/L Cu2O光催化处理3 h后,铜绿微囊藻的光合放氧速率和呼吸耗氧速率远低于未加入光催化剂时的对照组,说明Cu2O光催化处理后,铜绿微囊藻光合作用能力和代谢活性降低,铜绿微囊藻的生长受到抑制。

表1 光合放氧速率和呼吸耗氧速率
2.2.5 藻细胞形态
图5为处理前后铜绿微囊藻的细胞形态。由图5(a)可以看出,铜绿微囊藻细胞呈现球形;由图5(b)可以看出,部分藻体细胞发生变形,不再是球形,说明Cu2O的光催化作用破坏了藻细胞的形态。
2.2.6 Cu2+浓度
上述分析表明,Cu2O在黑暗条件下具有一定去除铜绿微囊藻的作用,这可能是Cu2O部分溶解产生Cu2+,因此本研究测定了在黑暗条件下铜绿微囊藻藻液中刚加入Cu2O后及作用3 h后体系中Cu2+浓度,如图6(a)所示。由图6(a)可知,在黑暗条件下加入Cu2O后,体系中Cu2+浓度随Cu2O加入量增加而增加,当Cu2O质量浓度为0.5 g/L时,Cu2+质量浓度为0.373 mg/L,说明确实有少量的Cu2O溶解产生Cu2+,因此在黑暗条件下,Cu2O也会产生一定抑藻作用。体系中加入Cu2O 3 h后,Cu2O的质量浓度为0.5 g/L时,体系中残留Cu2+质量浓度为0.092 mg/L,低于《污水综合排放标准》(GB 8978—1996)总铜限值(0.5 mg/L),因此使用Cu2O除藻相对安全。图6(b)为0.5 g/LCu2O水溶液中24 h内Cu2+浓度随时间的变化。由图6(b)可以看出,加入0.5 g/LCu2O的水体中Cu2+质量浓度在0.4 mg/L以下,低于GB 8978—1996中总铜限值,因此使用Cu2O去除水体中藻类不会引起Cu2+的残留问题。

图5 铜绿微囊藻细胞形态Fig.5 Morphology of Microcystis aeruginosa
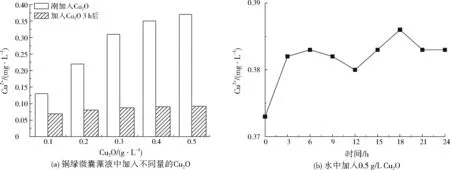
图6 加入Cu2O后Cu2+质量浓度Fig.6 Concentration of Cu2+ after adding Cu2O
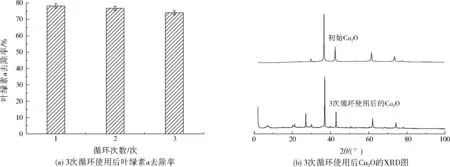
图7 Cu2O的循环使用Fig.7 Recycle of Cu2O
2.2.7 Cu2O的稳定性
将Cu2O从藻液中分离出来,用去离子水洗涤干燥后,再次进行可见光下的去除铜绿微囊藻的实验,叶绿素a去除率如图7(a)所示。由图7(a)可以看出,经过3次循环使用,铜绿微囊藻的叶绿素a去除率仅有少量降低。图7(b)为经过3次循环使用后Cu2O的XRD图,图中Cu2O的(110)、(111)、(200)、(220)和(311)衍射峰仍然存在,说明亚微米Cu2O微球具有很好的稳定性。
3 结 论
(1) 采用溶剂热法制备了由10 nm左右的纳米Cu2O颗粒聚集成的直径在400~500 nm的亚微米Cu2O微球。
(2) 亚微米Cu2O微球在可见光下具有较好的光催化降解铜绿微囊藻的效果,当Cu2O加入量为0.4 g/L时,3 h后叶绿素a去除率可达80.4%。
(3) 亚微米Cu2O微球的光催化作用可以破坏藻细胞膜,深度降解藻细胞内含物,降低藻细胞的代谢活性,阻止铜绿微囊藻的生长。
[1] 秦伯强,王小冬.太湖富营养化与蓝藻水华引起的饮用水危机——原因与对策[J].地球科学进展,2007,22(9):896-960.
[2] BEAULIEU S E,SENGCO M R,ANDERSON D M.Using clay to control harmful algal blooms: deposition and resuspension of clay/algal flocs[J].Harmful Algae,2005,4(1):123-138.
[3] 李静会,高伟,张衡,等.除藻剂应急治理玄武湖蓝藻水华实验研究[J].环境污染与防治,2007,29(1):60-62.
[4] ZOU Hua,PAN Gang,CHEN Hao,et al.Removal of cyanobacterial blooms in Taihu Lake using local soils.Ⅰ. Effective removal ofMicrocystisaeruginosausing local soils and sediments modified by chitosan[J].Environmental Pollution,2006,141(2):201-205.
[5] 尹海川,林强,柳清菊,等.纳米TiO2掺杂贵金属Pt抑制蓝藻的生长[J].功能材料,2005,36(12).
[6] YU Xiaojuan,ZHOU Jiangya,WANG Zhiping,et al.Preparation of visible light-responsive AgBiO3bactericide and its control effect on theMicrocystisaeruginosa[J].Journal of Photochemistry and Photobiology B:Biology,2010,101(3):265-270.
[7] 廖兴盛,汪星,赵开弘,等.UV-C光催化纳米TiO2对蓝藻生长影响的研究[J].武汉植物学研究,2007,25(5).
[8] LI Jiangying,XIONG Shenglin,PAN Jun,et al.Hydrothermal synthesis and electrochemical properties of urehin-like core-shell copper (Ⅰ) oxide nanostruetures[J].J. Phys. Chem. C,2010,114(21):9645-9650.
[9] 张文蓉,孙家寿,陈金毅,等.累托石/氧化亚铜纳米复合材料的制备及光催化性能研究[J].环境工程学报,2011,5(4):956-960.
[10] 李娟,王应军,高鹏.过氧化氢对铜绿微囊藻的损伤效应研究[J].环境科学学报,2015,35(4):1183-1189.
[11] 邹华,潘纲,陈灏.壳聚糖改性粘土对水华优势藻铜绿微囊藻的絮凝去除[J].环境科学,2004,25(6):40-43.
[12] 张普,董利英,乔俊莲,等.改性粉煤灰对铜绿微囊藻的去除效果及影响因素研究[J].水处理技术,2015,41(1):56-60.
[13] ZHANG Zailei,CHEN Han,SHE Xilin,et al.Synthesis of mesoporous copper oxide microspheres with different surface areas and their lithium storage properties[J].Journal of Power Sources,2012,217.
[14] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:670.
[15] 寻涛.高锰酸钾预氧化复合矿物质与PAC混凝去除水中颤藻的研究[D].青岛:青岛科技大学,2009.
[16] BRADFORD M M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[17] UCHIYAMA M,MIHARA M.Determination of malonaldehyde precursor in tissues by thiobarbitaric acid test[J].Analytical Biochemistly,1978,86(1):271-278.
[18] WINKLER M,HEMSCHEMEIER A,GOTOR C,et al.[Fe]-hydrogenases in green algae: photo-fermentation and hydrogen evolution under sulfur deprivation[J].International Journal of Hydrogen Energy,2002,27(11/12):1431-1439.
[19] 曾建强,王莉,谭一良,等.Cu2O亚微米空心球的低共熔溶剂辅助合成与表征[J].化学通报,2015,78(1):63-67.
[20] 马丽丽,余颖,黄文娅,等.多元醇法制备Cu2O/CNTs复合材料的研究[J].化学学报,2005,63(18):1641-1645.
[21] SUNADA K,MINOSHIM M,HASHIMOTO K.Highly efficient antiviral and antibacterial activities of solid-state cuprous compounds[J].Journal of Hazardous Materials,2012,235/236:265-270.
[22] 晋利,李晓亮.Cu2+对铜锈微囊藻生长及叶绿素荧光特性的影响[J].植物生理学报,2015,51(2):178-182.

