原花青素对小鼠急性痛风性关节炎的实验研究
刘海姣 范轶鑫 潘秀秀 姜来 刘文涛 张广钦
·实验研究·
原花青素对小鼠急性痛风性关节炎的实验研究
刘海姣 范轶鑫 潘秀秀 姜来 刘文涛 张广钦
目的利用小鼠急性痛风性关节炎模型,评估原花青素对于单钠尿酸盐(MSU)晶体诱发的关节肿胀及疼痛的治疗作用。方法将MSU晶体直接注射到小鼠踝关节腔,然后利用缚线法测定小鼠踝关节周径,Von Frey Hairs测定小鼠机械痛阈值,Western Blot检测P38的磷酸化水平,考察原花青素对急性痛风性关节肿胀和疼痛的治疗作用。结果原花青素给药组(15、30、60 mg/kg)的机械痛阈值、踝关节周径与模型组相比差异均具有统计学意义(P<0.05);与对照组相比,模型组的P38磷酸化水平显著升高(P<0.05);与模型组相比,原花青素给药组(15、30、60 mg/kg)的P38磷酸化水平显著降低(P<0.05)。结论原花青素可以通过抑制P38的磷酸化水平缓解急性痛风性关节肿胀和痛风痛。
原花青素;关节肿胀;痛风痛;P38
痛风主要是由嘌呤代谢异常等导致的尿酸生成增多或者尿酸排泄减少而引起的一种代谢型疾病[1]。当单钠尿酸盐以晶体的形式沉积在关节处时,可以诱发红、肿、热、痛等症状,给患者带来了极大痛苦[2]。令人遗憾的是,现有的抗痛风药物虽然具有一定的治疗作用,但效果远不能令人满意,并且长期使用往往具有肝肾损伤和胃肠道反应等副作用[3]。
巨噬细胞在痛风性关节炎中发挥着重要作用。尿酸盐在关节的沉积可以招募巨噬细胞在关节处的聚集,而活化的巨噬细胞能够释放多种炎症因子、趋化因子等,与此同时还能招募更多的炎症细胞的浸润,导致关节肿胀和疼痛[4]。以往的研究发现MSU结晶体可以诱发氧自由基(ROS)的产生,而ROS在巨噬细胞活化过程中发挥了重要作用[5,6]。ROS可以激活MAPK家族信号,进而激活NF-kB信号通路,释放白细胞介素-1β(IL-1β)、肿瘤坏死因子(TNF-α)等炎症因子,放大疼痛及炎症反应[7]。
原花青素是广泛存于葡萄籽、蓝莓的生物类黄酮,具有很强的抗氧化性即清除ROS的能力,其抗氧化性能是维生素C的20倍,维生素E的50倍。本研究拟考察原花青素对于小鼠关节腔注射MSU晶体诱发的急性痛风性关节炎的治疗作用并探讨其机制。现报告如下。
1 材料与方法
1.1 药物 原花青素(南京泽朗植提技术有限公司);尿酸钠(Sigma-Aldrich公司)。
1.2 动物 30只雄性CD-1小鼠,清洁级,体重18~22 g,由上海西普尔-必凯实验动物有限公司提供,实验动物使用许可证号:SCXK (沪) 2013-0016。
1.3 仪器 电泳仪(美国 Bio-Rad公司);化学发光仪(ChemiDoc XRS+,美国 Bio-Rad公司)。
1.4 方法
1.4.1 MSU晶体的制备 称取尿酸钠,加至1 mol/L的氢氧化钠中,再加入无菌生理盐水煮沸溶解,冷却至室温后,调节pH到7.2,离心吸取上清,室温静置2 d使MSU晶体析出,离心弃上清得MSU晶体,临用前经超声并且配置出所需浓度。
1.4.2 急性痛风模型的建立以及小鼠机械痛阈值和关节肿胀度的测定 小鼠使用水合氯醛(400 mg/kg,腹腔注射) 麻醉,将MSU晶体(0.5 mg/10 μl)注射至小鼠踝关节胫附踝关节腔,对照组注射等量的磷酸缓冲盐溶液(PBS)。采用缚线法测量小鼠踝关节周径,使用Von Frey Hairs测痛仪测量小鼠机械痛阈值。分别测量小鼠造模前和造模后不同时间点的周径,测量小鼠造模前和造模后不同时间点的机械痛阈值,并计算造模后周径与造模前周径的差值作为关节肿胀度的衡量标准。
1.4.3 原花青素对于P38磷酸化水平的影响 采用Western Blot 技术检测P38磷酸化水平变化。具体方法如下:于关节肿胀最高的点(24 h),采用腹腔给予水合氯醛溶液麻醉小鼠,取踝关节组织,加入蛋白质裂解液处理样品,离心取上清进行BCA定量,加5×Loading buffer,煮沸 5min,-80℃保存。根据BCA定量上样、电泳、转膜,室温封闭2 h后加入一抗过夜,TBST洗后二抗孵育2 h,TBST洗后显色。
1.5 统计学方法 采用SPSS12.0统计学软件对研究数据进行统计分析。计量资料以均数±标准差(±s)表示,采用t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 性质稳定的针尖样MSU晶体 晶体4℃保存1个月后形态没有显著改变,依旧具有稳定的晶体形态。图1(左)和图1(右)分别为刚制备和放置1个月后的MSU晶体。

图1 MSU晶体形态
2.2 原花青素对MSU晶体诱导的关节肿胀和机械痛阈的影响 实验动物分为5组,各6只,即对照组(注射PBS)、模型组(注射MSU晶体)、给药组(15、30、60 mg/kg原花青素,灌胃给药),实验结果表明:模型组可以诱发小鼠踝关节明显肿胀,而注射PBS组没有显著变化,模型组与对照组踝关节周径比较差异具有统计学意义(P<0.05),表明造模成功。在造模后24 h,模型组小鼠的踝关节周径平均增大了3.7mm,而原花青素给药组(15、30、60 mg/kg)的踝关节周径的肿胀程度显著降低,且与模型组比较差异均具有统计学意义(P<0.05)。见图2(左)。MSU晶体造模后8 h,可以诱发显著的机械性痛觉超敏,模型组小鼠的机械学痛阈值平均由1.334 g降为0.272 g,而对照组的机械学痛阈则没有显著改变,提示模型成功建立。原花青素能够缓解MSU晶体诱导的痛觉异常,且呈剂量依赖性。原花青素给药组(15、30、60 mg/kg)的机械痛阈值与模型组相比差异均具有统计学意义(P<0.05),其机械痛阈值分别为0.398 g、0.6 g、0.68 g。见图2(右)。
2.3 原花青素对踝关节组织处P38磷酸化水平的影响 与对照组相比,模型组的P38磷酸化水平显著升高(P<0.05)。与模型组相比,原花青素给药组(15、30、60 mg/kg)的P38磷酸化水平显著降低(P<0.05)。见图3。
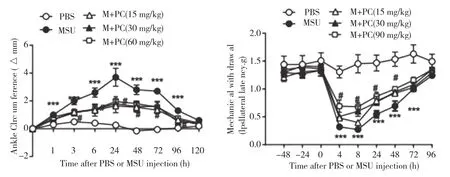
图2 原花青素对MSU晶体诱导的关节肿胀以及机械痛阈值的影响
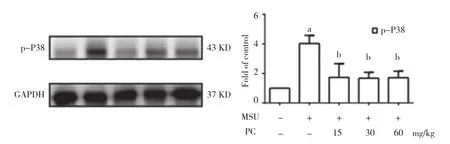
图3 原花青素对于踝关节组织处P38磷酸化水平的影响
3 讨论
现有的痛风治疗药物主要分为三类:第一类是以别嘌呤醇为代表的抑制尿酸合成的药物;第二类是以丙磺舒为代表的促进尿酸排泄的药物;第三类是以非甾体类抗炎药、秋水仙碱、类固醇类激素为代表的消炎镇痛药物。对于急性痛风性关节炎的治疗,往往使用第三类,即利用消炎镇痛药物来改善症状。然而非甾体类抗炎药的抗炎效果较弱,虽然可部分缓解急性痛风症状,但却易引起胃肠道反应等副作用。秋水仙碱作为治疗痛风的传统药物,不良反应更为常见,除胃肠道反应外甚至会引起骨髓抑制。而类固醇类激素虽然能起到消炎镇痛的效果,却不宜长期服用[3]。而本研究选择的药物原花青素来源广泛且具有很高的安全性,小鼠口服原花青素的LD50>4000 mg/kg,本研究中所用的最高剂量为60 mg/kg,相当于人剂量为6.67 mg/kg,这个剂量已经具有显著的抗炎与镇痛作用。与现有的镇痛药物相比,原花青素无疑具有巨大的安全优势。
以往研究已经发现炎症细胞尤其是巨噬细胞在急性痛风性关节炎中发挥着重要的作用。MSU晶体被巨噬细胞吞噬后,能招募更多的炎症细胞如中性粒细胞、肥大细胞等,进而释放释放许多炎症因子如IL-1β、TNF-α、前列腺素以及单核细胞趋化因子等,进而诱发了MSU沉积部位的关节肿胀或者疼痛[8]。本实验研究显示与模型组相比,原花青素组能显著抑制急性痛风性关节肿胀。MSU晶体诱导的急性痛风性疼痛在造模后8 h表现为疼痛最严重,与模型组相比,原花青素组能显著抑制机械学痛觉超敏。
MAPKs家族在急性痛风性炎症中发挥着至关重要的作用,其中以P38最为重要。在急性痛风性关节炎小鼠的滑液组织以及痛风患者的滑液中,P38的磷酸化水平均显著升高[9]。MSU诱发的组织损伤或者招募的炎症细胞释放的炎症因子均可以作用于P38-NF-kB信号系统,进而诱发炎症细胞释放更多的炎症因子与细胞因子,参与炎症放大。除了炎症反应,P38 还可以敏化瞬时型感受器电位离子通道V1 (TRPV1),对于疼痛的外周敏化极为重要。已有研究报道使用TRPV1拮抗剂能有效地减少MSU晶体诱导的疼痛和关节肿胀[10]。以往研究发现,MSU晶体可以诱发巨噬细胞中的ROS显著升高,ROS对于巨噬细胞中的P38激活具有非常重要的作用。而原花青素有着强大的自由基清除功能,我们的结果发现其能显著抑制MSU诱发的关节处P38的激活,这与前半部分的研究即原花青素有效缓解MSU晶体诱导的关节肿胀和机械性痛觉超敏相一致。
综上所述,原花青素能够抑制MSU晶体诱导的关节肿胀及机械痛,并能显著抑制P38的磷酸化水平。本研究为痛风的治疗提供了一种潜在的安全有效的药物,并可能为通过清除氧自由基抑制MAPK家族P38的异常升高,进而抑制炎症因子的产生来改善痛风性关节炎,提供了一种新的治疗策略。
[1]Choi HK,Mount DB,Reginato AM,et al.Pathogenesis of Gout.Ann Intern Med,2005,143(7):499-516.
[2]Roddy E,Zhang W,Doherty M.The changing epidemiology of gout.Nat Clin Pract Rheumatol,2007,3(8):443-449.
[3]Rees F,Hui M,Doherty M.Optimizing current treatment of gout.Nat Rev Rheumatol,2014,10(5):271-283.
[4]Martinon F,P étrilli V,Mayor A,et al.Gout-associated uric acid crystals activate the NALP3 inflammasome.Nature,2006,440(7081):237-241.
[5]Tschopp J,Schroder K.NLRP3 inflammasome activation: The convergence of multiple signalling pathways on ROS production? Nat Rev Immunol,2010,10(3):210-215.
[6]Zhou RB,Tardivel A,Thorens B,et al.Thioredoxin-interacting protein links oxidative stress to inflammasome activation.Nat Immunol,2010,11(2):136-140.
[7]Son Y,Kim S,Chung HT,et al.Reactive oxygen species in the activation of MAP kinases.Methods Enzymol,2013(528):27-48.
[8]Ramonda R,Oliviero F,Galozzi P,et al.Molecular mechanisms of pain in crystal-induced arthritis.Best Pract Res Clin Rheumatol,2015,29(1):98-110.
[9]Lu F,Liu L,Yu DH,et al.Therapeutic effect of Rhizoma Dioscoreae Nipponicae on gouty arthritis based on the SDF-1/CXCR 4 and p38 MAPK pathway: an in vivo and in vitro study.Phytother Res,2014,28(2):280-288.
[10]Hoffmeister C,Trevisan G,Rossato MF,et al.Role of TRPV1 in nociception and edema induced by monosodium urate crystals in rats.Pain,2011,152(8):1777-1788.
Experimental research of procyanidine for acute gouty arthritis in rats
LIU Hai-jiao,FAN Yi-χin,PAN Xiu-χiu,et al.Teaching and Research Office of Clinical Pharmacy,China Pharmaceutical University,Nanjing 211198,China
ObjectiveTo evaluate curative effect by procyanidine for monosodium urate (MSU) crystals -induced arthrocele and pain on the basis of acute gouty arthritis rats model.MethodsAfter injection of MSU crystals into rats ankle joint cavity,thread test was applied to measure ankle diameter,Von Frey Hairs test was used to detect pain withdrawal mechanical threshold value,and Western Blot test was applied for phosphorylation level detect in P38,in order to investigate curative effect by procyanidine for acute gouty arthrocele and pain.ResultsProcyanidine medication groups (15,30,60 mg/kg) and model group had statistically significant difference of pain withdrawal mechanical threshold value and ankle diameter (P<0.05).Comparing with control group,model group had obviously higher P38 phosphorylation level (P<0.05).In comparison with model group,procyanidine medication groups (15,30,60 mg/kg) had much lower P38 phosphorylation level (P<0.05).ConclusionProcyanidine can relieve acute gouty arthrocele and gout pain by inhibiting P38 phosphorylation level.
Procyanidine; Arthrocele; Gout pain; P38
10.14164/j.cnki.cn11-5581/r.2016.22.127
2016-10-31]
国家自然科学基金资助项目 (项目编号:81471142)
211198 中国药科大学/临床药学教研室(刘海姣范轶鑫 张广钦);南京医科大学/江苏省神经退行性疾病重点实验室(潘秀秀 姜来 刘文涛)
张广钦

