阶段控温提高透明质酸酶在毕赤酵母中的表达
张 娜, 李江华*, 金 鹏, 堵国成, 陈 坚, 康 振
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
阶段控温提高透明质酸酶在毕赤酵母中的表达
张 娜1,2, 李江华*1,2, 金 鹏1,2, 堵国成1,2, 陈 坚1,2, 康 振1,2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
透明质酸酶(Hyalurondiase,HAase)是一种具有医药作用的水解酶,为了提高HAase在重组毕赤酵母中的分泌表达量,对重组毕赤酵母诱导阶段的温度进行了优化。研究发现,降低诱导温度可以提高HAase的产量,其中两阶段控制温度诱导策略效果最为显著。诱导阶段0~60 h温度控制在25℃,60~96 h温度控制在22℃,HAase酶活最高为1.18×106U/mL,是诱导温度为30℃时(4.53×105U/mL)的2.6倍。此外,采用两阶段控制温度诱导策略有利于细胞活性的提高和AOX1启动子的表达。两阶段控制温度诱导策略还可以应用到其他酵母表型中,为毕赤酵母高效表达外源蛋白质提供一种新思路。
透明质酸酶;毕赤酵母;两阶段控制温度;分泌表达
透明质酸酶(Hyalurondiase,HAase)是一种降解透明质酸的水解酶,广泛存在于动物组织与微生物中。根据HAase的作用机制,将其分为3大类[1]:第一类为内切-β-N-乙酰氨基葡糖苷酶,作用于β-1,4-糖苷键,主要产物为四糖,主要来源于哺乳动物;第二类为内切-β-N-乙酰氨基葡糖苷酶,作用于β-1,4-糖苷键,通过β-消去机制得到4,5-不饱和双糖,主要来源于细菌;第三类为内切-β-葡糖苷酸酶,作用于β-1,3-糖苷键,主要来源于水蛭。目前市场上出售的HAase主要是从活体的牛和羊的睾丸组织中提取,存在杂蛋白质较多,纯度较低,免疫原性较强等问题。而重组的水蛭HAase没有任何交叉感染,因此重组水蛭HAase可以应用于治疗临床医疗如眼科、内科和外科手术等。此外重组水蛭HAase能专一性的降解透明质酸,产物在窄普基质范围内[2-3],可以用它来获得小分子透明质酸。
近年来,HAase已经在枯草芽孢杆菌和毕赤酵母中实现了表达,HAase在枯草芽孢杆菌中的产量达到1.50×104U/mL[4],在毕赤酵母中的产量为6.31× 104U/mL[5],这说明毕赤酵母作为HAase的表达宿主具有无可比拟的优势,同时通过基因工程手段表达重组HAase也突破了水蛭原料来源的限制和繁琐提取分离步骤等因素的限制,能够推动HAase在医疗和科研上的广泛应用。然而目前报道的毕赤酵母中的HAase的表达量依然较低距离实现工业化还有一段距离,因此如何提高HAase在毕赤酵母中的表达量是一个亟待解决的问题。外源蛋白质在毕赤酵母中表达,发酵培养条件是提高其表达量很重要的因素,在发酵培养条件中,温度是影响细胞生长和目的蛋白质产率及稳定性的一个重要因素[6-8]。降低温度可以降低细胞的死亡率,同时也可以降低目的蛋白质的降解[9-10],提高AOX转录水平[11]。
作者在构建表达重组HAase的毕赤酵母重组菌株的基础上研究诱导温度对HAase表达的影响,通过改变诱导温度来提高HAase的表达量,同时为提高外源蛋白质在毕赤酵母工程菌中的高效表达提供一种新的策略。
1 材料与方法
1.1 材料
1.1.1 菌株 P.pastoris GS115-HAase由作者所在实验室构建,其特性以P.pastoris GS115为宿主,整合来自水蛭的透明质酸酶基因 (GenBank登录号KJ026763),同时具有His+和Mut+表型。
1.1.2 培养基
1)YPD活化培养基(g/L):酵母提取物 10,蛋白胨20,葡萄糖20。装液量为50 mL培养基/500 mL三角瓶。
2)分批发酵培养基 BSM (g/L):CaSO4·2H2O 0.93,K2SO418.2,MgSO4·7H2O 14.9,KOH 4.13,甘油40.0;85%磷酸 26.7 mL,PTM1 4.35 mL。装液量为800 mL培养基/3 L发酵罐。
3)PTM1(g/L):CuSO4·5H2O 6,KI 0.09,MnSO4· H2O 3,H3BO30.02,MoNa2O4·H2O 0.2,CoCl20.5,ZnCl220,FeSO4·7H2O 65,生物素 0.2;浓H2SO45.0 mL。
1.2 方法
1.2.1 摇瓶培养 划线活化菌种,挑取单菌落接种于YPD培养基中,于30℃、200 r/min培养24 h。
1.2.2 高密度分批发酵培养 将摇瓶培养的YPD种子液以10%的接种体积分数接种到3 L全自动发酵罐(LiFlus GM BioTRON,Korea)中,温度控制在30℃,使用25%氨水调节pH 5.5,初始搅拌转速为500 r/min,通气量为2.5 L/min,溶氧维持在30%以上。培养28 h,OD600约70~80待甘油耗尽,流加50 g/dL甘油(含12 mL/L PTM1),停止补料待甘油再次耗尽,OD600约220(干重约60 g/L),流加100%甲醇(含12 mL/L PTM1),甲醇的质量浓度控制在18 g/L[12],诱导温度分别采用30、25、22℃及两阶段控制温度诱导策略。
1.2.3 菌体浓度测定
1)OD600测定方法:将发酵液用pH 6.0的磷酸盐缓冲液稀释合适倍数,在600 nm下测定吸光值。
2)菌体干重的测定方法:取10 mL发酵液,10 000 r/min离心10 min,菌体使用pH 6.0磷酸盐缓冲液重悬,洗涤两次,放置于105℃烘箱,烘干至恒质量,称量并计算菌体干重(g/L)。
1.2.4 细胞活力测定 亚甲基兰染色法[10]:将稀释好的发酵液以1∶1加入0.4%亚甲基兰,染色2~3 min。
细胞活力=(细胞总数-染色的细胞数)/细胞总数。
1.2.5 醇氧化酶AOX活力测定 醇氧化酶活力单位(1U)定义为:每分钟产生1 μmoL的过氧化氢所需的酶量。酶活力测定方法见文献[13]。
1.2.6 水蛭透明质酸酶活力测定 水蛭透明质酸酶的活力单位定义为:在pH 5.5和38℃下,每小时从透明质酸中释放1 μg葡萄糖还原当量的还原糖所需的酶量。
酶活力测定方法采用DNS法[14]。具体的测定方法为:反应体系共3 mL,2 mL DNS溶液中分别加入0,50,75,100,125,150,175,200 μL的葡萄糖标准液 (2 mg/mL),加水补足到3 mL,沸水浴煮沸10 min,冷却至室温,加水补足到10 mL,在540 nm下测定吸光度,以吸光度为横坐标,以葡萄糖质量浓度为纵坐标制作标准曲线。
样品的测定需要配置如下试剂:2 mg/mL透明质酸,50 mmol/L、pH 5.5柠檬酸-磷酸氢二钠缓冲液。反应体系1 mL,800 μL透明质酸,稀释一定倍数的发酵上清液,缓冲液补足1 mL,38℃水浴锅中反应15 min,用1 mL反应的样品代替葡萄糖标准液,测定吸光值代入标准曲线求得还原当量的葡萄糖质量浓度,根据水蛭透明质酸酶的活力定义,进一步求得透明质酸酶酶活。
2 结果与分析
温度对毕赤酵母生长和重组蛋白质的表达具有很重要的影响,主要通过影响菌体的生长和细胞代谢。温度升高菌体胞内代谢加速,使得菌体过早的老化,过低的温度影响胞内酶的活性,从而影响胞内代谢,最终影响菌体的生长和重组蛋白质的表达。
2.1 诱导温度对菌体浓度和HAase表达的影响
毕赤酵母生长温度为28~30℃,考虑到过高的温度会造成菌体过早的衰老,一定程度的降低温度有利于重组酶的表达,因此考察了不同温度(30、25、22℃)对HAase表达的影响,发酵结果见图1—3。不同诱导温度对菌体干重影响较小,对HAase表达较大。当温度为30℃时,诱导72 h,菌体干重最高达到182.7 g/L,HAase酶活最高为4.53×105U/mL。72 h后,随着溶氧反弹,菌体干重缓慢降低,同时HAase酶活也缓慢下降,可能温度过高造成细胞不利的影响;诱导温度为25℃时,诱导90 h菌体干重最高为187.6 g/L,HAase酶活最高为8.56×105U/mL,为诱导温度30℃的1.89倍;诱导温度为22℃时,诱导90 h菌体干重最高为189.8 g/L,HAase酶活最高为1.04×106U/mL,为诱导温度30℃的2.3倍。由不同诱导温度对HAase表达的影响可知,降低温度有利于HAase的表达。

图1 诱导温度为30℃时的分批发酵培养对HAase酶活的影响Fig.1 Effect of induction temperature 30℃ on the HAase by fed-batch fermentation

图2 诱导温度为25℃时的分批发酵培养对HAase酶活的影响Fig.2 Effect of induction temperature 25℃ on the HAase by fed-batch fermentation

图3 诱导温度为22℃时的分批发酵培养对HAase酶活的影响Fig.3 Effect of induction temperature 22℃ on the HAase by fed-batch fermentation
2.2 诱导温度对细胞活力的影响
前期研究表明,表达阶段温度降低与细胞生长和细胞活性呈现正相关[9],对不同诱导温度下的细胞活力进行测定,结果见图4。诱导温度为30℃时,诱导48 h时细胞活力降低到80%,诱导96 h时细胞活力下降到40%以下。诱导温度为25℃时,诱导0~60 h,细胞活力维持在90%以上,60~96 h,细胞活力维持在80%以上。诱导温度为22℃时,诱导0~ 96 h细胞活力维持在90%以上。由不同诱导温度对细胞活力的影响可知,高温对细胞活力不利,可能是温度过高导致细胞提前衰亡,从而影响细胞活力。

图4 不同诱导温度对细胞活力的影响Fig.4 Effect of different induction temperature on the cell viability
2.3 诱导温度对醇氧化酶AOX酶活力影响
温度还能影响AOX酶活性,降低温度可提高AOX基因转录水平3~5倍[14],故考察不同诱导温度对AOX酶活力的影响,结果见图5。诱导温度为30℃时,诱导36 h,AOX酶活达到最高值1 251 U/mL。诱导96 h,AOX酶活下降为804 U/mL;当诱导温度为25℃时,诱导60 h,AOX酶活最高达到1 530 U/mL。诱导96 h时,AOX酶活为1 410 U/mL;诱导温度为22℃时,诱导60 h,AOX酶活最高为1 653 U/mL。诱导96 h,AOX酶活力维持在1 621 U/mL且较稳定。由温度对AOX酶活的影响可知,降低温度能够提高AOX酶活力。
2.4 两阶段控制温度诱导策略对HAase表达影响
由不同诱导温度下细胞活力与醇氧化酶AOX酶活力的影响,结合HAase的发酵过程,发现当诱导温度分别为25℃与22℃时,诱导0~60 h,细胞活力维持在90%以上,AOX酶活力达到最高,且HAase酶活力增加速度几乎相同。60~96 h,两个诱导温度下有明显的区别,诱导温度为25℃时,细胞活力下降到80%,AOX酶活力缓慢下降。而诱导温度为22℃时,细胞活力维持在90%以上,AOX酶活力几乎稳定且HAase酶活力增加速度加快。基于此研究结果,我们提出了一个两阶段控制温度诱导策略即诱导0~60 h,温度控制为25℃;60~96 h,温度控制为22℃,结果见图6。采用两阶段控制温度诱导策略,诱导60~72 h细胞活力和AOX酶活力缓慢增加,72~96 h几乎不变,同时HAase表达速度加快,诱导96 h,菌体干重为190 g/L,HAase酶活最高达到1.18×106U/mL,是诱导温度30℃的2.6倍。因此,两阶段控制温度诱导策略比单一的降低温度更有利于外源蛋白质的表达。
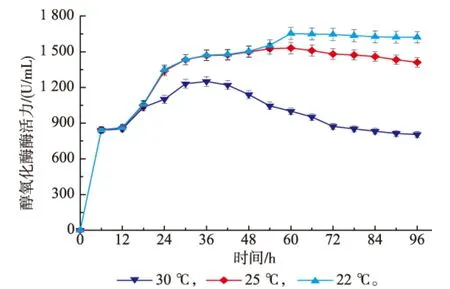
图5 不同诱导温度对醇氧化酶AOX酶活力的影响Fig.5 Effect of different induction temperature on the AOX activity
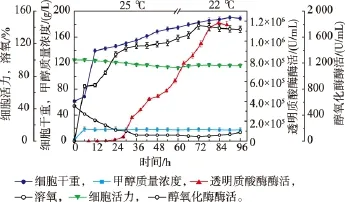
图6 两阶段控制温度诱导策略的分批发酵培养对HAase表达影响Fig.6 Effect of two-stage temperature induction strategy on the HAase by fed-batch fermentation
3 结语
通过研究不同诱导温度对细胞活力、AOX酶活力以及HAase酶活力的影响,确定了一种最适诱导表达HAase的策略,即两阶段控制温度诱导策略,采用此策略后,HAase酶活最高达到1.18×106U/ mL,是诱导温度30℃的2.6倍,实现了HAase在毕赤酵母中的高效表达,说明两阶段控制温度诱导策略更能提高HAase的表达,为毕赤酵母提高外源蛋白质表达提供了一种新思路,同时为实现HAase的工业化生产奠定了基础。此外进一步通过对毕赤酵母表达系统的上游进行优化,进一步提高HAase的表达。
[1]EL-SAFORY N S,FAZARY A E,LEE C K.Hyaluronidases,a group of glycosidases:current and future perspectives[J]. Carbohydrate Polymers,2010,81(2):165-181.
[2]LINKER A,HOFFMAN P,MEYER K.The hyaluronidase of the leech:an endoglucuronidase[J].Nature,1957,180(2):810-811.
[3]LINKER A,MEYER K,HOFFMAN P.The production of hyaluronate oligosaccharides by leech hyaluronidase and alkali[J]. Biology and Chemistry,1960,235(2):924-927.
[4]GUO X P,SHI Y L,SHENG J Z,et al.A novel hyaluronidase produced by Bacillus sp.A50[J].Plos One,2014,9(4):156-164.
[5]JIN P,KANG Z,ZHANG N.High-yield novel leech hyaluronidase to expedite the preparation of specific hyaluronan oligomers [J].Scientific Reports,2014,4(2):4471-4479.
[6]LAURENT P,BUCHON L,GUESPIN-MICHEL J F,et al.Production of pectate lyases and cellulases by Chryseomonas luteola strain MFCL0 depends on the growth temperature and the nature of the culture medium:evidence for two critical temperatures[J]. Applied Environmental Microbiology,2000,66(4):1538-1543.
[7]HONG F,MEINANDER N Q,JONSSON L J.Fermentation strategies for improved heterologous expression of laccase in Pichia pastoris[J].Biotechnology and Bioengineering,2002,79(4):438-449.
[8]WOO J H,LIU Y Y,STAVROU S,et al.Increasing secretion of a bivalent anti-T-cell immune toxin by Pichia pastoris[J]. Applied Environmental Microbiology,2004,70(6):3370-3376.
[9]LI Z J,XIONG F,LIN Q S,et al.Low temperature increases the yield of biologically active herring antifreeze protein in Pichia pastoris[J].Protein Expression and Purification,2001,21(4):438-445.
[10]SINHA J,PLANTZ B A,INAN M,et al.Causes of proteolytic degradation of secreted recombinant proteins produced in methylotrophic yeast Pichia pastoris:case study with recombinant ovine interferon-t[J].Biotechnology and Bioengineering,2005,89(1):102-112.
[11]LING Z M,MA T,LI J,et al.Functional expression of trypsin from Streptomyces griseus by Pichia pastoris[J].Microbiology and Biotechnology,2012,39(11):1651-1662.
[12]SUYE S,OGAWA A,YOKOYAMA S,et al.Screening and identification of Candida methanosorbosa as alcohol oxidase producing methanol using yeast[J].Agricultural Biology and Chemistry,1990,54(5):1297-1298.
[13]GHOSE T.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,59(2):257-268.
Enhanced Expression of Hyalurondiase in Pichia pastoris by Two-Stage Temperature Induction Strategy
ZHANG Na1,2, LI Jianghua*1,2, JIN Peng1,2, DU Guocheng1,2, CHEN Jian1,2, KANG Zhen1,2
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Hyalurondiases(HAase)are a kind of hydrolases with medicine values.In order to improve the expression of HAase in the recombinant Pichia pastoris,the effect of induction temperature on HAase expressed was investigated in the recombinant P.pastoris.The result showed that the production of HAase could be improved with the decrease of induction temperatures,especially,two-stage temperature induction strategy.In this strategy,temperature was controlled at 25℃during the induction stage 0~60 h,and then shifted to 22℃after 60 h.HAase activity reached to 1.18×106U/mL,2.6 fold improvement compared to induction temperature at 30℃(4.53×105U/mL).In addition,two-stage temperature induction strategy had an advantage on cell viability and alcohol oxidase activity,which offered a new strategy for expression of exogenous protein in the recombinant P.pastoris.
hyalurondiase,Pichia pastoris,two-stage control temperature,secretion expressed
Q 93
A
1673—1689(2016)12—1273—05
2014-10-10
国家自然科学基金项目(31670092);江苏省科技支撑计划项目(BE2014607)。
*通信作者:李江华(1966—),男,江西修水人,工学博士,教授,博士研究生导师,主要从事酶技术发酵过程优化与控制方面的研究。E-mail:lijianghua@jiangnan.edu.cn

