酿酒酵母和异常汉逊酵母在酿酒过程中的相互作用
颜 兵, 江 月, 梁若楠, 吴轩德, 周世水
(华南理工大学生物科学与工程学院,广东广州 510006)
酿酒酵母和异常汉逊酵母在酿酒过程中的相互作用
颜 兵, 江 月, 梁若楠, 吴轩德, 周世水*
(华南理工大学生物科学与工程学院,广东广州 510006)
摘要[目的]探究酿酒酵母与异常汉逊酵母在半固态白酒酿造过程中的相互作用。[方法]在白酒酿造过程中,通过对微生物纯培养和混合培养过程中微生物数目变化、理化指标变化来探究酿酒酵母与异常汉逊酵母间的相互作用。[结果]在酿酒酵母、异常汉逊酵母共培养过程中,异常汉逊酵母经过24 h短暂生长后迅速衰亡;对可能引起异常汉逊酵母衰亡的因子包括碳源、酒精度、pH、酵母无细胞滤液的初步研究,发现在酿酒酵母无细胞滤液和混合酵母无细胞滤液中,异常汉逊酵母生长受到明显抑制而酿酒酵母生长正常。[结论]异常汉逊酵母和酿酒酵母共培养时,异常汉逊酵母的生长受到明显抑制,酿酒酵母的代谢产物是抑制其生长的主要原因。
关键词酿酒酵母;异常汉逊酵母;酿酒;相互作用
酵母是白酒酿造过程中的主要功能微生物,根据其在发酵过程中的作用,主要分为两大类:一类是酿酒酵母,在白酒酿造中主要起产酒精的作用,一般具有高的酒精发酵力[1];另一类是非酿酒酵母,主要为产酯酵母,它的产酒精能力较弱,但是在白酒酿造中可以将发酵中的原料前提物质转化为白酒的重要风味物质如醛、酯、高级醇等[2]。因此,酿酒酵母和非酿酒酵母常一起用于白酒的酿造。有研究表明,葡萄酒酿造过程中,在发酵初期非酿酒酵母发挥主要作用,但在发酵1~3 d后,酿酒酵母逐渐取代非酿酒酵母而成为优势菌株。出现这种情况的原因可能是酿酒酵母与非酿酒酵母对外界环境的抵抗力差异造成的,如营养物质的消耗、酒精度的提高、有机酸的增加、代谢物的产生都可能会抑制非酿酒酵母的生长[3-5]。
目前,对酿酒酵母与非酿酒酵母的研究主要集中在葡萄酒酿造过程中,而白酒酿造过程中研究的比较少。因此,笔者通过对共培养过程中的碳源、酒精度、有机酸和酵母代谢物的研究,确定白酒酿造过程中影响异常汉逊酵母生长的主要因子,为白酒的生产酿造提供借鉴和依据。
1材料与方法
1.1材料
1.1.1菌种 。酿酒酵母,华南理工大学生物科学与工程学院保藏;异常汉逊酵母(GIM2.18),广东微生物菌种保藏中心保藏。
1.1.2培养基。麦芽汁培养基(固体):加入15 g/L琼脂的麦芽汁(10°p)。米酒发酵培养基:按粉碎大米∶水=1∶8的比例混合均匀,93 ℃糊化30 min,冷却至60 ℃加入糖化酶(3‰,以大米计)糖化2 h,冷却后双层纱布过滤,煮沸15 min,121 ℃灭菌20 min。
1.2方法
1.2.1酿酒酵母和异常汉逊酵母的耐酒精试验。配制酒精浓度为0%vol、6%vol、8%vol、10%vol、12%vol、14%vol的灭菌米酒发酵培养基。接入菌株后在30 ℃静置培养24 h,测定菌体浓度,使OD600nm在0.20~0.80。
1.2.2酿酒酵母与异常汉逊酵母相互作用研究。
1.2.2.1发酵过程微生物数量的变化。酿酒酵母和异常汉逊酵母纯培养: 将异常汉逊酵母、酿酒酵母分别接种到50 mL米酒发酵培养基中,接种量2.5×106CFU/mL,32 ℃条件下静置培养8 d。每隔24 h取样,稀释平板法测定异常汉逊酵母、酿酒酵母的数量。
异常汉逊酵母和酿酒酵母共培养:接种异常汉逊酵母和酿酒酵母到50 mL米酒发酵培养基,接种量2.5×106CFU/mL,32 ℃条件下,静置培养8 d。每隔24 h取样,用稀释平板法测定异常汉逊酵母、酿酒酵母的数量。
1.2.2.2发酵过程的理化指标。酵母培养方法同“1.2.2.1”,还原糖采用DNS法测定,酒精度采用酒精计测定。
1.2.2.3无细胞滤液对酵母生长的抑制作用。分别将酿酒酵母、异常汉逊酵母及两者混合液接种于米酒发酵培养基中培养2 d,离心后超滤得到无细胞滤液。在无细胞滤液中添加等体积米酒发酵培养基,按2.5×106CFU/mL 接种,30 ℃静置培养24 h后测OD600nm值。对照组为米酒发酵培养基。
2结果与分析
2.1酿酒酵母和异常汉逊酵母的耐酒精试验结果酵母的耐酒精能力在白酒酿造中具有重要作用。每株酵母都有其最大的耐酒精度,当达到最大耐酒精度时,酵母就会停止生长。
从图1可知,随着培养基中酒精含量的增大,2株酵母的相对生长速率均逐渐减小,当酒精含量在12%vol时,2株酵母均几乎不生长,故酿酒酵母的耐酒精度为10%vol、异常汉逊酵母为8%vol。一般来说,非酿酒酵母耐酒精能力较低,而该研究中异常汉逊酵母具有较强耐酒精能力,能在混合发酵体系中生长。
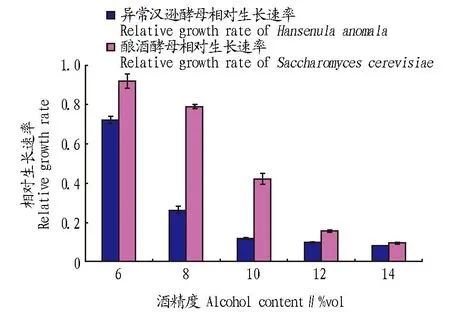
图1 酿酒酵母与异常汉逊酵母耐酒精度试验结果Fig. 1 Alcohol tolerance test of Saccharomyces cerevisiae and Hansenula anomala
2.22种酵母培养过程中微生物数量变化结果酿酒酵母和异常汉逊酵母纯培养的微生物数目变化见图2,酿酒酵母和异常汉逊酵母共培养的微生物数目变化见图3。

图2 酿酒酵母和异常汉逊酵母纯培养过程数目变化Fig. 2 Quantitive changes of Saccharomyces cerevisiae and Hansenula anomala during pure culture process
从图2可知,酿酒酵母和异常汉逊酵母纯培养过程中,在前48 h 2种酵母均处于快速生长阶段,而后在48~120 h维持较高的数目基本不变,在120 h后两者均开始衰亡,微生物数目都开始减少。酿酒酵母和异常汉逊酵母在培养过程可达到的最大细胞量分别为2.8×108和2.4×108CFU/mL。

图3 酿酒酵母和异常汉逊酵母混合培养过程数目变化Fig. 3 Quantitive changes of Saccharomyces cerevisiae and Hansenula anomala during mixed culture
由图3可知,在酿酒酵母和异常汉逊酵母共培养过程中,酿酒酵母在前48 h处于生长阶段,而后缓慢减少。这可能由于酿酒酵母和异常汉逊酵母混菌发酵,两者竞争营养物质而导致酿酒酵母经过短暂的对数生长期,而后马上进入衰亡期。异常汉逊酵母经过24 h的迅速增长后迅速衰亡,这可能由于受酿酒酵母竞争抑制使其迅速减少。
2.3酿酒酵母和异常汉逊酵母的相互作用研究
2.3.1营养物质的限制。酿酒酵母与非酿酒酵母对营养物质的竞争主要是对碳源的竞争。从图4可知,2种酵母纯培养和共培养时,随着发酵的进行,发酵液中的还原糖含量逐渐降低,发酵8 d后,酿酒酵母、异常汉逊酵母、二者混合培养的发酵液中的还原糖含量分别为22.54、20.75、20.14 g/L。混菌发酵终了时,其发酵液中的还原糖浓度与异常汉逊酵母纯发酵时还原糖浓度基本相同,再结合图2和图3酵母纯培养与共培养时微生物数目的变化结果,可见碳源不是导致异常汉逊酵母在共培养时受抑制的主要原因。

图4 酵母发酵过程中还原糖的含量变化Fig. 4 Changes of reducing sugar content during yeast fermentation
2.3.2酒精度对异常汉逊酵母生长抑制作用。从图5可知,在发酵1~6 d,发酵液中的酒精含量不断增大,6 d后酒精含量基本不变。由于酿酒酵母的产酒精能力高于异常汉逊酵母的产酒精能力,所以在整个发酵过程中,酿酒酵母发酵液中的酒精含量>共培养发酵液酒精含量>异常汉逊酵母发酵液酒精含量。发酵6 d后异常汉逊酵母培养液、酿酒酵母培养液、共培养发酵液的酒精度依次为3.4%vol、4.7% vol、4.1%vol。结合图1异常汉逊酵母耐酒精试验结果可知,异常汉逊酵母能够耐受8%vol的酒精度。因此,在异常汉逊酵母与酿酒酵母共培养过程中,酒精度不是抑制异常汉逊酵母生长的原因。

图5 酵母发酵过程中酒精度的含量变化Fig. 5 Changes of alcohol content during yeast fermentation
2.3.3pH对异常汉逊酵母抑制作用。从图6可知,酵母发酵液在发酵1 d后,其pH迅速降低,由初始pH 5.6降至pH 3.7左右,而后出现先逐渐减少再稍微上升的趋势。整个发酵过程中,异常汉逊酵母纯培养发酵液的pH均低于混菌发酵培养液中的pH。由此可知,异常汉逊酵母发酵产酸要高于异常汉逊酵母与酿酒酵母混菌发酵产酸。因此,pH不是抑制异常汉逊酵母的主要原因。

图6 酵母发酵过程中pH的变化Fig. 6 Changes of pH value during yeast fermentation
2.3.4酵母发酵代谢物对异常汉逊酵母的抑制作用。由表1可知,对于酿酒酵母而言,无论是在酿酒酵母滤液、异常汉逊酵母滤液还是混菌发酵的滤液当中,其生长未表现出抑制作用。说明酵母代谢物对酿酒酵母的生长没有明显的抑制作用。异常汉逊酵母在酿酒酵母和混菌发酵滤液中,其生长都出现了比较明显的抑制作用。因此,酿酒酵母代谢物是抑制异常汉逊酵母生长的重要原因,且混菌发酵滤液中的抑制作用要高于酵母纯培养滤液。

表1 无细胞滤液对酵母生长抑制作用结果
3结论与讨论
该试验采用共培养的方法,通过对纯培养及混合培养过程中2种酵母的数目变化进行分析,发现异常汉逊酵母在混合培养过程中受到明显的抑制作用。对可能影响异常汉逊酵母生长的因子,如碳源、pH、酒精度及无细胞滤液等的研究发现,无论在酿酒酵母无细胞滤液还是在混合酵母无细胞滤液中,异常汉逊酵母生长均受到明显抑制而酿酒酵母生长正常,这说明抑制异常汉逊酵母生长的物质主要是酿酒酵母的代谢物,而非营养物质、酒精度和有机酸。但是具体哪些酿酒酵母的代谢产物起主要作用及如何起作用,目前尚不清楚。因此,如果能够通过进一步的研究确定何种代谢产物起主要抑制作用,并弄清其具体的作用机制,则不仅对于进一步阐明米酒中酵母间的相互作用机制具有重要意义,也可为米酒的酿造生产提供一定的理论依据。
参考文献
[1] 凌杰.白酒酿造中地衣芽孢杆菌与酿酒酵母的相互作用与应用研究[D].无锡:江南大学,2013.
[2] 唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012,39(7):921-930.
[3] 翟文昌.混菌发酵中克鲁维酵母衰亡原因及其对酒风味的影响[D].大连:大连工业大学,2008.
[4] ANDORRA L,BERRADRE M,ROZES N,et al. Effect of pure and mixed cultures of the main wine yeast species on grape must fermentation[J].European food research and technology,2010, 231(2):215-224.
[5] NISSEN P,NIELSEN D,ARNEBORG N.Viable Saccharomyces cerevisiae cells at high concentrations cause early growth arrest of non-Saccharomyces yeasts in mixed cultures by a cell-cell contact-mediated mechanism[J].Yeast,2003,20:331-341.
Interaction betweenSaccharomycescerevisiaeandHansenulaanomaladuring Brewing
YAN Bing, JIANG Yue, LIANG Ruo-nan, ZHOU Shi-shui*et al (College of Biological Science and Engineering, South China University of Technology,Guangzhou,Guangdong 510006)
Abstract[Objective] To research the interaction betweenSaccharomycescerevisiaeandHansenulaanomalain semi-solid brewing. [Method]The interaction betweenSaccharomycescerevisiaeandHansenulaanomalawas studied by detecting the numbers of yeasts and analyzing the physical and chemical indexes during the single fermentation and mix fermentation. [Result]Hansenulaanomaladied rapidly after 24 hours during the mix fermentation ofSaccharomycescerevisiaeandHansenulaanomala. Through analyzing the influence factors such as carbon source, alcohol, pH and cell-free system of yeasts, we found out thatHansenulaanomalagrew very slowly in the cell-free solutions ofSaccharomycescerevisiaeand mix yeasts compared withSaccharomycescerevisiae. [Conclusion] During the mix fermentation ofSaccharomycescerevisiaeandHansenulaanomala,Hansenulaanomala is inhibited obviously mainly by the metabolites ofSaccharomycescerevisiae.
Key wordsSaccharomycescerevisiae;Hansenulaanomala; Brewing; Interaction
收稿日期2015-12-21
作者简介颜兵(1989- ),男,湖南永州人,硕士研究生,研究方向:生物工程。*通讯作者,副教授,博士,从事发酵工程与酿酒研究。
中图分类号S 609.9
文献标识码A
文章编号0517-6611(2016)02-107-03

