SrHA/PMMA复合骨水泥的制备、理化性能及细胞相容性研究*
邓育红崔旭彭松林*
SrHA/PMMA复合骨水泥的制备、理化性能及细胞相容性研究*
邓育红1崔旭2彭松林1*
目的 结合PMMA和锶羟基磷灰石(SrHA)各自的优势,制备出兼具高的力学强度、合适的固化时间、较低的热释放、生物活性和骨整合性能的SrHA/PMMA复合骨水泥,并系统性地研究SrHA的引入对复合骨水泥的体外固化性能、力学强度和生物学性能的影响。方法 将水热合成法制备的锶羟基磷灰石引入PMMA基体,制备SrHA/PMMA复合骨水泥。系统性地对SrHA/PMMA复合骨水泥的力学强度、固化时间、热释放、生物活性进行研究。将复合骨水泥和细胞共培养,利用 MTT法、扫描电镜等研究SrHA/PMMA复合骨水泥的细胞毒性,粘附和增殖。结果 结果表明,与纯的PMMA骨水泥(对照组)相比,SrHA/PMMA复合骨水泥的固化热释放明显降低(约80~84℃),同时又维持了合适的固化时间(8~11分钟)和较好的力学性能(抗压强度为90MPa左右)。SrHA的引入,不仅赋予了复合骨水泥生物活性,也显著地改善了其细胞/材料的相互作用。浸泡在SBF后,SrHA/PMMA复合骨水泥显示出更好的体外矿化性能。与成骨细胞 MC3T3-E1共培养后,表面沉积的羟基磷灰石能够更好的促进细胞的粘附和爬行。结论 兼具优异的理化性能和生物活性的SrHA/PMMA复合骨水泥,有着广阔的骨科微创修复应用前景。
骨水泥;锶磷灰石;PMMA;凝固时间;生物活性;生物矿化;细胞毒性;粘附;增殖;骨整合性能
骨水泥广泛用于骨科和整形领域,通常由固相粉剂和固化液两部分组成,在室温下按一定比例混合即可发生固化,将其置于更换关节或需填充的部位,待反应结束后即可将关节固定或骨缺损填充[1]。同时,由于骨水泥具有可注射性,利用医用注射器植入体内,可最大限度减小手术创口的面积,加快康复速度,减轻患者痛苦,故而常用于骨组织,特别是脊柱的微创填充材料和支架材料,能够很好的稳定骨折,起到支撑作用,是骨组织应用材料不可缺少的一员[2]。
自20世纪60年代初问世以来[3],骨水泥类材料已被广泛的研究。目前,主要的骨水泥种类有硫酸钙骨水泥、聚甲基丙烯酸甲酷(PMMA)骨水泥、磷酸钙骨水泥等,其中PMMA骨水泥临床应用最广泛[4]。传统PMMA骨水泥具有固化时间短、力学强度高等特点,可适用于承重部分的骨修复植入,能够与植入的假体形成较好的结合。但PMMA骨水泥不能降解,缺乏生物活性,与宿主骨之间的界面结合力低,固化过程中的热释放易损伤宿主组织,长期植入后界面容易老化、破裂,最终导致无菌性松动或者植入失败,引发患者植入部位的疼痛,降低生活质量。上述缺陷极大的限制了PMMA骨水泥作为治疗骨质疏松填充材料的应用[5,6]。为此,科研工作者们一直都致力于PMMA骨水泥临床生物学性能的改善。其中,向PMMA基体中引入生物活性成分是一种有效的途径[7]。而较为典型的生物活性成分主要包括生物玻璃[8]、生物活性玻璃-陶瓷[9]、Tio2[10]和HA[11]等。
HA与人体骨骼中的无机矿物成分类似,有着优异的生物相容性和生物活性其晶体不同的表面带有不同的电荷,从而具有极性,与蛋白质和多糖类物质亲和性好,容易通过氢键将蛋白质和多糖吸附于材料表面[12]。HA植入体内后,能够支撑骨细胞的粘附和增殖,并最终引导新骨长入材料基体,形成新骨,具有优异的骨整合性能[13]。实验及临床证实[14],HA种植体与骨组织之间无纤维组织生成,结合良好,是临床用于硬组织修复和替代较为理想的生物材料。目前,HA已经以药物载体,涂层,骨水泥,三维支架等诸多形式应用于牙科,骨科等不同的生物医学领域[15]。
人体内的微量锶元素(Sr)几乎全部沉积于骨中,有着和钙(Ca)一样的生理代谢途径。同时Sr具有双向调控作用,能够双向调控骨代谢,在促进成骨细胞的增殖和分化同时,又可以抑制破骨细胞,还能促进干细胞往成骨方向诱导分化,最终抑制破骨吸收,促进成骨,是临床治疗绝经后妇女骨质疏松的有效药物成分[16,17]。因此,利用Sr取代HA中的Ca,制备了SrHA。国内外长期研究表明[16,17],SrHA具有好的骨再生能力,可与骨形成牢固的化学键结合,使材料与骨融合在一起,增加骨与材料间的界面结合力,提高植入材料使用寿命,降低发生失效的风险,此外,SrHA还具有射线不透性的特点。迄今为止,将SrHA引入PMMA的相关研究大部分都集中于动物学实验,考察其体内的骨整合性能和成骨促进作用。而SrHA的引入对PMMA理化性能影响的研究相对较少。因此,本文将SrHA引入PMMA骨水泥,制备可注射SrHA/PMMA复合骨水泥,并对其临床应用的理化性能和生物相容性进行研究。
1 材料和方法
1.1 材料
Ca(NO3)2、Sr(NO3)2、NH4H2PO4、氨水都为分析纯,由国药集团化学试剂有限公司提供;DMEM培养液(Hyclone公司);MTT溶液、二甲基亚砜(Solarbio公司)。
1.2 实验方法
1.2.1 SrHA/PMMA复合骨水泥的制备
⑴ 固相粉剂的制备和灭菌
①SrHA的制备
本研究参考文献[18]中描述的方法,利用水热合成法制备 SrHA。按化学计量比将 Ca(NO3)2+Sr(NO3)2(Sr∶Ca的摩尔比为1∶9)溶液和(NH4)2HPO4以及适量的柠檬酸三钠和模板剂CTAB溶于50 mL去离子水中,剧烈搅拌30分钟后,将混合液移至高压釜中,在200℃下保温12小时。冷却至室温后,抽滤除去液体,将留下的SrHA粉末用去离子水和乙醇反复清洗,抽滤除去液体,然后在高温烘箱中90℃干燥10小时,并利用破碎和分级设备逐级破碎过筛获得需要粒径(10~20 m)的SrHA。
②固相粉剂的混合
利用三维固体混合机(SYH-5,江苏宇通干燥工程有限公司)将复合骨水泥固相粉剂中各组分(PMMA(MakevaleGroup,UK)、SrHA、过氧化苯甲酰(BPO)(分析纯,Sigma试剂))(引发剂,占固相粉剂的质量分数为0.05 wt. %)混合均匀。
③固相粉剂的灭菌
将混合均匀的复合骨水泥固相粉剂用环氧乙烷灭菌。⑵ 固化液的制备和灭菌
④固化液的配置
将固化液中各组分(甲基丙烯酸甲酯单体(MMA)和N,N-二甲基甲苯胺(DMPT))(分析纯,Sigma试剂)在玻璃反应釜(S212-1L,上海一凯仪器设备有限公司)搅拌混合均匀,其中DMPT的质量分数为2wt.%。
⑤固化液的灭菌
复合骨水泥的固化液用滤膜过滤灭菌。
⑶ 复合骨水泥的制备
固相粉剂和固化液消毒后,将两者按一定的比例混合1~2分钟,即可获得均匀的复合骨水泥浆体,固化后即为复合骨水泥成品,制备的SrHA/PMMA复合骨水泥的组成见表1。

表1 SrHA/PMMA复合骨水泥的组成
1.2.2 SrHA/PMMA复合骨水泥的性能
⑴ 可注射性
本实验中利用医用注射器测试SrHA/PMMA复合骨水泥的可注射性能。医用注射器为10mL,针头孔径为1.7 mm。注射器被垂直固定后用人力推动活塞将浆体挤出。注射器不含骨水泥浆体的重量为 M;浆体被挤出前,含浆体的注射器重量为M0;浆体挤出后,剩余浆体和注射器的重量为M1,利用公式(1)计算 SrHA/PMMA复合骨水泥的可注射性(I),每组实验重复4次,计算平均值和标准差(SD)。
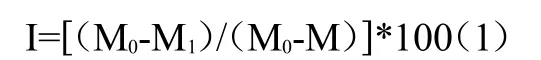
⑵ 凝固时间
利用现行通用的吉尔摩仪(ASTM C266)评估 SrHA/ PMMA复合骨水泥的初凝时间。吉尔摩针的质量为113.98g,直径为2.117mm。利用5孔(6mm×12mm)的有机玻璃做模具,将SrHA/PMMA复合骨水泥的水泥浆体填进模具,置于37.8℃、99%湿度的恒温恒湿箱中养护,将吉尔摩针垂直接触复合骨水泥浆体的表面,观察期落入试样的深度,初凝的标准是吉尔摩针落入试样的深度不超过1mm。每组实验重复4次,计算平均值和标准差(SD)。
⑶ 抗压强度
用万能力学性能试验机(CMT6104,中国SANS Test MachineInc)测试SrHA/PMMA复合骨水泥的抗压强度,加载速度为0.5mm/min。样品尺寸为直径6mm×12mm,每组实验重复4次,计算平均值和标准差(SD)。
⑷ 固化过程中的热释放
利用微量热仪(VoltcraftData-LoggerK202,ConradElectronics,Germany)测量SrHA/PMMA复合骨水泥固化过程中释放热量导致的温度变化。SrHA/PMMA复合骨水泥浆体置于聚乙烯模具中,测试环境为20℃。
1.2.3 SrHA/PMMA复合骨水泥的体外矿化能力
分别制备尺寸为直径10mm×2mm的PMMA、10SrHA/ PMMA、30SrHA/PMMA复合骨水泥样品。复合骨水泥样品浸泡于模拟体液(SBF),置于湿度>90%,温度为37℃恒温箱中。浸泡液SBF的体积按照生物材料体外浸泡实验的经典算法,即浸泡液SBF的体积数值为样品表面积的1/10。每一个时间点后,将样品取出,用去离子水冲洗3~5遍,在90℃下干燥;利用场发射环境扫描电子显微镜(S-2360,日本Hitachi公司)观察SrHA/PMMA复合骨水泥浸泡前后的形貌与微观结构的变化,同时结合能谱分析检测其表面成分;利用 X射线衍射仪(D/max2550,日本 Rigaku公司)和红外光谱仪(EQUINOXSS,德国Bruker公司)分析样品浸泡后的物相组成。
1.2.4 SrHA/PMMA复合骨水泥的细胞毒性和细胞粘附
⑴ 细胞毒性MTT测试
根据GB/T16886.5-2003选择浸提液试验方法,按照GB/ T14233.2-2005《细胞毒性试验》中推荐的MTT法进行试验。
首先进行细胞培养。取冻存的L929成纤维细胞进行复苏-培养-传代-培养的过程,当细胞传至第3代时(正常状态下需5~6天),消化下来待用。
其次是样品准备。采用浸提液试验方法,计算骨水泥样品重量与表面积的转换关系,采用DMEM细胞培养液(含10%胎牛血清(FBS,Gibco,USA),100IU/mL青霉素(Gibco, USA),100/mL链霉素(Gibco,USA)),以浸提比例6cm2/ mL,37℃,24小时制备浸提液。
将配制好的密度为1×104/mL的细胞悬液接种于96孔板中,每孔100L,实验设空白对照组和试验样品组,每组至少接种3个孔,在含5%CO2条件下,37℃培养24小时后,弃去培养液。空白对照组仅加DMEM细胞培养液(含10%胎牛血清(FBS,Gibco,USA),100IU/mL青霉素(Gibco, USA),100/mL链霉素(Gibco,USA)。试验样品组加制备好的24小时浸提液。空白对照组和试样样品组置于 CO2浓度为5%,湿度为95%的培养箱中37℃培养72小时后,加MTT继续培养4小时,在酶标仪570nm和630nm处测定吸光度。计算相对增殖率(RGR),根据 RGR判断试验样品的细胞毒性反应级别。
⑵ 细胞粘附
复合骨水泥样品事先使用75%的酒精消毒,并在含10% FBS的培养基中浸泡24小时,37°C。成骨细胞MC3T3-E1在 -MEM培养基中培养至第3代或第4代时,将成骨细胞MC3T3-E1用0.25%胰酶消化,制成细胞悬液并计数,调节使其密度达到5×104cells/孔,用微量加样器将MC3T3-E1细胞接种于骨水泥材料样品上,每孔200 L细胞悬液,之后将培养板置于37℃、体积分数为5%的CO2培养箱中培养4小时;再在体系中补加500 L全培养液,将孔板放入培养箱中继续培养,隔天换液。在培养第3天将孔板从培养箱中取出,吸出培养基,用PBS洗3遍,吸出PBS溶液,加入冰的戊二醛对细胞进行固定,在4°C冰箱中固定8小时以上。之后取出孔板,吸出戊二醛,使用浓度梯度为30%、50%、75%、80%、90%、95%、100%的酒精进行梯度脱水,每个梯度脱水2次,每次5分钟。脱水之后,将骨水泥片浸泡于乙酸异戊酯中,再进行临界点干燥,之后取出样品镀金并进行SEM观察。
1.3 统计学分析
为确保结果的准确性,本研究所有的生物学实验(5个样品1组)都以一式三份进行实验操作,所有结果都以平均值±标准差(±s)的形式给出。采用单项方差的方法进行统计分析,显著性差异设置为<0.05。
2 结果
2.1 SrHA/PMMA复合骨水泥的表征
图1是不同SrHA含量复合骨水泥的表面微观形貌。由图可知,所有复合骨水泥基体都分布着一些气孔。随着SrHA含量的增加,复合骨水泥基体表面逐渐变得粗糙。XRD结果(图2)表明,PMMA骨水泥为典型的非晶相,而10SrHA/ PMMA和30SrHA/PMMA则出现HA的特征峰。

图1 不同SrHA含量的复合骨水泥的表面形貌。a,PMMA;b,10SrHA /PMMA;c,30SrHA/PMMA(图中黑色箭头标示为气孔)

图2 不同SrHA含量的复合骨水泥的XRD图
2.2 SrHA/PMMA复合骨水泥的理化性能
2.2.1 可注射性
图3(a)是用医用注射器测量的不同SrHA含量复合骨水泥的可注射性。随着复合骨水泥中SrHA含量的增加,浆体的粘度逐渐变小,可注射性逐渐增加,3种复合骨水泥的可注射性分别为(80.6±3.23)%(对照组PMMA),(85.35± 5.56)%(10SrHA/PMMA)和(92.46±7.61)%。所有复合骨水泥的可注射性测试过程中,未见任何的分层或者硬膏从注射器中挤出。而且,由于上述表征骨水泥可注射性方法的局限,总有部分的骨水泥会存留在注射器的针头里[19],参考文献[20]的结果,表明本论文制备的复合骨水泥浆体都具有优异的可注射性能。
2.2.2 凝固时间
初凝时间是可注射骨水泥临床应用的重要指标之一。初凝时间过长,在与生理体液或者血液接触时,骨水泥浆体容易被体液或者血液冲散,从而形成栓塞,给患者带来巨大的风险。如果初凝时间太短,则没有充足的手术时间[21]。因此,开发出初凝时间适用于临床应用,且力学性能较好的骨水泥尤为迫切。不同SrHA含量复合骨水泥的初凝时间如图3(b)。随着复合骨水泥中SrHA含量的增加,初凝时间逐渐增加。对照组PMMA的初凝时间为(6.67±0.661)分钟,而10SrHA/PMMA和30SrHA/PMMA的初凝时间分别为(8.03± 0.890)和(10.89±1.364)分钟。可知,SrHA的引入改善了复合骨水泥的自固化性能,且所有骨水泥组分均符合可注射的丙烯酸类树脂骨水泥行业标准 YY 0459-2003/ISO 5833:2002(《外科植入物丙烯酸类树脂骨水泥》)规定的凝固时间要求(6~15分钟)。
2.2.3 抗压强度
图3(c)为不同SrHA含量复合骨水泥的抗压强度。随着复合骨水泥中SrHA含量的增加,抗压强度逐渐增加。对照组 PMMA的抗压强度为(86.5±5.6)MPa,而10SrHA/ PMMA和30SrHA/PMMA的抗压强度则分别为(88.6±7.0)和(90.3±4.5),虽然复合骨再生水泥的抗压强度虽然随着SrHA含量的增加而增强,但是并没有显著的差异(<0.5)。根据行业标准YY0459-2003/ISO5833:2002(《外科植入物丙烯酸类树脂骨水泥》)可知,实验范围内的所有组分均符合可注射的丙烯酸类树脂骨水泥规定的抗压强度要求(>70 Mpa)。
2.2.4 固化温度
图3(d)是不同 SrHA含量复合骨水泥固化过程中的最高固化温度。随着复合骨水泥中SrHA含量的增加,最高固化温度明显下降。不添加SrHA的骨水泥(对照组PMMA),最高固化温度为(92.35±5.36)℃,而添加30SrHA/PMMA的复合骨水泥(10SrHA/PMMA),最高固化温度则为(79.23±3.98)℃,明显低于纯的PMMA固化时的最高温度。SrHA的引入,有效地降低了PMMA聚合过程的热释放,可以降低或避免固化过程中对周围组织的热损伤[13]。

图3 不同SrHA含量的复合骨水泥的可注射性。a可注射性;b初凝时间;c抗压强度;d和最高固化温度(虚线表示为行业标准YY 0459-2003/ISO 5833:2002规定的要求)
2.3 SrHA/PMMA复合骨水泥的体外矿化性能
在模拟体液(SBF)中浸泡30天后,复合骨水泥表面矿化沉积的羟基磷灰石的微观形貌如图4。由图可见,所有组分的复合骨水泥表面都沉积有HA,而对照组PMMA只有极少数表面位点沉积有HA,随着复合骨水泥中SrHA含量的增加,复合骨水泥表面矿化沉积的HA逐渐增多,且矿化HA的微观形貌表现为针状HA堆垛形成的类球状颗粒。

图4 不同SrHA含量的复合骨水泥在SBF中浸泡30天后的表面矿化羟基磷灰石的形貌(a、d,PMMA;b、e,10SrHA/PMMA;c、f, 30SrHA/PMMA)
2.4 细胞毒性和细胞粘附
2.4.1 细胞毒性
表2和图5是SrHA/PMMA复合骨水泥的细胞毒性测试结果。与空白对照组相比,含有SrHA的复合骨水泥的细胞增殖率相对有所下降,可能是因为SrHA的添加导致PMMA与MMA未完全聚合,而残余的极少量MMA会有细胞毒性。但是所有组分的SrHA/PMMA复合骨水泥的细胞毒性都为1级,符合国标(GBT 16886.5-2003医疗器械生物学评价第5部分:体外细胞毒性试验)规定的细胞毒性级别。
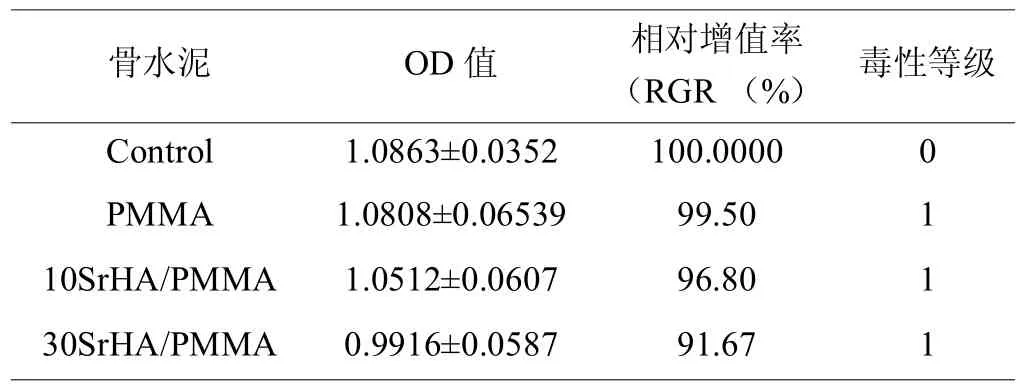
表2L929细胞与不同SrHA含量的复合骨水泥浸提液共培养3天后的OD值和细胞毒性评级
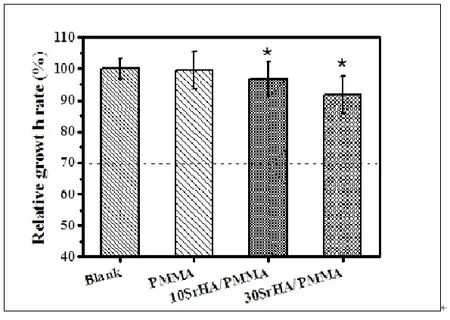
图5 L929细胞与不同SrHA含量的复合骨水泥浸提液共培养后3天后细胞的相对增值率
2.4.2 细胞粘附
图6是共培养3天后,MC3T3-E1细胞在复合骨水泥样品表面的粘附形态。MC3T3-E1细胞在不同组分复合骨水泥样品表面都能够粘附和伸展。随着复合骨水泥中SrHA含量的增加,样品表面粘附的细胞形态伸展更加良好,粘附的细胞相对数目也更多。
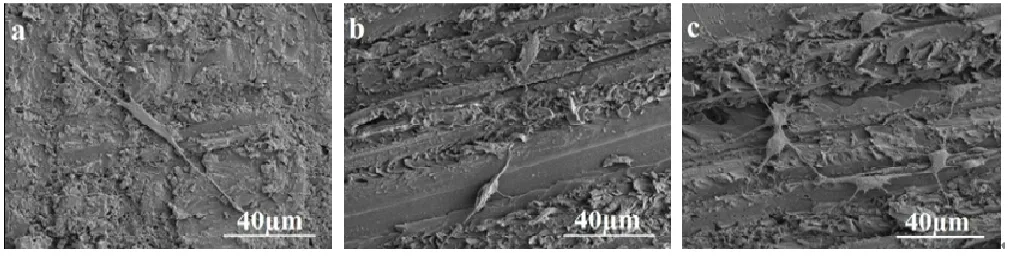
图6 共培养3天后,MC3T3-E1细胞在复合骨水泥样品表面的粘附(a,PMMA;b,10SrHA/PMMA;c,30SrHA/PMMA)
3 讨论
骨水泥在临床应用的一个主要缺陷,就是MMA单体聚合成PMMA过程中,存在大量的热释放,使植入区域的局部温度会上升至100℃左右,易导致细胞死亡和周围组织的损伤[22]。因此,PMMA的固化过程被认为是影响其临床应用最重要的因素之一。实验制备的SrHA/PMMA复合骨水泥的最高固化温度为84℃左右,明显低于纯PMMA骨水泥的最高固化温度(92℃)和ISO-5833的标准(90℃)[1]。而且随着SrHA含量的增加,SrHA/PMMA复合骨水泥最高固化温度也随着降低,30SrHA/PMMA复合骨水泥的最高固化温度已经低至80℃左右。SrHA是一种热阻隔和热吸收陶瓷材料,能够一定程度上隔绝和吸收PMMA固化过程中的热释放,从而有效地降低了 SrHA/PMMA复合骨水泥的最高固化温度[21,23]。同时,相对较低的固化温度能够降低或者避免对周围组织和细胞热损伤,从而具有更好的生物相容性[21]。更重要的是,SrHA的添加并未牺牲PMMA合适的固化时间,SrHA/PMMA复合骨水泥仍具有媲美于PMMA的合适的固化时间(8~11分钟),且也充分地满足 ISO-5833的标准要求(6~15分钟)[1]。
早期研究发现[24,25],向PMMA基体中添加生物活性成分以改善其骨结合性能的同时,生物活性成分在PMMA基体的颗粒团聚会引起材料的机械损伤,从而降低材料的力学性能。本研究中SrHA的添加不仅未降低反而少许地增加了复合骨水泥材料的力学强度,结果类似于常江等人关于硅酸钙生物陶瓷/PMMA复合骨水泥的研究,这可能得益于复合骨水泥材料的制备工艺[26]。制备过程中,首先将SrHA粉末均匀分散于PMMA颗粒基体,然后再将已经充分混合均匀的固相粉剂与固化液混合并搅拌均匀。因此,固化后SrHA能够均匀地分散于整个PMMA基体。而SrHA在PMMA基体的均匀分散是保证复合骨水泥具有高力学强度的必要条件。固化后SrHA/PMMA复合骨水泥的抗压强度(86~93MPa)处于商用的PMMA骨水泥(73~120MPa)范围,且远高于商用 CPC骨水泥的抗压强度(12~55MPa)[21,23],符合丙烯酸类骨水泥行业标准(YY 0459-2003/ISO 5833:2002)规定的临床应用要求(>70MPa)。
细胞的粘附和伸展是细胞/材料相互作用的第一个阶段,会直接影响细胞在材料表面的增殖和分化能力,同时材料的特性也会影响细胞的行为[26]。本实验制备的PMMA和SrHA/ PMMA骨水泥都能支持细胞的粘附,成骨细胞MC3T3-E1在SrHA/PMMA复合骨水泥材料表面呈现出更好的粘附和伸展行为,应该得益于矿化沉积的HA层和局部的微pH环境[9]。众所周知,生物材料表面矿化的HA能够促进细胞的增殖和分化[14]。本研究中,纯PMMA骨水泥表面并未有明显的HA沉积,而浸泡于SBF后,SrHA/PMMA复合骨水泥表面有着广泛的HA沉积。因此,与纯PMMA骨水泥相比,SrHA/PMMA复合骨水泥表面有着更好的细胞粘附和伸展行为就很容易理解了。有研究表明[27],pH微环境在调节细胞行为过程中也能起到重要的作用。本研究中,SrHA引入PMMA基体能够形成更加偏中性的pH微环境,因此,在一定程度上能够促进细胞在SrHA/PMMA复合骨水泥材料表面的粘附和爬行。
综上所述,制备的新型生物活性 SrHA/PMMA复合骨水泥具有良好的可注射性,能够注射入体内,并在合适的时间内自固化成型。SrHA的掺入极大的改善了PMMA的自固化性能,不仅显著地降低了复合骨水泥固化温度,还增加了复合骨水泥的抗压强度,同时又保持了合适的凝固时间,使之更加适应于临床应用。浸泡在SBF后,PMMA骨水泥表面只有局部较少的区域有HA的沉积,而复合骨水泥的表面几乎完全被沉积的 HA覆盖,显示出更好的体外矿化性能,从而促进了成骨细胞在其表面的粘附和增殖。因此,兼具优异理化性能和生物活性的SrHA/PMMA复合骨水泥,有着广阔的骨科微创修复应用前景,可以用于体内动物实验的进一步研究。
[1]国家食品药品监督管理局.行业标准YY 0459-2003,外科植入物-丙烯酸类树脂骨水泥[S].北京:中国标准出版社,2003.
[2]李宏杰.人工全髋关节置换术的研究现状[J].国外医学,外科学分册,1999,26(1):34-36.
[3]郭艾,罗先正.人工全髋关节的回顾和进展[J].中华骨科杂志,1994,14(5):314-316.
[4]X Liu,X M Wang,F Z Cui,et al.Injectable bone cement based on mineralizedcollagen[J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2010,94B:77-79.
[5]TYamamuro,T Nakamura,HIida,et al.Developmentof bioactive bone cement and itsclinicalapplications[J].Biomaterials,1998,19:1479-1482.
[6]陈德敏.丙烯酸酯类骨水泥材料的临床应用与研究进展[J].口腔材料器械杂志,2010,19(2):81-86.
[7]G Lewis.Alternative acrylic bone cement formulations for cemented arthroplasties:Present status,key issues[J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2008,84:301-319.
[8]S Shinzato,T Nakamura,T Kokuba,et al.A new bioactive bone cement:effect of glass bead filler content on mechanical and biological proper[J].Journal ofBiomedical Materials Research,2001,54:491-500.
[9]H AbdSamad,M Jaafar,R Othman,et al.New bioactive glass-ceramic:Synthesisand application in PMMAbone cement composites[J].Bio-Medical Materials and Engineering,2011,21:247-258.
[10]C Fukuda,K Goto,M Imamura,et al.Bone bonding ability and handling properties of a titania-polymeth ylmethacrylate(PMMA) composite bioactive bone cement modified with a unique PMMA powder[J].Acta Biomaterialia,2011,7:3595-3600.
[11]M J Dalby,L Di Silvio,E J Harper,et al.Initial interaction of osteoblasts with the surface of a hydroxyapatite-poly(methyl methacrylate)cement[J].Biomaterials,2001,22:1739-1747.
[12]杨洪,宁黔冀.生物硬组织材料羟基磷灰石-从天然到人工合成[J].生物学通报,2004,39(5):6-7.
[13]M Bohner.Calcium orthophosphates in medicine:from ceramics to calcium phosphate cements[J].Injury,2000,31(Suppl 4):37-47.
[14]Hideki Aoki.Science and medical applications of hydroxyapatite [M].IshiyakuEuroamerica,1992.
[15]S Peng,G Zhou,W M Lam,et al.Strontium promotes osteogenic differentiation of mesenchymal stem cells through the Ras/MAPK signaling pathway[J].Cellular Physiology and Biochemistry, 2009,23:165-174.
[16]K Lin,H Pan,J Chang,et al.Enhanced osteoporotic bone regeneration by strontium-substitutedcalcium silicate bioactiveceramics [J].Biomaterials,2013,34:10028-10042.
[17]O Z Andersen,VOffermanns,M Sillassen,et al.Accelerated bone ingrowth by local delivery of strontium from surface functionalized titanium implants[J].Biomaterials,2013,34:5883-5890.
[18]赵欣,王德平,邱雯青,等.掺锶量对羟基磷灰石形貌及其荧光特性的影响[J].无机材料学报,2013,28(1):45-50.
[19]MPGinebra,TTraykova,J APlanell.Calciumphosphatecements as bone drug delivery systems:A review[J].Journal of Controlled Release,2006,113:102-110.
[20]X Cui,Y D Zhang,S C Zhao,et al.An Injectable Borate Bioactive Glass Cement for Bone repair:Preparation,Bioactivity and Set-ting Mechanism[J].Journal of Non-Crystalline Solids,2016,432, Part A:150-157.
[21]C H Liu,Y Huang,J G Chen.The Physicochemical Properties of the Solidification of Calcium Phosphate Cement[J].Journal of Biomedical Materials Research Part B:Applied Biomaterial,2004, 1:73-78.
[22]P Liu-Snyder,T J Webster.Developing a new generation of bone cements with nanotechnology[J].Current Nanoscience,2008,4:111-118.
[23]K Serbetci,F Korkusuz,N Hasirci.Thermal and mechanical properties of hydroxyapatite impregnated acrylic bone cements[J]. Polymer Testing,2004,23:145-155.
[24]C F Jasso-Gastinel,S G Enriquez,J Flores,et al.Acrylic Bone Cements Modified With Bioactive Filler[J].Macromolecular Symposia,2009,283-284:159-166.
[25]T Miyazaki,C Ohtsuki,MKyomoto,et al.Kuramoto.Bioactive PMMA bone cement prepared by modification with methacryloxypropyltrimethoxysilane and calcium chloride[J].Journal of Biomedical Materials Research Part A,2003,67:1417-1423.
[26]Lei Chen,Chengtie Wu,Jiang Chang,et al.Silicate bioceramic/ PMMA composite bone cement with distinctive physicochemical andbioactive properties[J].RSCAdvances,2015,5:37314-37322.
[27]Yuhui Shen,HaoboPan,William WLu,et al.Interfacial pH:a critical factor for osteoporotic bone regeneration[J].Langmuir,2011, 27:2701-2708.
Preparation,handling properties and cytocompatibility of SrHA/PMMA composite bone cement
Deng Yuhong1,Cui Xu2,Peng Songlin1.
1Department of Spine Surgery,Shenzhen People's Hospital,Shenzhen Guangdong,518020;2CenterforHumanTissues and Organs Degeneration,ShenzhenInstituteofAdvanced Technology, Chinese Academy of Science,Shenzhen Guangdong,518055,China
Objective The purpose of this study is to harness theadvantages of both PMMA and SrHA in order to prepare a new kind of composite bone cement(SrHA/PMMA)with goodmechanical strength,improved exothermic effect and osteogenicactivity.Theeffect ofSrHAon the in vitrosetting behaviors,andmechanical andbiological propertiesofcomposite cements wassystematically investigated.Methods Hydrothermal synthesis of SrHA was introduced into PMMA to prepare a novel SrHA/PMMA composite bone cement,and the mechanical property,setting time,heat release and the bioactivity was systematically investigated.After that,cytotoxicity,cell adhesion and proliferation of SrHA/PMMA composite bone cement was evaluated by cocultured the cell with materials.Results The results showed that the prepared SrHA/PMMA composite bone cementsrevealed significantly decreased polymerization temperature as compared with pure PMMA,butmaintained idealsettingtimes(8 to11min)andhigh mechanical strength(90MPaforcompressivestrength). Most interestingly,the incorporation of SrHAinto PMMA improved its cell/material interaction,asindicated by the significantly enhanced apatite-mineralization ability and stimulatoryeffect on the attachment and spread of osteoblasts.Conclusion The results suggest that SrHA/PMMA composite bone cements possess distinctive physicochemical and bioactive properties,and are apromising injectable biomaterial for orthopedic applications.
Bone cement;SrHA;PMMA;Settingtime;Bioactivity;Biomineralization;Cytotoxicity;Celladhesion; Proliferation;Osseointegration
R318.08
A
10.3969/j.issn.1672-5972.2016.04.001
swgk2016-03-0060
邓育红(1975-)女,硕士,副主任护师。研究方向:骨外科。
*[通讯作者]彭松林(1977-)男,博士,主治医师。研究方向:脊柱外科。
2016-03-26)
深圳市科技创新委员会项目(JSGG20150331154931068,CXZZ20150401152251209)
1深圳市人民医院脊柱外科,广东深圳518020;2中国科学院深圳先进技术研究院,广东深圳,518055

