牙鲆dazl基因的克隆与表达分析
孙近近,张俊玲,孙文慧,施志仪
(上海海洋大学水产与生命学院,农业部淡水水产种质资源重点实验室,上海 201306)
牙鲆dazl基因的克隆与表达分析
孙近近,张俊玲,孙文慧,施志仪
(上海海洋大学水产与生命学院,农业部淡水水产种质资源重点实验室,上海 201306)
dazl(deleted in azoospermia-like)基因是多种物种精子发生的重要调控因子,为探讨该基因在牙鲆(Paralichthys olivaceus)性腺发育分化中的作用,本研究采用同源克隆和RACE技术克隆了牙鲆dazl基因的cDNA序列,利用生物信息学方法分析了其序列结构,并利用实时荧光定量PCR技术检测了该基因在牙鲆成体组织和早期发育阶段的表达情况。结果发现:牙鲆dazl cDNA序列全长2 031 bp,包括105 bp的5′端非翻译区,1 275 bp的3′端非翻译区和编码217个氨基酸残基的651 bp开放阅读框;氨基酸同源序列比对显示该序列存在一个高度保守的RRM(RNA recognition motif)结构域,且该结构域在鱼类中具有100%的序列一致性;荧光定量PCR结果显示dazl基因主要在牙鲆性腺中表达,且在精巢中的表达高于卵巢;在牙鲆早期发育阶段,dazl基因在未受精卵、受精卵及囊胚期均有较高的转录本,而在原肠胚期表达开始降低,至孵化后3 d一直保持较低的水平,这些丰富表达的母源性dazlmRNA可能参与了胚胎发育中原始生殖细胞的形成。本研究为进一步阐明dazl基因在牙鲆生殖发育中的功能奠定了基础。
牙鲆;dazl;cDNA克隆;基因表达
DAZ基因家族包括daz、dazl(daz-like)和bolue基因,这3者的编码蛋白均为RNA结合蛋白,在生殖细胞中特异表达,参与调节生殖细胞的发育和分化[1-2],是精子发生过程中减数分裂的主要调控因子[3]。bolue和dazl是常染色体基因,一般认为bolue是DAZ基因家族的祖先基因(ancestral gene),在无脊椎动物和脊椎动物中都存在,其在睾丸中表达(蠕虫除外),调控精子的正常发生;dazl起源于bolue基因,仅在脊椎动物中存在,它在生殖细胞和胚胎干细胞中表达,迄今研究表明其功能至少是精子生成的重要调控因子;daz基因是dazl的多拷贝基因,定位于Y染色体上,在人类和旧世界猴中的睾丸中表达,其缺失将导致精子生成停滞。
目前,dazl在人类(Homo sapiens)[4]、鼠(Mus musculus)[5]、爪蟾(Xenopus laevis)[6]、蝾螈(Cynops orientalis)[7]、斑马鱼(Danio rerio)[8]、青鳉(Oryzias latipes)[9]等物种中均有发现。功能缺失实验表明dazl基因在减数分裂和生殖细胞发育过程中均发挥重要作用[1]。在非洲爪蟾和斑马鱼中,dazlmRNA是卵子发生和胚胎形成中生殖质的重要成分[10],因此它也成为追踪生殖细胞发育和生殖质特化的分子标记。在虹鳟(Oncorhynchus mykiss)[11]和中华鲟(Chinese sturgeon)[12]中,dazl只存在于精巢和卵巢中,且在卵母细胞的早期发育中即能检测到,研究发现dazl蛋白参与中华鲟雌雄的有丝分裂和减数分裂过程;同样,在异育银鲫(Garassiusauratusgibelio)中,dazl仅在卵巢中表达(精巢未检测),且在原始生殖细胞形成中起重要作用[13]。在青鳉中,dazl是雌雄胚胎发育和配子发生的关键[9];研究也表明dazl基因参与了半滑舌鳎(Cynoglossussemilaevis)的雌雄性腺分化[14]。
牙鲆隶属鲽形目(Pleuronectiforms),是我国重要的海水养殖经济鱼类[15],雌性个体明显大于雄性个体,有关牙鲆性别决定和生殖调控的分子调控机制研究备受重视。鉴于dazl基因在脊椎动物生殖中的重要作用,本研究采用RT-PCR及RACE法分离与克隆了牙鲆dazl基因,并利用实时荧光定量PCR技术检测了该基因在牙鲆各组织及胚胎发育各时期的表达情况,为进一步研究DAZ基因家族在牙鲆生殖发育中的作用提供基础。
1 材料与方法
1.1 实验用鱼
牙鲆胚胎和仔鱼来自中国水产科学研究院北戴河中心实验站,分别采集未受精卵、受精卵、囊胚期、原肠胚期、神经胚期、胚孔封闭期、心跳期、孵化前期、孵化期胚胎和3 d仔鱼。成鱼购自上海市铜川路水产品市场,解剖取脑、鳃、肝、肾、卵巢、精巢、心脏、肌肉、胃和肠组织。各样品经DEPC水冲洗干净后在液氮中速冻,然后置于-80℃保存备用。
1.2 总RNA提取与反转录
上述各牙鲆样品依照Trizol试剂盒(Invitrogen)方法提取总RNA。总RNA用Agilent 2100 Bioanalyzer测定OD260/OD280值及浓度,P值均在1.8~2.0之间。用2%琼脂糖凝胶电泳检测RNA完整性,确认RNA质量能够满足后续实验要求,置于-80℃保存备用。
所得总RNA用DNase I(Promega)处理后作为模板,按以下体系进行反转录:在无RNase的离心管中加入2μg总RNA,1μL OligodT Primer(50μmol·L-1),1μL dNTPMixture(10 mmol· L-1each),补充RNase freedd H2O至10μL;然后在PCR仪上进行变性、退火反应,条件为65℃5 min,冰上急冷;加入以下试剂:5 x PrimeScript Buffer 4μL,RNase Inhibitor(40 U·μL-1)0.5 μL,PrimeScript RTase(200 U·μL-1)1μL,补充RNase free ddH2O至20μL;然后在PCR仪上进行反转录,反应条件为42℃60 min,72℃15 min,然后冰上放置2 min,-20℃保存。
1.3 牙鲆dazl基因的克隆
根据己知物种同源基因,设计dazl基因的简并引物(表1,dazl-f和dazl-r),取牙鲆性腺组织cDNA进行PCR扩增,PCR反应条件为94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸12 s,35个循环;72℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳分离后,用天根胶回收试剂盒纯化回收,并将其连接到pMD19-T载体上,16℃连接过夜后,转化到大肠杆菌DH5α菌株中,经蓝白斑筛选,挑选白色单菌落,培养后做菌落PCR鉴定,挑选正确的阳性克隆抽提质粒后送上海生工生物工程有限公司测序。

表1 用于PCR扩增的引物序列Tab.1 Primer sequences for PCR amp lification
根据所得dazl基因片段,设计3′-RACE outer primer和3′-RACE inner primer引物(表1)进行巢式PCR,PCR反应条件均为:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸50 s,35个循环;72℃延伸10 min。同样根据所得牙鲆dazl序列设计5′-RACE outer primer和5′-RACE inner primer(表1),首先依照5′-Full RACE Kit(TaKaRa)进行反转录合成5′-RACE cDNA链,然后进行5′-RACE PCR扩增,PCR反应条件均为:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸65 s,35个循环;72℃延伸10 min。3′-RACE和5′-RACE PCR产物分别经1%琼脂糖凝胶电泳分离后,割胶回收纯化目的片段,进行连接、转化、克隆和测序。
1.4 序列及系统进化分析
首先用BioEdit软件[16]将测序所得的序列拼接得到全长cDNA,然后利用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html/)软件分析序列开放阅读框(open reading frame,ORF);利用SMART(http://smart.emblheidelberg.de/smart/set_mode.cgi?NORMAL=1)和swissmodel(http://www.swissmodel.expasy.org/)在线预测其二级和三级结构。利用NCBI website(http://www.ncbi.nlm.nih.gov/guide/)中的BLAST程序对所得cDNA序列和氨基酸序列与GenBank数据库中序列进行对比;用BioEdit软件进行不同物种该基因的核苷酸序列和氨基酸序列的比对;利用MEGA 5.1[17]构建其系统进化树,其他脊椎动物的dazl氨基酸序列均从NCBI中GenBank下载,登录号如下:罗非鱼(Oreochromis niloticus),XP_005453868.1;斑马鱼,AAH76423.1;虹鳟,ADW41782.1;青鳉,NP_001098269.1;网纹鳉(Poecilia reticulate),XP_007562718.1;半滑舌鳎,NP_001281163.1;非洲爪蟾,NP_001081772.1;红腹蝾螈(Cynops pyrrhogaster),BAD38676.1;西部锦龟(Chrysemys picta bellii),XP_005297093.1;小鼠,NP_001264792.1;山羊(Capra hircus),AFR36910.1;白颊长臂猿(Nomascus leucogenys),XP_003265409.1;人,NP_001342.2。
1.5 dazl基因的实时荧光定量PCR
设计高效特异的引物(表1,qdazl-f和qdazlr),在CFX96TouchTMReal Time PCR Detection System(Bio-Rad)上进行定量检测。首先制备目的基因和内参基因(β-actin)的标准曲线。20μL反应体系包括了1μL cDNA(从100 ng~0.1 ng,10倍梯度稀释),0.2μL特异性引物,10μL 2× iQTMSYBR Green Supermix(Bio-rad)和8.6μL ddH2O。反应条件为:95℃1 min;95℃10 s和63℃15 s,采集荧光40次,然后进行融解曲线的扩增。标准曲线结果显示目的基因和内参基因的相关系数均大于0.99,相应的扩增效率均介于95%~100%之间。随后对所有样品进行定量检测,PCR反应体系和条件同上,实验重复3次。
牙鲆dazlmRNA的相对表达量采用2-△△CT法计算,其数值用平均值±标准误(Mean±SEM)表示,生物学重复(n)=3。牙鲆各发育时期以孵化期中的相对mRNA量为对照,牙鲆不同组织以肠中的相对mRNA量为对照。统计分析采用SPSS 17.0软件中的单因素方差分析(one-way ANOVA),使用Dunnett’s T3 test进行比较,当P<0.05时表示差异显著。
2 结果与分析
2.1 牙鲆dazl cDNA克隆和结构分析
经普通PCR扩增得到616 bp的cDNA片段,在此基础上进行5′-RACE和3′-RACE扩增,分别得到180 bp和1 388 bp的cDNA片段(图1),经软件拼接得到牙鲆dazl基因的全长cDNA序列。

图1 RACE法克隆牙鲆dazl基因全长cDNAFig.1 Full-length cDNA cloning of P.olivaceus dazl gene by RACE technology
牙鲆dazlcDNA全长2 031 bp,其中包含105 bp的5′端非翻译区(untranslated regions,UTR),1 275 bp的3′-UTR和编码217个氨基酸残基的651 bp开放阅读框。在其3′-UTR区域包含6个与mRNA瞬时表达有关的快速降解信号(图2-a)。通过SMART预测发现,该蛋白在34~103氨基酸处有一个典型的RNA识别基序(RNA recognitionmotif,RRM),其中含有分别具8个和6个保守氨基酸的核蛋白(ribonucleoprotein,RNP)1和2基序,在RNP1和RNP2的两侧是一些散布的疏水性氨基酸;在154~163处有一个低复杂区域(low complexity);在164~188处有一个DAZ repeat基序(图2-a、b)。通过swissmodel预测牙鲆dazl蛋白的三级结构,结果显示RRM的βαββαβ的二级结构形成4条反向平行β片层结构,2个α螺旋与β片层结构的方向相垂直。dazl蛋白的N-端开始为一段无规则卷曲,之后形成一段α螺旋,在一段连接肽之后,序列回折形成β-折叠,残基构成了一个典型RRM。DAZ repeat基序在结构中的二级结构呈现为无规卷曲并带着少量的α螺旋(图2-c)。
2.3 牙鲆dazl基因的同源性和系统进化分析
BLAST搜索和BioEdit软件序列比对分析(图3)显示,牙鲆dazlcDNA推导出的全部氨基酸序列与尖吻鲈(Lates calcarifer)、罗非鱼、红丽鱼(Pundamilia nyererei)、网纹鳉、虹鳟、青鳉、半滑舌鳎和斑马鱼的同源性分别为80%、78%、78 %、78%、70%、68%、65%和64%,与两栖动物爪蟾和哺乳动物小鼠、山羊和人类的同源性只有25%、26%、28%和28%。而对其RRM区氨基酸比对分析则发现该区域在脊椎动物中是高度保守的,且与鱼类的一致性可达到100%。

图2 牙鲆dazl基因的cDNA、氨基酸序列及其蛋白的二级、三级结构Fig.2 cDNA sequence,am ino acid and protein of the secondary and tertiary structure of P.olivaceus dazl gene
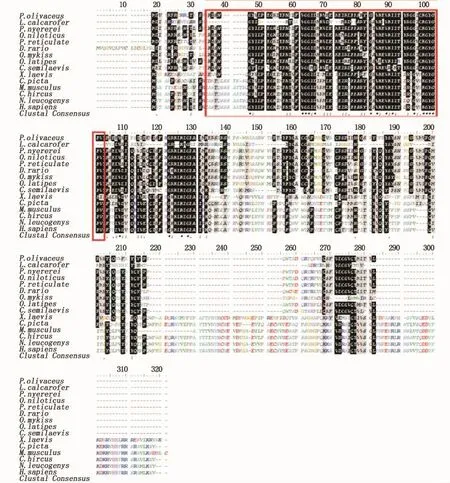
图3 牙鲆dazl和其它物种的氨基酸序列对比Fig.3 Com parison of am ino acid sequence alignment of P.olivaceus dazl w ith that of other species
利用MEGA 5.0软件构建系统发育树(图4),发现牙鲆dazl与所有鱼类dazl聚为一支,而两栖类、爬行类与哺乳动物等聚为另一支。

图4 基于dazl蛋白的氨基酸序列构建的NJ树Fig.4 NJ tree based on am ino acid sequences of dazl protein
2.4 牙鲆dazl基因的组织分布及在早期发育中的表达
荧光定量PCR结果(图5-a)显示,dazl基因主要在牙鲆性腺中表达,且在精巢中比在卵巢中有更为丰富的表达(P<0.05)。而在其它各组织中仅有微弱的表达。
在牙鲆早期发育阶段,dazl基因在未受精卵、受精卵以及受精后囊胚期均有较高的表达;而在受精后原肠胚期的表达开始降低,至神经胚期已降至很低的水平,且直到孵化后的3 d都保持很低的表达水平。
3 讨论

图5 dazl基因在牙鲆各组织及早期发育中的表达Fig.5 Relative expression levels of dazl in different tissues and at early developmental stages of P.olivaceus
本研究采用RACE法克隆得到牙鲆dazl基因的全长cDNA。序列分析表明牙鲆dazl蛋白是一种RNA结合蛋白,和其它物种一样,其存在一个高度保守的RRM结构域,该结构域含有两个核蛋白信号基团RNP1和RNP2[18-20],能特异地结合各种不同的RNA分子[21],与其蛋白功能有着密切关系[22-23]。系统进化树表明,dazl基因在不同物种间有较高的同源性,并且在物种的系统进化中是比较保守的。
本研究发现,dazl基因主要在牙鲆性腺中表达,且在精巢中的表达高于卵巢,这和在青鳉[9]、虹鳟[11]、半滑舌鳎[14]等鱼的表达是一致的,表明dazl基因在鱼类的两性性腺中特异表达,可能参与鱼类生殖细胞的发育和雌雄配子的发生。在爪蟾中,卵dazlmRNA的缺失可导致原始生殖细胞的缺失[1]。小鼠dazl同源基因的无义突变可引起雌、雄两性不育,在发生无义突变的9日龄小鼠睾丸组织中几乎没有生殖细胞,而在同日龄对照组的野鼠睾丸中发现大量的A型精母细胞,而不是前细线期精原细胞[24]。并且dazl基因发生无义突变的小鼠精子发生障碍主要表现在从A型精母细胞到A1型细胞的分化失败,表明dazl基因是A型精母细胞分化所必需的。以上研究结果表明,dazl基因参与了调节生殖细胞的发育和分化[18-25],是精子发生过程中减数分裂的主要调控因子[19]。
在牙鲆早期发育阶段,dazl基因在未受精卵、受精卵及囊胚期均有较高的转录本,而在原肠胚期表达开始降低,至孵化后3 d一直保持较低的水平。与此类似,斑马鱼dazlmRNA在原肠胚期之前表达量也很高,随后迅速降低[25];同样,dazlmRNA在异育银鲫卵子、受精后1细胞期至囊胚期均有丰富的表达,而在之后逐步消失[1]。研究发现,在异育银鲫成熟卵子中,dazl蛋白集中于植物极皮质层,受精后dazl蛋白逐步迁移到卵裂球,随着胚胎发育过程中原始生殖细胞的形成和迁移,dazl蛋白被限制在原生殖细胞中[1]。这些结果表明dazl基因是母源性基因,贮存在卵子中的mRNA在受精后翻译成蛋白,用于原生殖细胞的形成。因此,dazl基因是鱼类生殖调控的重要因子,本研究关于dazlcDNA序列的克隆与表达分析对于进一步研究其在牙鲆性腺分化过程中的作用机制奠定了基础。
[1] HOUSTON D W,KING M L.A critical role for Xdazl a germ plasm localized RNA,in thedifferentiation of primordial germ cells in Xenopus[J].Development,2000,127(3):447-456.
[2] YEN P H.Putative biological functions of theDAZfamily[J].International Journal of Andrology,2004,27(3):125-129.
[3] TSCHANTER P,KOSTOVA E,LUETJENSCM,et al.No association of the A260G and A386GDAZLsingle nucleotide polymorphismswithmale infertility in a Caucasian population[J].Human Reproduction Update,2004,19(12):2771-2776.
[4] RUGGIU M,SPEED R,TAGGARTM,et al.The mouseDAZLa gene encodes a cytoplasmic protein essential for gametogenesis[J].Nature,1997(389):73-77.
[5] KARASHIMA T,SUGIMOTO A,YAMAMOTO M.Caenorhabditis elegans homologue of the human azoospermia factorDAZis required for oogenesis but not for spermatogenesis[J].Development,2000,127(5):1069-1079.
[6] HOUSTON D W,KING M L.A critical role forXDAZL,differentiation of primordial germ cells inXenopus[J].Journal of Biosciences,2000,127(3):444-456.
[7] VOGEL T,SPEED RM,ROSS A,et al.Partial rescue of theDAZLlnockout mouse by the humanDAZLgene[J].Molecular Human Reproduction,2002,8(9):797-804.
[8] XU E Y,MOORE F L,PERA R A.A gene family required for human germ cell development evolved from an ancientmeiotic gene conserved inmetazoans[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(13):6983-6988.
[9] XU H,LIZ,LIM,et al.Boule is present in fish and bisexually expressed in adult and embryonic germ cells ofmedaka[J].Plos One,2009,4(6):e6097.
[10] Crackower M A,Kolas N K,Noguchi J,et al.Essential role ofFkbp6in male fertility and homologous chromosome pairing in meiosis[J].Science,2003,300(5623):1291-1295.
[11] MINGYOU L,QIAN S,HONGYAN X,et al.Differential conservation and divergence of fertilitygenes boule and dazl in the rainbow trout[J].Plos One,2011,6(1):e15910.
[12] HUAN Y,CHUANG J L,HUA M Y,et al.Differential expression of fertility genes boule and dazl in Chinese sturgeon(Acipenser sinensis),a basal fish[J].Cell&Tissue Research,2015,360(2):413-425.
[13] PENG J X,XIE J L,ZHOU L,et al.Evolutionary conservation of Dazl genomic organization and its continuous and dynamic distribution throughout germ line development in Gynogenetic Gibel carp[J].Science,2009(312B):855-871.
[14] 张 红.半滑舌鳎性别相关基因DAZL和WTLA的克隆和表达分析[D].青岛:中国海洋大学,2013.
ZHANG H.Molecular cloning and expression analysis ofDAZLandWTLAgene in the Half-smooth Tongue-sole,Cynoglossus semilaevis[D].Qingdao:Ocean University of China,2013.
[15] 苏艳芳,付元帅,施志仪,等.牙鲆SRF基因的克隆及真核表达载体的构建[J].海洋渔业,2015,37(4):331-340.
SU Y F,FU Y S,SHI Z Y,et al.Cloning ofSRFfromParalichthys olivaceusand eukaryotic expression vector construction[J].Marine Fisheries,2015,37(4):331-340.
[16] HALL A T.Bioedit:a user-friendly biological sequence alignment editor and analysis program for windows 9s/98/NT[J].Nucleic Acids Symlposium Series,1999(41):95-98.
[17] TAMURA K,DUDLEY J,MASATOSHIN,et al.MEGA4:molecular evolutionary genetic analysis(mega)software version 4.0[J].Molecular Biology and Evolution,2007,24(8):1596- 1599.
[18] REIJO R,LEE T Y,SALO P,et al.Diverse spermatogenic defects in humans caused by Y chromosome deletions encompassing a novel RNA-binding protein gene[J].Nature Genetics,1995,10(4):383-393.
[19] YEN P H,CHAIN N,SALIDO E C.The human autosomal geneDAZLA:testis specificity and a candidate formale infertility[J].Human Molecular Genetics,1996,5(12):2013-2017.
[20] HAAG E S.Rolling back to BOULE[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(13):6983-6985.
[21] BURD C G,DREYFUSSG.Conserved structures and diversity of functions of RNA-binding proteins[J].Science,1994,265(5172):615-621.
[22] NICOLA R,COOKE H J.Role of the DAZ genes in male fertility[J].Reproductive Biomedicine Online,2005,10(1):72-80.
[23] C MARC L,XU E Y,PERA R A R,et al.Association of meiotic arrest with lack of BOULE protein expression in infertile men[J].Journal of Clinical Endocrinology&Metabolism,2004,89(4):1926-1933.
[24] SCHRANS-STASSEN B H,SAUNDERS P T,COOKE H J,et al.Nature of the spermatogenic arrest inDazl-/-mice[J].Biology of Reproduction,2001,65(3):771-776.
[25] MAEGAWA S,YASUDA K,INOUE K.Maternal mRNA localization of zebrafishDAZ-like gene[J].Mechanisms of Development,1999,81(1-2):223-226.
M olecular cloning and expression analysis of dazl gene in Paralichthys olivaceus
SUN Jin-jin,ZHANG Jun-ling,SUNWen-hui,SHIZhi-yi
(Key Laboratory of Freshwater Aquatic Genetic Resources of Ministry of Agriculture,College of Fisheries and Life Science,ShanghaiOcen University,Shanghai201306)
dazl(deleted in azoospermia-like)gene is an important regulator of a variety of species of spermatogenesis.To explore the role ofdazlgene in gonad differentiation and development ofParalichthys olivaceus,the full-length cDNA ofdazlgene was cloned using homology cloning and RACE technology,its sequence structure was analyzed by bioinformaticsmethod,and its gene expression in different adult tissues and during early development ofP.olivaceuswas studied using real-time PCR technology.The results showed that the full-length cDNA sequence ofP.olivaceus dazlwas 2 031 bp,including 105 bp of 5′untranslated region,1 275 bp of 3′untranslated region and 651 bp of open reading frame encoding 217 amino acid residues.Thedazlhad a highly conserved RNA recognition motif,which shared 100%sequence similarities among fish species by amino acid sequence homology comparison.RT-qPCR results showed that thedazlgene wasmainly expressed in gonad,and it had a higher expression level in testis than in ovary.During the early development,thedazlgene had higher transcriptions in the unfertilized egg,fertilized egg and blastocysts,and its expression began to reduce at gastrula stage,and remained at a low level until3 days after hatching.These results suggest that the abundantmaternaldazlmRNA may be involved in the formation of primitive germ cells in the embryonic development.This study provides a basis to further clarify the role ofdazlgene inP.olivaceusreproductive development.
Paralichthys olivaceus;dazl;cDNA cloning;gene expression
Q 782
A
1004-2490(2016)04-0391-09
2016-01-17
国家自然科学基金青年项目(41306128),国家自然科学基金面上项目(30271017)
孙近近(1989-),女,安徽人,在读理学硕士,生物学方向。Tel:021-61900437,E-mail:jjsun1110@163.com
施志仪,教授。Tel:021-61900437,E-mail:zyshi@shou.edu.cn

