樱桃根腐病病原鉴定及其生物学特性研究
陈秋芳,梁艳霞,张红娟,吴红玉,王美琴*
(1.山西省农业科学院 果树研究所, 山西 太原 030006; 2.山西农业大学 农学院,山西 太谷 030801)
樱桃根腐病病原鉴定及其生物学特性研究
陈秋芳1,梁艳霞1,张红娟2,吴红玉2,王美琴2*
(1.山西省农业科学院 果树研究所, 山西 太原 030006; 2.山西农业大学 农学院,山西 太谷 030801)
摘要:为了有效的防治樱桃树根腐病,采用组织分离法、单孢分离法、形态学特征和柯赫氏法则对樱桃根腐病的病原进行了分离纯化和鉴定;并采用菌落直径生长速率法和悬滴法测定了致病菌的培养条件及其对6种杀菌剂的敏感性。研究结果表明引起樱桃根腐病的病原为腹状镰孢菌(FusariumventricosaAppel & Wollenweber);病原菌在PSA培养基上生长最好,25 ℃和偏酸性条件有益于孢子的萌发,而光照对孢子的萌发没有影响。供试的6种杀菌剂中, 樱桃根腐病菌对多菌灵最敏感,EC50为 0.431 4 μg·mL-1,其次是苯醚甲环唑和扑海因,EC50分别为34.999 3 μg·mL-1和85.092 9 μg·mL-1。研究结果对指导樱桃根腐病的防治具有一定的意义。
关键词:樱桃根腐病;病原鉴定;腹状镰孢菌;生物学特性
樱桃因其上市早,色泽艳丽,果实营养丰富,含有糖、蛋白质、维生素以及钙、铁、磷、钾等多种微量元素,具有很高的食用价值,深受果农及消费者的喜爱。近年来对其在培育优质品种资源方面进行了大量的研究,出现了许多优良的品种[1~5],但随着种植面积的扩大和种植环境的变化,出现了发病率上升、抗病性降低的问题,影响了樱桃的产量[6,7],尤其是樱桃树因根颈腐烂导致整株死亡的现象日趋严重,病株率达20%,地上部分表现出营养不良症状,部分枝干上叶片发黄,严重的枝干枯死,给果农造成了严重的经济损失。Jones在1986年报道了美国Michigan有该病害的发生[8],Vettraino在2008年报道了意大利首次发现樱桃根腐病[9],在我国山东、山西、河南等地均有该病发生,并且有逐年加重的趋势[10,11]。为了有效的预防和控制该病害的发生,病原菌的鉴定是病害防治的重要环节,也是进行病害发生规律和防治技术研究的基础。本试验采用常规的组织分离法进行病原菌的分离纯化后回接,按照柯赫氏法则的程序对樱桃根腐病进行病原鉴定,并对致病菌的培养条件及其对常用杀菌剂的敏感性进行了初步研究,为樱桃根腐病的防治提供理论依据。
1材料和方法
1.1 材料
培养基:① PDA培养基:马铃薯200 g,琼脂粉15 g,葡萄糖20 g,蒸馏水1 000 mL;不加琼脂粉的为液体培养基。②PSA培养基:马铃薯200 g,琼脂粉15 g,蔗糖20 g,琼脂粉15 g,蒸馏水1 000 mL。③Bilai’s培养基:KH2PO41 g,KNO31 g,KCl 0.5 g,MgSO4·7H2O 0.5 g, 淀粉0.2 g,葡萄糖0.2 g,蔗糖0.2 g,琼脂粉15 g,水1 000 mL。④查彼培养液:NaNO32 g,KCl 0.5 g,FeSO4·7H2O 0.1 g,K2HPO41 g,MgSO4·7H2O 0.5 g,蔗糖30 g,琼脂粉15 g,蒸馏水1 000 mL。
供试材料:樱桃树病根(2013年7月采自山西省农科院果树研究所樱桃园 )
供试药剂:10%苯醚甲环唑水分散粒剂(瑞士先正达作物保护有限公司),75%百菌清可湿性粉剂(深圳诺普信农化股份有限公司),70%甲基托布津可湿性粉剂(美国阿普顿有限公司生产),50%扑海因可湿性粉剂(法国罗纳普朗克北京办事处),80%多菌灵可湿性粉剂(大仓市农药厂有限公司),80%代森锰锌可湿性粉剂(西安近代农药科技股份有限公司)。
1.2 樱桃根腐病病原菌的分离与鉴定
1.2.1病组织上病原的形态学鉴定
樱桃病根涂片显微镜检测:于2013年7月挖取病根,病根表面有白色菌丝层,实验室进行手工切片后在显微镜下观察病原真菌的产孢结构及分生孢子类型,初步确定寄生真菌的分类地位。
1.2.2樱桃根腐病菌的分离纯化和单孢分离
分离纯化:取直径约1 mm粗细的新鲜病根,先用自来水将表面的泥土冲洗干净,70%的酒精浸泡1 min进行表面消毒,再用无菌水冲洗3~4次,然后在超净工作台上用灭菌的手术刀和镊子撕去皮层组织,将中间木质部切成约为3 mm左右的小段置于PDA平板中央,25 ℃下恒温培养。待材料边缘有菌落长出时,将不同的菌落分别挑到PDA平板上进行纯化。
单孢分离:将纯化后培养的分生孢子用无菌水配成孢子浓度约为103个·mL-1,取25 μL孢子悬浮液涂布于PDA平板上,25 ℃恒温培养箱中黑暗培养,从分散的单个菌落上移植菌丝体进行培养。纯化后的菌株在 25 ℃恒温培养4 d后,观察菌落形态特征,产孢细胞,大、小分生孢子和厚垣孢子的形态。
1.2.3回接试验
将分离纯化的单胞菌系对樱桃进行蘸根接种试验。选用大小相同,生长状况相近的1年生樱桃健康盆栽苗,用灭菌的接种针刺伤根毛,将樱桃苗的根浸泡在孢子浓度为106个·mL-1的孢子悬浮液中10 h,取出后栽种在花盆中,每个花盆栽种一株,共栽种10株。盆栽土壤用孔径为5 mm土壤筛处理后在160 ℃的干燥灭菌箱中灭菌1 h,冷却后使用。以无菌水浸泡的樱桃苗作为对照。定期观察植株发病情况,如地上部分出现黄化症状后,采集樱桃病根进行分离纯化,镜检分离物并与原始菌株比较。
1.3 致病菌的生物学特性
1.3.1不同培养基对菌落生长及产孢量的影响
用打孔器在培养3 d的菌落边缘取直径6 mm的菌块,并将其正面朝下置于不同培养基平板中央,置于25 ℃的恒温箱中黑暗培养。每个处理重复3次,培养2 d后开始测量菌落净生长量,培养4 d 后用直径10 mm打孔器分别在菌落中间位置打取5个菌块,放入有10 mL无菌水的试管中(加入少许明胶),用振荡器充分振荡洗涤后,用血球记数板计测洗涤液中分生孢子数,重复测定3次,计算1 mL孢子悬浮液的产孢量。
1.3.2温度、pH及光照对孢子萌发的影响
采用悬滴法测量孢子萌发率[12]:用无菌水加少许明胶将培养4 d的致病菌制成浓度为106个·mL-1的孢子悬浮液。用移液器取0.05 mL的孢子悬浮液滴在洁净的盖玻片中央,在盖玻片的边缘涂上一层凡士林,然后快速翻转放在凹陷的载玻片上,轻压使盖玻片粘在载玻片上,将载玻片放在培养皿中,皿底放置浸水的棉花团保湿。置于不同条件下培养。36 h后在16×40倍的显微镜下观察孢子萌发状况,当芽管长度超过孢子直径一半记为萌发,每个处理3次重复,每个载玻片观察3个视野,即每个处理观察9个视野,计算孢子的平均萌发率。
温度的设置:将培养箱的温度分别调节到10 ℃,15 ℃,20 ℃,25 ℃,28 ℃,30 ℃下黑暗培养;pH的影响:用1%盐酸和1%氢氧化钠溶液将无菌水的pH分别调至5.5,6.0,6.5, 7.0,7.5,8.0和8.5共6个处理,25 ℃下黑暗培养;光照的影响:将光照培养箱设置成光照、黑暗、4 h光照和黑暗交替3个处理,置于25 ℃下培养。
1.3.3不同药剂对樱桃根腐病菌的室内毒力测定
含药平板的制备:用无菌水将供试杀菌剂配置成浓度为1 000 μg·mL-1的母液,用无菌水将母液稀释成浓度分别为400、200、100、50 μg·mL-1稀释液。用移液枪取各稀释液1 mL注入不同的无菌培养皿中,同时倒入冷却至50 ℃左右的PDA培养基9 mL,轻轻摇匀,制成浓度分别为100、40、20、10、5 μg·mL-1的含药平板,以加无菌水为空白对照。
毒力测定:用打孔器在培养3 d的菌落边缘取直径为6 mm的菌块接入各含药平板中央,置于25℃恒温培养箱中培养,每个处理3个重复,4 d 后测量菌落直径,按照下列公式计算抑制率,使用DPS软件处理后得到毒力回归方程、相关系数及EC50值。
抑制率/%=(对照菌落直径-处理菌落直径)/(对照菌落直径-6 mm)×100%
2结果与分析
2.1 樱桃根腐病致病菌的分离和鉴定
2.1.1樱桃根腐病病原组织分离结果
通过对樱桃根腐病病根的菌丝进行涂片观察发现有大量的镰刀形的大型分生孢子和肾形的小型分生孢子,初步鉴定为无性孢子类的镰孢菌属真菌(Fusariumsp.),除此外没有发现其他的病原菌。
2.1.2樱桃根腐病致病菌的分离和鉴定
致病菌的培养性状:该菌在PDA培养基上生长较快,到第四天时菌落直径达到3.50~4.50 cm,气生菌丝发达,菌落为绒絮状,乳白色。培养2 d后,开始产生分生孢子,15 d时培养基背面中央出现黄色条带,21天黄色条带愈明显(图1中A、B、C和D)。
致病菌的形态特征:分生孢子梗无色,多簇生,有分隔,较少分枝。上端为产孢细胞:单瓶梗(图1E)。分生孢子有两种类型:①小型分生孢子,多卵圆形至椭圆形,无色,单胞至双胞,单生,量度为6.51~16.68×1.35~5.56 μm(图1F)。②大型分生孢子镰刀形,2~3分隔,分隔不太明显,量度为29.79~38.50×5.85~6.68 μm(图1G)。厚垣孢子:第15 d开始有厚垣孢子,但较少,第21 d形成大量的厚垣孢子,厚垣孢子表面光滑,单生或者2~3个串生,在短侧枝的末端形成(图1H)。
病菌的生长速度、培养性状和子实体形态均与已报道的腹状镰孢菌(FusariumventricosaAppel & Wollenweber)相似[13]。根据分离物的培养性状和形态学特征,最后初步将引起樱桃根腐病的致病菌鉴定为腹状镰孢菌(FusariumventricosaAppel & Wollenweber)。
2.1.3病原菌致病性测定
病原菌致病性测定人工回接结果表明,只有接种了该菌的植株表现出了与田间相同的症状,再分离菌株在25 ℃培养3 d时的菌落形态与原接种体一致,经测量其孢子形态及大小也与原接种体一致,符合柯赫氏法则,故证实分离的菌株为樱桃根腐病的致病菌。
2.2 致病镰孢菌的生物学特性
2.2.1不同培养基对菌落生长及产孢量的影响
由表1可以看出, 25 ℃条件下致病镰孢菌在4种培养基上都能够正常扩展和产孢。在PSA和查氏培养基上生长量最大,与其它处理差异显著,4 d时菌落直径超过35.0 mm;在Bilai’s和查氏培养基上大孢子的产孢量最大,分别为2.1×105个·mL-1和1.9×105个·mL-1,在PDA上大孢子的产孢量最小;小孢子在PSA培养基上产量最大为2.6×105个·mL-1,与其他处理差异显著。
表1不同培养基上致病菌的菌落直径和产孢量
Table 1The colony diameter and spores number ofFusariumventricosain different culture medium
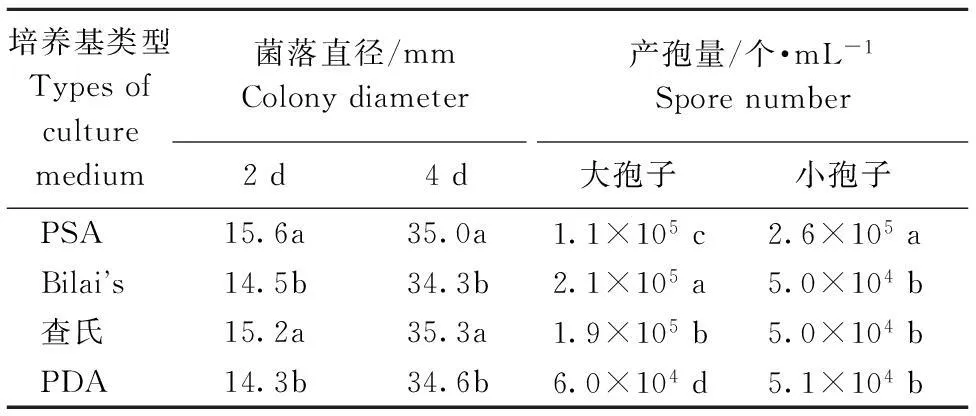
培养基类型Typesofculturemedium菌落直径/mmColonydiameter产孢量/个·mL-1Sporenumber2d4d大孢子小孢子PSA15.6a35.0a1.1×105c2.6×105aBilai s14.5b34.3b2.1×105a5.0×104b查氏15.2a35.3a1.9×105b5.0×104bPDA14.3b34.6b6.0×104d5.1×104b
注:不同小写字母表示P<0.05差异显著水平,下同。
Note: Differrent capital letters show significant difference at the 0.05 level ,the same below.
2.2.2温度、pH及光照对致病菌孢子萌发的影响
试验结果表明:致病镰孢菌孢子在18~30 ℃范围内均能萌发,在25 ℃时萌发率最高为89.5%(图2)。pH为6.5时孢子的萌发率最高为96.3%(图3)。光照对孢子的萌发影响差异不显著,无论在光照或黑暗条件下孢子均正常萌发。
2.2.36种杀菌剂对致病菌的毒力测定
由表2可知,苯醚甲环唑、扑海因、多菌灵3种药剂对樱桃根腐病致病菌有很好的抑制作用。多菌灵对樱桃根腐病菌的毒力最大,EC50为0.431 4 μg·mL-1,与其它处理相比差异显著。其次是苯醚甲环唑和扑海英EC50分别为34.999 3 μg·mL-1和85.092 9 μg·mL-1。百菌清、甲基托布津和代森锰锌3种杀菌剂的EC50都超过300 μg·mL-1,对病原菌的毒性较弱。
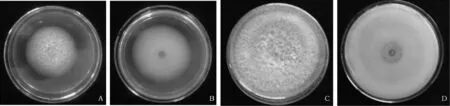
(A和C:培养4 d和21 d菌落正面;B和D培养4 d和21 d菌落背面)(A&C:colonies faces of 4 and 21days;B&D:colonies backs of 4 and 21days)

图1 樱桃根腐病致病菌的培养性状和形态特征Fig.1 The culture characteristics and the morphological features of pathogen
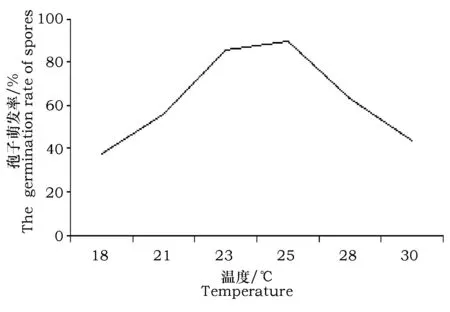
图2 不同温度下分生孢子的萌发率Fig.2 The germination rate of spores in different temperature

图3 不同pH值下分生孢子萌发率Fig.3 The germination rate of spores in different pH
表26种杀菌剂对樱桃根腐病致病菌的毒力测定
Table 2The toxicity of 6 fungicides against theFusariumventricosaof cheery tree root-rot

杀菌剂Biocide毒力回归方程Virulenceregressionequation相关系数RCorrelationEC50百菌清Y=3.4499+0.5643X0.9532558.2874a甲基托布津Y=3.0929+0.7354X0.9369391.9969b苯醚甲环唑Y=4.1065+0.5787X0.980434.9993d扑海因Y=2.7435+1.1693X0.888485.0929c代森锰锌Y=3.0328+0.7148X0.9770565.1359a多菌灵Y=5.1901+0.5207X0.99160.4314e
3讨论
对于引起樱桃根腐病病原,上世纪90年代,美国纽约州农业实验站从樱桃病根和根颈中分离出引起根腐病的致病菌为疫霉属真菌[10],Jones和Vettraino先后报道的引起樱桃根腐病的病原均为疫霉属的隐地疫霉Phytophthoracryptogea[8,9]。国内还未见这方面明确的报道,本试验通过形态观察、培养形状及柯赫氏法则确定引起樱桃根腐病的病菌为腹状镰孢菌Fusariumventricosa,虽然与
国外学者报道的有出入,但据资料研究得知,引起植物根腐病的病原种类不止一种,如赵思峰等分离和鉴定了新疆甜菜根腐病的病原种群是以镰孢菌、丝核菌和腐霉菌为主[14],国外Pivonia等从甜瓜病株的根部分离到腐皮镰孢菌 [Fusariumsolani(Mart.) Sacc.][15]。中国林兰稳等从番茄根腐病和粉葛根腐病中都分离到了镰孢菌(Fusarium)[16,17]。本试验采集的样本较单一,所以在今后的工作中,针对全国主要樱桃产区的根腐病,需采用传统形态学方法结合分子鉴定,进一步明确我国樱桃根腐病致病菌的种群结构。
对于根腐病的防治,目前在生产中主要以增强树势,注意防冻保暖,病根处理以及药剂灌根来控制病害的扩展[10,11]。结合本试验结果,还应该从改良土壤,调节微生态环境等方面来控制病害的发生。
4结论
引起樱桃根腐病的致病菌为无性孢子类镰孢菌属的腹状镰孢菌FusariumventricosaAppel & Wollenweber。PSA培养基有利于菌落生长和孢子的产生,25 ℃和酸性条件有利于孢子的萌发,而光照和黑暗对孢子的萌发没有影响,多菌灵对致病菌的毒性最强,所以在发病初期建议使用多菌灵灌根,可以有效的抑制病原菌的萌发,控制病害的扩展。
参考文献
[1]职倩倩,赵长竹,顾红,等.露地和日光温室甜樱桃花芽发育特征及胚珠多糖定位观察[J].果树学报,2012, 29(3):466-470.
[2]王廿,张开春,王晶,等. 6个甜樱桃品种ACO基因多态性的检测[J].果树学报, 2012, 29(3):359-365.
[3]黄晓姣,王小蓉,陈涛,等.中国樱桃遗传资源多样性研究进展[J].果树学报, 2013,30(3):470-479.
[4]魏海蓉,宗晓娟,王甲威,等.甜樱桃四倍体杂种砧木Y1 高频、高效离体再生体系研究[J].果树学报, 2012, 29(1):49-52.
[5]赵长竹,姜建福,张慧琴,等.甜樱桃花芽分化后期特征观察[J].果树学报, 2012, 29(1):42-48.
[6]侯纪展,王钦伦,田宝江,等.大樱桃根癌病的发生与防治试验[J] . 北方果树, 2006,(2):11-12.
[7]刘保友,张伟,栾炳辉,等. 大樱桃褐斑病病原菌鉴定与田间流行动态研究[J].果树学报, 2012, 29(4):634~637.
[8]Jones A L, Bielenin A, Proffer T, et al. Identification and distribution of root rot problems in sour cherry in Michigan[J].Annual report michigan state horticultural society, 1986:71-78.
[9]Vettraino A M, Flamini L, Pizzichini L, et al. First Report of Root and Collar Rot byPhytophthoracryptogeaon Sweet Cherry in Italy [J].Plant disease, 2008, 92(1):177.
[10]丁通翔,张福兴,李淑平.大樱桃根颈腐烂病的发生与防治[J].烟台果树, 2006(1):29-30.
[11]董晓燕.大樱桃根颈腐烂病防治技术初探[J].青海农林科技,2013(2):60-61.
[12]方中达.植病研究方法[M].北京:中国农业出版社, 1998(3):512-153.
[13]王拱辰,郑重,叶琪明,等. 常见镰刀菌鉴定指南[M].北京:中国农业科技出版社, 1996:1-45.
[14]赵思峰,李国英,李晖,等.新疆甜菜根腐病病原种群鉴定[J].中国糖料, 2006(1): 3-8.
[15]Pivonia S, Cohen R, Kafkafi U, et al. Sudden wilt of melons in southern Israel: Fungal agents and relationship with plant development[J].Plant diease, 1997, 81:1264-1268.
[16]林兰稳,李兆雄,何熊威,等.粉葛根腐病的病原鉴定[J].生态环境, 2003, 12(4):516-517.
[17]周黎,李国英,丁建军.新疆加工番茄根腐病病原的分离和鉴定[J].新疆农业科学,2008, 45(1):130-134.
(编辑:张贵森)
Identification and biological characteristics research of the pathogen from cherry tree root-rot
Chen Qiufang1, Liang Yanxia1, Zhang Hongjuan2, Wu Hongyu2, Wang Meiqin2*
(1.PomologyInstitute,ShanxiAcademyofAgriculturalSciences,Taiyuan030006,China; 2.CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030800,China)
Abstract:In order to effectively prevent and control occurrence and damage of cherry root-rot. Isolation and identification of pathogen were studied according to the morphological features, culture characteristics, monospore isolation and Koch,s postulates, The colony growth and spores germination were researched in relation to cultural conditions and the sensitivity of fungicides. Results showed that the pathogen was identified asFusariumventricosaAppel & Wollenweber. Mycelium growth and spores production were better on PSA medium, 25 ℃ and acidic condition, but light had no effect on spores production. Among 6 kinds of fungicides, carbendazim showed the best distinguished toxicity against the pathogen, and the EC50was 0.431 4 μg·mL-1. difenoconazole and iprodione were also effective to the pathogen, EC50were 34.999 3 μg·mL-1and 85.092 9 μg·mL-1respectively. The results have certain significance for prevening and controlling cherry root-rot.
Key words:Cherry tree root-rot; Pathogen identification;FusariumventricosaAppel & Wollenweber; Biological characteristics
中图分类号:S432.1
文献标识码:A
文章编号:1671-8151(2016)01-0015-05
基金项目:山西省科技攻关项目(20120311016-2);博士科研启动项目(2013YJ10);山西省农科院育种基金(Yyzjc1312)
通讯作者:*王美琴,副教授,硕士生导师。Tel:13935492918;E-mail:sxndwmq1973@163.com
作者简介:陈秋芳(1971-),女(汉),山西汾西人,副研究员,研究方向:果树栽培育种
收稿日期:2015-07-21修回日期:2015-10-09

