柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库的构建
徐帅兵,黄 兵,3,赵其平,董 辉,朱顺海,崔晓霞,谢雨翔,唐 敏,2,杨志远,2,韩红玉
(1. 中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2. 上海师范大学 生命与环境科学学院,上海 200234;3. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库的构建
徐帅兵1,黄 兵1,3,赵其平1,董 辉1,朱顺海1,崔晓霞1,谢雨翔1,唐 敏1,2,杨志远1,2,韩红玉1
(1. 中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2. 上海师范大学 生命与环境科学学院,上海 200234;3. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
为了筛选柔嫩艾美耳球虫子孢子入侵相关的蛋白,利用酵母双杂交体系构建了柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库。提取纯化的子孢子总RNA,经MMLV-RT反转录合成cDNA第一链后,利用LD-PCR扩增合成双链cDNA(ds cDNA),dscDNA经纯化柱CHROMA SPINT+TE-400 Columns 纯化剔除小于200 bp的片段。将纯化后dscDNA、pGADT7-Rec及CarrierDNA共转化到已经制备好的酵母感受态细胞Y187中,dscDNA与pGADT7-Rec以同源重组的方式在细胞内进行连接,经过缺陷性培养基(SD/-Leu)的筛选得到酵母双杂交cDNA文库。结果显示,构建的柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库的转化率为4.33×105/μg pGADT7-Rec,文库滴度为3.62×107cfu/mL。随机挑取32个单克隆进行PCR检测,插入片段大小为200~2000 bp,重组率为93.75%,并以该文库作为模板,用柔嫩艾美耳球虫5对特异性引物进行PCR扩增,获得了这5个基因片段。结果表明成功构建了柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库,为进一步筛选和研究球虫入侵互作蛋白奠定了基础。
柔嫩艾美耳球虫;子孢子;酵母双杂交cDNA文库;同源重组
鸡球虫病是由几种艾美耳球虫(Eimeria)寄生于鸡肠道并在繁殖过程中严重损害肠道组织细胞而引起的一种全球性寄生虫病,给养鸡业带来了巨大的经济损失。集约化养鸡场尤其为鸡球虫的生存和传播提供了更多的便利条件[1]。据报道在我国鸡群中流行的鸡球虫有9种[2],其中柔嫩艾美耳球虫(E. tenella)和毒害艾美耳球虫(E. necatrix)毒力较强,危害较大,常引起鸡死亡。柔嫩艾美耳球虫作为顶复器门原虫的成员之一,属于专性细胞内寄生虫,它们有共同的入侵机制。这类寄生虫入侵宿主细胞的过程十分复杂,目前已知是由3种细胞器(微线体、棒状体、致密颗粒)分泌的一系列蛋白的相互作用来完成[3],但是这些相互作用蛋白之间的联系以及蛋白的分泌是由什么信号介导的,至今尚不清楚。所以,研究这些蛋白之间的相互作用机制,可以为寻找新的药物靶标及控制球虫入侵提供有效途径。
由Fields等[4,5]建立的酵母双杂交系统是研究蛋白互作的经典方法,现在已被广泛用于互作蛋白的筛选与鉴定,不仅可以寻找蛋白发挥作用的关键结构域[6],还能建立蛋白质互作图谱[7]等。传统的研究蛋白互作的方法,如Pull-down、Co-IP、免疫共沉淀等,仅能筛选到少量蛋白。酵母双杂交是模拟体内环境在核酸水平上进行,不受环境和试验条件的限制,可以用某个关键的蛋白作为诱饵,对酵母双杂交cDNA文库进行大规模的蛋白筛选,在短时间内即可获得大量的互作蛋白,进而研究蛋白互作的意义及其功能[8]。
国内外很多学者为了研究已知蛋白的功能和作用位点,构建了不同的酵母双杂交cDNA文库。Mahajan等[9]构建了来自猪肾细胞LFBK细胞系的酵母双杂交cDNA文库。Xue等[10]构建了柔嫩艾美球虫第二代裂殖子酵母双杂交cDNA文库。程子英等[11]构建了弓形虫RH株酵母双杂交cDNA文库。由于在球虫的整个生活史中,子孢子是球虫入侵鸡肠道组织细胞的第一阶段,在整个入侵过程中发挥着至关重要的作用。因此,本研究成功利用酵母双杂交方法构建了柔嫩艾美耳球虫子孢子酵母cDNA文库,为进一步筛选子孢子阶段入侵相关的蛋白及功能基因奠定基础。
1 材料与方法
1.1 主要试剂 Trizol试剂盒购于TaKaRa公司;Make Your Own“Mate & PlateTM”Library System User Manual、YPD Medium、YPD Agar Medium、Minimal SD Agar Base、-Leu DO Supplement、Matchmaker Insert Check PCR Mix 2均购自Clontech公司。
1.2 引物设计 根据实验室前期的相关研究,用Primer Primier 5.0软件设计了5个柔嫩艾美耳球虫基因的特异性引物,引物由上海赛百盛公司合成。

表1 本研究所用引物Table1 Primers used in this study
1.3 柔嫩艾美耳球虫子孢子的收集与纯化 柔嫩艾美耳球虫上海株保存于中国农业科学院上海兽医研究所动物原虫病创新团队。首先将5×104个孢子化卵囊/只接种于2周龄无球虫感染的三黄鸡,感染后收集d 6~8粪便中的卵囊,27℃条件下在2.5%重铬酸钾溶液中28℃进行孢子化,至孢子化率达到80%以上,收集卵囊。然后用饱和食盐水漂浮法对孢子化卵囊进行漂浮纯化,收集絮状物,10倍稀释后离心弃上清,沉淀用2倍体积的次氯酸钠悬浮,氧化30 min。按1∶1比例加入蒸馏水稀释,使次氯酸钠含量约为50%,转移至50 mL离心管中离心,收集白色絮状物即为孢子化卵囊。收集的孢子化卵囊经玻璃珠震荡破碎其细胞壁,用灭菌HBBS洗涤以去除部分卵囊壁碎片,然后离心收集孢子囊,经6%鸡胆汁和0.5%胰蛋白酶37℃消化至90%子孢子自孢子囊中溢出。离心,HBBS洗涤2次去除绝大部分孢子囊碎片,沉淀用HBBS悬浮,然后经G4砂芯漏斗过滤,收取滤液,离心弃上清,获得的沉淀即为柔嫩艾美耳球虫子孢子,保存于液氮中备用。
1.4 总RNA的提取 按照子孢子50~100 mg/mL RNAiso Plus比例悬浮子孢子,充分混匀,室温静置5 min。根据Trizol试剂盒的说明书进行操作,最后将得到的总RNA溶解于20μL DEPC水中,紫外分光光度计测定总RNA纯度及浓度,用琼脂糖凝胶电泳分析其完整性。
1.5 第一链的合成 按照Make Your Own“Mate & PlateTM”Library System User Manual说明书步骤,取2 μL总RNA、1.0 μL CDS Ⅲ、1.0 μL ddH2O于无RNase离心管中,离心混匀,72℃孵育2 min,冰上冷却2 min,向离心管中依次加入2.0 μL 5×firststrand buffer、1.0 μL dNTP Mix、1.0 μL DTT、1.0 μL SMART MMLV reverse transcriptase,手指轻弹,离心混匀,42℃孵育10 min。接着加入1 μL SMERT Ⅲ-modified oligo混匀,42℃孵育1 h后,再以75℃孵育10 min终止反应。最后室温冷却,加入1 μL RNase H,37℃孵育20 min,快速离心,使液体聚集管底,-20℃保存备用。
1.6 双链的合成及纯化 将PCR仪预热至95℃,在PCR管中依次加入2 μL first-strant cDNA、10 μL 10×advantage 2 PCR buffer、2 μL 50×dNTP Mix、上下游PCR 引物各2 μL、10 μL 10×melting solution、2 μL 50×advantage 2 polymerase mix、70 μL deionized H2O,总体积为100 μL,离心混匀,分装2管,放到预热的PCR仪中。反应条件:95℃预变性30 s;95℃变性10 s,68℃退火延伸6 min,21个循环;68℃延伸5 min。取4 μL PCR产物保存备用。取出Chroma Spin TE-400柱子,上下颠倒使柱内基质悬浮,去掉上下端盖子,置于1个2 mL收集管中,室温605×g,离心5 min,将柱子置于一个新的收集管中。将上述剩余的PCR产物加入柱中间基质上,室温605×g离心5 min,保留收集管。向收集管中加入预冷的1/10体积的NaAc、2.5倍体积的95%乙醇,上下颠倒使之混匀,-20℃冰箱内放置1 h。室温20598×g离心20 min,小心吸去上清,室温干燥10 min,最后用20 μL ddH2O悬浮沉淀并混匀。dscDNA纯化前后各取4 μL进行凝胶电泳,检验纯化效果,其余-20℃冰箱中保存备用。
1.7 酵母感受态的制备 在YPDA固体培养基上用三区划线法对Y187酵母菌划板,30℃培养3~4 d。挑取4个直径2~4 mm的酵母菌于离心管中,30℃、245 r/min恒温震荡培养11 h,测定其OD600值,选取生长速度最快的继续培养。取酵母菌液5 μL于500 mL锥形瓶中(含有50 mL YPDA液体培养基),30℃、245 r/min恒温震荡培养18~20 h,直至OD600值达到0.15~0.3,946×g离心 5 min,去上清。再用100 mL YPDA液体培养基重悬酵母细胞,30℃、245 r/min震荡培养3~5 h,离心去上清,用无菌ddH2O重悬沉淀,再离心去上清。用TE/LiAc重悬酵母细胞,瞬时离心15 s,去上清,再用TE/LiAc重悬酵母细胞,置于冰上。
1.8 cDNA文库的构建 根据说明书制备好Y187酵母感受态细胞,然后将Carrier DNA、dsDNA、pGADT7-Rec质粒共转化到Y187酵母感受态细胞中,转化产物用0.9% NaCl重悬后均匀涂布于SD/-Leu缺陷性培养基上,30℃恒温培养3~5 d。平板上有大量的酵母长出时,开始收集文库。先将平板在4℃冰箱中预冷3~4 h,向每个平板上滴加4℃预冷的含25%甘油的YPDA液体培养基4 mL,用无菌细胞刮将酵母从培养基上刮下来,收集至锥形瓶中混匀。检测转化子密度大于2×107cfu/mL,若小于该密度,可通过离心浓缩,然后分装于50 mL和1 mL离心管中,-70℃冰箱中保存备用。
1.9 文库质量的鉴定
1.9.1 转化效率的检测 筛选转化子时,取100 μL转化混合物按1∶10、1∶102、1∶103稀释。每个稀释度取50 μL涂布于100 mm的SD/-Leu缺陷性培养基上,30℃培养3~5 d,统计生长出的菌落数量,计算转化效率(转化率=N×稀释倍数×转化混合物总体积/铺板体积)。
1.9.2 文库容量检测 文库菌液按1∶10、1∶102、1∶103、1∶104、1∶105稀释,每个稀释度取50 μL涂布于100 mm的SD/-Leu缺陷性培养基上,30℃培养3~5 d,统计生长出的菌落数量,再计算文库滴度(文库滴度=N×稀释倍数/铺板体积)。
1.9.3 插入片段大小检测 用牙签从文库滴度检测的SD/-Leu平板上分别挑取32个单克隆,溶于50 μL ddH2O中,再用Matchmaker Insert Check PCR Mix 2进行PCR鉴定。反应体系:PCR Mix 45μL、模板5μL。PCR程序:94℃预变性1 min;98℃变性10 s,68℃退火延伸3 min,30个循环。经1%琼脂糖凝胶电泳检测分析文库插入片段的大小以及重组率。
1.9.4 用柔嫩艾美耳球虫特异性引物从文库中钓取基因 取1 mL cDNA文库,于液氮和沸水中反复冻融5次,破坏酵母细胞壁,3783×g离心5 min,取上清作为模板,用柔嫩艾美耳球虫的特异性引物进行PCR扩增。反应体系:模板3 μL、上下游引物各1 μL、2×PCR Mix 12.5 μL、ddH2O 7.5 μL。PCR程序:95℃预变性2 min;95℃变性40 s, 50℃~60℃退火40 s(根据各个引物Tm值有所改变),72℃延伸2 min,30个循环;72℃再延伸5 min;4℃结束。PCR产物用1%琼脂糖凝胶电泳检测,将与原序列大小相近的单一条带切下,胶回收PCR产物,并与pGEMT-easy Vector连接过夜,转化到大肠杆菌感受态细胞TOP10中,37℃培养10~12 h。挑取单克隆摇菌,取1 mL送去测序,并将测序结果与原序列进行Blast比对。
2 结果
2.1 柔嫩艾美耳球虫孢子化卵囊及子孢子的纯化 用纯种柔嫩艾美耳球虫接种2周龄无球虫鸡,收集感染后6~8 d的卵囊,在2.5%重铬酸钾溶液中于 28℃培养后获得孢子化卵囊,经饱和食盐水漂浮和次氯酸钠纯化后获得纯化的孢子化卵囊(图1A)。孢子化卵囊经玻璃珠破碎后,经胰酶和胆汁消化,子孢子从孢子囊逸出,再经G4漏斗过滤纯化后获得纯化的子孢子(图1B)。

图1 孢子化卵囊(A)和子孢子(B)的纯化Fig.1 Purif cation of the sporulated oocysts(A) and sporozoite(B)
2.2 子孢子总RNA的提取 提取子孢子总RNA后,经紫外分光光度计测定总RNA浓度为1077.7 ng/μL,OD260/OD280为1.98。经1%琼脂糖凝胶电泳后可以看到3条较亮的条带,分别是28S、18S和5S(图2)。结果说明提取的柔嫩艾美耳球虫子孢子总RNA的纯度和质量较高,可用于后续子孢子酵母cDNA文库的构建。

图2 子孢子总RNA电泳图Fig.2 Electrophoretogram of total RNA from sporozoite
2.3 双链cDNA的扩增及纯化 分别取纯化前后的dscDNA 4 μL进行1%琼脂糖凝胶电泳,结果表明,纯化后的dscDNA较纯化前剔除掉了小于200 bp的片段,且纯化后的dscDNA主要集中在200~2000 bp之间,表明分布比较完整(图3)。

图3 柔嫩艾美耳球虫子孢子双链cDNA纯化前后电泳结果Fig.3 Electrophoretogram of unpurif ed and purif ed double-stranded cDNA of sporozoite of Eimeria tenella
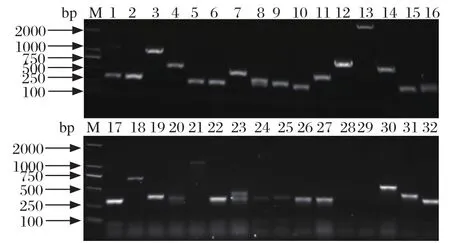
图4 柔嫩艾美耳球虫子孢子文库插入片段cDNA的 PCR鉴定Fig.4 PCR identif cation of the inserted fragments size ofcDNA lbrary from sporozoite of Eimeria tenella
2.4 文库质量的鉴定 通过对SD/-Leu平板上的菌落计数,经公式计算得到子孢子cDNA文库转化效率为4.33×105/μg pGADT7-Rec,文库滴度为3.62×107cfu/mL。随机挑取32个单克隆进行PCR,PCR产物经凝胶电泳,结果显示条带主要集中在400~2 000 bp之间,平均长度约为1000 bp,有2个单克隆没有转化成功,表明文库重组率为93.75%(图4)。2.5 特异性引物扩增获得球虫基因 以柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库反复冻融离心获得的上清作为模板,用柔嫩艾美耳球虫5个特异基因的引物进行PCR扩增。电泳检测结果表明,扩增出了5个特异性基因(ETH_00007915、ETH_00008865、EtCHP317、EtMIC2 、EtADF)(图5),测序后进行比对,与原序列100%同源,表明所构建的柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库质量较好,包含有该阶段所表达的特异性基因,可用于后续的研究。

M: DNA分子量标准(DL2000); 1: ETH_00007915; 2: ETH_00008865; 3: EtCHP317; 4: EtMIC2; 5: EtADFM: DNA Marker(DL2000); 1: ETH_00007915; 2: ETH_00008865; 3: EtCHP317; 4: EtMIC2; 5: EtADF
3 讨论
构建一个高质量的酵母cDNA文库是在真核细胞体内高效、大量地筛选与已知蛋白有互作关系的蛋白以及研究蛋白间功能的前提。本研究分离纯化获得柔嫩艾美耳球虫子孢子,提取总RNA,经紫外分光光度计测得OD260/OD280为1.97,28S、18S和5S条带清晰,说明提取的总RNA质量良好,能用于后续的实验。直接用总RNA反转录合成第一链,避免了mRNA在分离过程中被污染和降解,再用LD-PCR合成dscDNA,经过柱纯化后的dscDNA较纯化之前,剔除了200 bp以下的小片段,避免了其在后期筛选过程中的干扰,可减少假阳性。能用于酵母双杂交系统的高质量cDNA文库须满足以下条件,文库的转化率大于3.3×105/μg pGADT7-Rec,文库容量大于2.0×107cfu/mL,重组率大于90%。经过鉴定,本研究构建的柔嫩艾美耳球虫子孢子cDNA文库的转化效率为4.33×105/μg pGADT7-Rec,文库容量为3.62×107cfu/mL,重组率为93.75%。同时,根据实验室前期已研究的柔嫩艾美耳球虫特异性基因,以该文库为模板,成功克隆出了长度不同的5个球虫特异性基因,说明本研究构建的子孢子酵母cDNA文库可用于后续的相互作用蛋白的筛选。
本文库在构建时选用的引物是CDS Ⅲ(OligodT),较Random Primer有一定的优势。利用Oligo-dT扩增时,逆转录酶MMLV-RT通过OligodT Primer与mRNA的PolyA结合而延伸,当延伸到mRNA的5' 端遇到“帽子结构”时,会在已合成的cDNA 3' 端加上几个C碱基。这时Oligo(dG)会与cDNA末端突出的C碱基进行配对,逆转录酶自动转换模板,以SMART引物为模板继续延伸至末端,获得的cDNA一端有Oligo-dG,另一端有Oligo-dT已知序列。根据已知序列设计上、下游引物进行LDPCR就会扩增出大量的全长双链cDNA,保证了基因的完整性[12,13]。而Rondom Primer上的6个随机碱基是自由结合在mRNA的任何部位,由于该引物的特异性不强,扩增得到的大部分是一些片段基因,很少能得到全长基因。这样就有可能导致一些基因重要结构域的不完整或者缺失,不利于后期的筛选。
酵母双杂交cDNA文库的构建在球虫研究中已有应用。薛璞等[14]构建了柔嫩艾美耳球虫子孢子cDNA文库,且利用该文库筛选了柔嫩艾美耳球虫顶膜抗原1(EtAMA1)可能的相互作用蛋白。本研究构建的子孢子酵母双杂交cDNA文库选用的酵母菌株是Y187,因此在筛选文库时所用诱饵菌株应为Y2HGold。薛璞等[14]构建的子孢子酵母双杂交cDNA文库的酵母菌株是AH109,诱饵菌株是Y187。酵母菌株Y2HGold与AH109两者的区别在于,Y2HGold菌株中的AUR1基因某个碱基发生了突变,即AUR1-C,突变后的菌株能够对金担子素A(aureobasidin A,AbA)产生抗性,而AH109不包含这个突变基因,对AbA敏感[15]。所以在后期文库筛选中AUR1-C作为一个报告基因,使得筛选条件更加的严格,减少了假阳性产生的几率。
近年来,随着cDNA文库技术的不断改进和完善,使得酵母双杂交方法的应用更加广泛。Li等[16]利用酵母双杂交方法获得了与日本血吸虫抱雌沟蛋白互作的5个蛋白的ESTs序列。Wang等[17]利用酵母双杂交筛选获得了与MIC2整合素A样结构相互作用的2个宿主蛋白LAMTOR1、RNaseH2B。Leneghan等[18]将亲免素(PfFKBP)作为诱饵,用酵母双杂交的方法从疟原虫cDNA文库中筛选到了11个可能与免疫抑制有关的基因。这些研究为以后利用酵母双杂交cDNA文库筛选寄生虫功能基因提供了新的思路和方法。本研究成功构建了柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库,为进一步筛选与球虫入侵相关的蛋白及功能基因奠定了基础。
[1] Shirley M W, Smith A L, Pblake D. Challenges in the successful control of the avian coccidian[J]. Vaccine, 2007, 25(30)∶ 5540-5547.
[2] 黄兵, 沈杰, 赵其平, 等. 中国鸡球虫种类与地理分布[J].上海师范大学学报(自然科学版), 2001 (增刊)∶ 1-6.
[3] Carruthers V B, Sibley L D. Sequential protein secretion from three distinct organelles of Toxoplasma gondii accompanies invasion of human fibroblasts.[J]. Eur Jo Cell Biol, 1997, 73(2)∶114-123.
[4] Fields S, Song O. A novel genetic system to detect protein-protein interactions.[J]. Nature, 1989, 340(6230)∶245-246.
[5] Fields S. The Two-Hybrid System to Detect Protein-Protein Interactions[J]. Methods, 1993, 5(2)∶116-124.
[6] Wang Y, Fang R, Yuan Y, et al. Identification of host proteins, Spata3 and Dkk2, interacting with Toxoplasma gondii micronemal protein MIC3[J]. Parasitol Res, 2016, 115(7)∶ 1-11.
[7] Hua S B, Luo Y, Qiu M, et al. Construction of a modular yeast two-hybrid cDNA library from human EST clones for the human genome protein linkage map[J]. Gene, 1998, 215(1)∶143-152.
[8] Han H Y, Lin J J, Zhao Q P, et al. Identification of differentially expressed genes in early stages of Eimeria tenella by suppression subtractive hybridization and cDNA microarray[J]. J Parasitol, 2010, 96(1)∶ 95-102.
[9] Mahajan S, Sharma G K, Matura R, et al. Construction and characterization of yeast two-hybrid cDNA library derived from LFBK cell line[J]. Biologicals Journal of theInternational Association of Biological Standardization, 2015, 43(3)∶ 202-208.
[10] Xue P, Han H Y, Jin YM, et al. Contruction of a yeast twohybrid cDNA library from second-generation. merozoites of Eimeria tenella [J]. Afr J Microbiol Res, 2013, 7(12)∶1035-1040.
[11] 程子英. 弓形虫酵母双杂交cDNA文库构建及与AMA1羧基端相互作用蛋白的筛选[D]. 长春∶ 吉林农业大学, 2014.
[12] Zhu Y Y, Machleder E M, Chenchik A, et al. Reverse transcriptase template switching∶ a SMART approach for full-length cDNA library construction[J]. Biotechniques, 2001, 30(4)∶ 892-897.
[13] Wellenreuther R, Schupp I, Poustka A, et al. SMART amplification combined with cDNA size fractionation in order to obtain large full-length clones[J]. Bmc Genomics, 2004, 5(1)∶1-8.
[14] 薛璞. 柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库的构建及EtAMA1相互作用蛋白的初步筛选[D]. 上海∶ 上海师范大学, 2013.
[15] Kuroda M, Hashidaokado T, Yasumoto R, et al. An aureobasidin A resistance gene isolated from Aspergillus is a homolog of yeast AUR1, a gene responsible for inositol phosphorylceramide (IPC) synthase activity[J]. Mol Gen Genet, 1999, 261(2)∶ 290-296.
[16] 李勉. 18日龄日本血吸虫酵母双杂交cDNA文库的构建及抱雌沟蛋白相互作用因子的筛选[D]. 郑州∶ 河南农业大学, 2009.
[17] Wang Y, Rui F, Yuan Y, et al. Identification of host proteins interacting with the integrin-like A domain of Toxoplasma gondii micronemal protein MIC2 by yeasttwo-hybrid screening[J]. Parasit Vectors, 2014, 7(7)∶ 1-9.
[18] Leneghan D, Bell A. Immunophilin-protein interactions in Plasmodium falciparum[J]. Parasitology, 2015, 142(11)∶ 1-11.
CONSTRUCTION OF A YEAST TWO-HYBRID CDNA LIBRARY FROM SPOROZOITES OF EIMERIA TENELLA
XU Shuai-bing1, HUANG Bing1,3, ZHAO Qi-ping1, DONG Hui1, ZHU Shun-hai1, CUI Xiao-xia1, XIE Yu-xiang1, TANG Min1,2, YANG Zhi-yuan1,2, HAN Hong-yu1
(1. Key Laboratory of Animal Parasitolgy of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China; 3. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
In order to screen the proteins related to the invasion of Eimeria tenella sporozoites, the yeast two-hybrid cDNA library of E. tenella sporozoites was constructed in the present study. The total RNA was isolated from the sporozoites and used as the template to synthesize the f rst-strand cDNAs. The dscDNAs were acquired by long-distance polymerase chain reaction (LD-PCR) using the f rststrand cDNAs as the template and purified with Chroma Spin TE-400 Column to remove less than 200 bp fragments. The dscDNA,pGADT7-Rec and CarrierDNA were co-transformed into Y187 yeast competent cells. The dscDNA were then connected with pGADT7-Rec by homologous recombination reaction to construct the yeast two-hybrid cDNA library of E. tenella sporozoites. The results showed that the conversion ratio and titer of the cDNA library were 4.33×105/μg pGADT7-Rec and 3.62×107cfu/mL, respectively. As demonstrated in PCR amplif cation, the cDNA library contained approximately 93.75% recombinant clones and the inserted cDNA fragments were between 200 bp and 2000 bp. Furthermore, 5 gene fragments were obtained by PCR amplication using the cDNA library as template and 5 specif c pairs of primers of E. tenella. Therefore, it concluded that a yeast two-hybrid cDNA library of the sporozoites was constructed for screening invasion-related interaction proteins of the sporozoites of E. tenella.
Eimeria tenella; sporozoite; yeast two-hybrid cDNA library; homologous recombination
S852.723
A
1674-6422(2016)06-0036-07
2016-09-08
国家自然科学基金(31272557,31572266);农业部中央级公益性科研院所项目(2015JB10)
徐帅兵,男,硕士研究生,预防兽医学专业
韩红玉,E-mail∶ hhysh@shvri.ac.cn

