多发性骨髓瘤预后的影响因素研究
陆敏秋,褚 彬,白砚霞,左杏果,吴梦青,
石 磊,付丽娜,高 珊,房立娟,项秋晴
·论著·
多发性骨髓瘤预后的影响因素研究
陆敏秋,褚 彬,白砚霞,左杏果,吴梦青,
石 磊,付丽娜,高 珊,房立娟,项秋晴
【摘要】目的探讨临床特征、实验室指标、治疗方案对多发性骨髓瘤(MM)预后的意义。方法选取2000年1月—2012年3月北京积水潭医院血液科确诊的初治MM并行化疗、有完整随访资料的患者202例为研究对象,均采用化疗,42例合并放疗。记录患者的性别、年龄、分型、有无重度贫血、血β2微球蛋白水平、C反应蛋白水平、有无低蛋白血症、血钙水平、乳酸脱氢酶水平、骨髓浆细胞比例、骨病分级(MBD分级)、美国东部肿瘤协作组体力状况评分(ECOG评分)、有无复杂核型(G显带核型分析)、有无淀粉样变、有无肾损伤、有无截瘫及是否达到完全缓解(CR)、有无沙利度胺维持治疗(治疗≥6个月)。随访至2015年3月,随访时间1.0~180.0个月。采用多因素Cox比例风险回归分析各因素及采用生存曲线分析DS分期、ISS分期与MM患者总生存期(OS)、无进展生存期(PFS)的相关性;19例患者在确诊后6个月内死亡,采用多因素Logistic回归分析早期死亡的影响因素;根据OS和PFS的共同影响因素及ISS分期对患者进行危险因素分层,分为高危组、中危组、低危组,分析不同危险因素分层患者的预后。结果202例MM患者中53例(26.2%)达到CR,96例(47.5%)达到非常好的部分缓解(VGPR),29例(14.4%)达到部分缓解(PR),总有效率为88.1%。截至随访时间死亡120例。1、3、5、10年生存率分别为80.7%、70.6%、36.1%、7.6%。OS为1.0~180.0个月,中位OS为51.0个月;PFS为1.0~91.0个月,中位PFS为38.0个月。多因素Cox比例风险回归分析结果显示,年龄、重度贫血、低蛋白血症、复杂核型、淀粉样变、截瘫、沙利度胺维持治疗与OS有回归关系(P<0.05);年龄、重度贫血、复杂核型、截瘫、沙利度胺维持治疗与PFS有回归关系(P<0.05)。不同DS分期患者OS比较,差异无统计学意义(χ2=1.710,P>0.05)。不同DS分期患者PFS比较,差异有统计学意义(χ2=12.222,P<0.05)。不同ISS分期患者OS、PFS比较,差异有统计学意义(χ2值分别为15.037及32.222,P<0.05)。单因素分析结果显示,有无重度贫血〔32%(8/25)与6.2%(11/177),χ2=0.512,P=0.039〕、有无淀粉样变〔66.7%(4/6)与7.7%(15/196),χ2=11.460,P=0.007〕患者早期死亡率比较,差异有统计学意义。多因素Logistic回归分析结果显示,淀粉样变是早期死亡的独立影响因素〔β=2.178,SE=0.915,Wald χ2=5.669,P=0.017,OR=8.826,95%CI(1.470,53.002)〕。不同危险因素分层患者OS、PFS比较,差异有统计学意义(P<0.001)。结论MM患者预后影响因素复杂多样,高龄、合并重度贫血、低蛋白血症、复杂核型、淀粉样变、截瘫的患者预后较差,沙利度胺维持治疗的患者可获得更长的生存期,ISS分期较DS分期更有预测预后的意义,合并淀粉样变患者早期死亡风险大。根据OS和PFS的共同影响因素及ISS分期对患者进行危险因素分层对预测患者预后有意义。
多发性骨髓瘤(multiple myeloma,MM)是一种血液系统常见的恶性肿瘤。由于血液中的浆细胞克隆性增生,导致体内多器官损伤,患者最终出现骨质破坏、贫血、肾功能不全、高钙血症及易感染等[1]。近年来,随着硼替佐米、沙利度胺、雷利度胺等靶向新药的应用,MM患者总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS)较前延长[2]。随着疗效及生存期的不断延长,需要重新评估MM的预后分层体系以及疗效评判体系以指导治疗。因此,了解新药应用情况下MM预后影响因素具有重要意义。本研究回顾性分析202例MM患者的临床资料,统计OS和PFS,探讨影响患者预后的主要因素。
1资料与方法
1.1纳入标准(1)符合国际骨髓瘤工作组[3]诊断标准的初治MM患者。(2)有完整随访资料。
1.2临床资料根据纳入标准选取2000年1月—2012年3月北京积水潭医院血液科MM患者202例为研究对象,其中男127例,女75例;年龄29~84岁,中位年龄57岁;IgG型133例(65.8%),IgA型28例(13.9%),
本研究创新点:
随着我国步入老龄化社会,多发性骨髓瘤发病率呈明显上升趋势。近年来,多发性骨髓瘤的预后分层对治疗的指导作用越来越受到重视。本研究的创新点在于:(1)对202例多发性骨髓瘤患者进行长达15年的追踪随访,完善临床特征及实验室指标,根据多发性骨髓瘤细胞生物学特征并结合靶向新药应用来评估多发性骨髓瘤患者的预后和早期死亡的影响因素。(2)根据总生存期和无进展生存期的共同影响因素及ISS分期对患者进行危险因素分层,有效区分预后,指导多发性骨髓瘤的临床治疗,并指出以硼替佐米为主的化疗方案可延长高危组患者的无进展生存期。(3)将沙利度胺维持治疗纳入到预后的相关性分析中,明确沙利度胺维持治疗可有效改善生存期。此外,还对早期死亡患者的影响因素加以分析。本研究数据分析较为完整,全面深入地对多发性骨髓瘤的预后因素进行了评估,具有指导治疗的价值。
IgD型9例(4.5%),κ轻链型13例(6.4%),λ轻链型19例(9.4%)。
1.3治疗方法均采用化疗,其中42例合并放疗。诱导化疗方案:44例接受靶向药物硼替佐米为主的PD化疗方案(具体方案:硼替佐米1.3 mg/m2,第1、4、8、11天;地塞米松20 mg/d,第1、2、4、5、8、9、11、12天);158例患者接受传统化疗方案,包括70例接受改良M2方案(具体方案:马法兰10 mg/d,第1~7天;洛莫司汀40 mg/d,第1天;长春地辛4 mg/d,第1天;环磷酰胺600 mg/d,第2、4天;泼尼松60 mg/d,第1~7天),48例接受VAD方案(具体方案:长春地辛1 mg/d,第1~4天;吡柔比星15 mg/d,第1~4天;地塞米松20 mg/d,第1~4、9~12、17~20天),40例接受MP方案(具体方案:马法兰10 mg/d,第1~7天;泼尼松60 mg/d,第1~7天)。患者接受化疗1~12个疗程。119例患者采用沙利度胺100~150 mg/d维持治疗,24例患者采用干扰素300万U,1次/d,维持治疗,14例患者采用雷利度胺15~20 mg/d维持治疗,45例患者未采用维持治疗。维持治疗直至患者疾病进展或复发。
1.4观察指标记录患者的性别、年龄、分型、有无重度贫血〔血红蛋白(Hb)<60 g/L〕、血β2微球蛋白水平、C反应蛋白水平、有无低蛋白血症、血钙水平、乳酸脱氢酶水平、骨髓浆细胞比例、骨病分级(MBD分级)[4]——根据全身骨骼X线片检查结果分级、美国东部肿瘤协作组体力状况评分(ECOG评分)[5]、有无复杂核型(G显带核型分析)、有无淀粉样变、有无肾损伤、有无截瘫及是否达到完全缓解(CR)、有无沙利度胺维持治疗(治疗≥6个月)等。疗效判断参照国际骨髓瘤工作组(IMWG)的统一标准[6],分为严格完全缓解(SCR)、CR、非常好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)、CR后复发。总有效率=(SCR+CR+VGPR+PR)/总例数×100%。
1.5随访所有患者随访至2015年3月,随访时间1.0~180.0个月,中位随访时间51.0个月。OS为患者确诊至死亡或最后随访时间。PFS为患者开始治疗至PD或死亡时间。早期死亡为患者确诊后6个月内死亡。
2结果
2.1疗效及患者生存情况202例患者中53例(26.2%)达到CR,96例(47.5%)达到VGPR,29例(14.4%)达到PR,总有效率为88.1%。截至随访时间死亡120例。1、3、5、10年生存率分别为80.7%、70.6%、36.1%、7.6%。OS为1.0~180.0个月,中位OS为51.0个月;PFS为1.0~91.0个月,中位PFS为38.0个月。
2.2预后分析
2.2.1OS的影响因素分析单因素分析结果显示,不同性别、是否轻链型、不同C反应蛋白水平、不同血钙水平、不同乳酸脱氢酶水平、不同MBD分级、不同ECOG评分患者OS比较,差异均无统计学意义(P>0.05)。不同年龄、有无重度贫血、不同血β2微球蛋白水平、有无低蛋白血症、不同骨髓浆细胞比例、有无复杂核型、有无淀粉样变、有无肾损伤、有无截瘫、是否达到CR、有无沙利度胺维持治疗患者OS比较,差异均有统计学意义(P<0.05,见表1)。
以单因素分析差异有统计学意义的变量为自变量,以OS为因变量,代入多因素Cox比例风险回归模型,结果显示,年龄、重度贫血、低蛋白血症、复杂核型、淀粉样变、截瘫、沙利度胺维持治疗与OS有回归关系(P<0.05,见表2)。
2.2.2PFS的影响因素分析单因素分析结果显示,不同性别、是否轻链型、不同血β2微球蛋白水平、不同C反应蛋白水平、不同血钙水平、不同乳酸脱氢酶水平、不同MBD分级、不同ECOG评分患者PFS比较,差异均无统计学意义(P>0.05)。不同年龄、有无重度贫血、有无低蛋白血症、不同骨髓浆细胞比例、有无复杂核型、有无淀粉样变、有无肾损伤、有无截瘫、是否达到CR、有无沙利度胺维持治疗患者PFS比较,差异均有统计学意义(P<0.05,见表3)。
以单因素分析差异有统计学意义的变量为自变量,以PFS为因变量,代入多因素Cox比例风险回归模型,结果显示,年龄、重度贫血、复杂核型、截瘫、沙利度胺维持治疗与PFS有回归关系(P<0.05,见表4)。
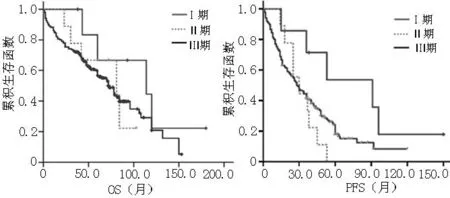
2.2.3临床分期与预后的相关性202例患者中DS分期Ⅰ期7例、Ⅱ期9例、Ⅲ期186例,中位OS分别为(114.0±54.0)月、(81.0±36.8)月、(72.0±5.2)月,3组间比较差异无统计学意义(χ2=1.710,P>0.05,见图1)。中位PFS分别为(91.0±30.5)月、(30.0±7.5)月、(28.0±3.2)月,3组间比较差异有统计学意义(χ2=12.222,P<0.05);其中Ⅰ期与Ⅱ期患者中位PFS比较,差异有统计学意义(P=0.012);Ⅰ期与Ⅲ期患者中位PFS比较,差异有统计学意义(P=0.036);Ⅱ期与Ⅲ期患者中位PFS比较,差异无统计学意义(P=0.417,见图1)。
202例患者中ISS分期Ⅰ期75例、Ⅱ期84例、Ⅲ期43例,中位OS分别为(106.0±14.0)月、(72.0±11.6)月、(49.0±7.0)月,3组间比较差异有统计学意义(χ2=15.037,P<0.05);其中Ⅰ期与Ⅱ期患者中位OS比较,差异有统计学意义(P=0.001);Ⅰ期与Ⅲ期患者中位OS比较,差异有统计学意义(P<0.001);Ⅱ期与Ⅲ期患者中位OS比较,差异无统计学意义(P=0.486,见图2)。中位PFS分别为(48.0±7.1)月、(26.0±2.9)月、(16.0±3.8)月,3组间比较差异有统计学意义(χ2=32.222,P<0.05);其中Ⅰ期与Ⅱ期患者中位PFS比较,差异有统计学意义(P<0.001);Ⅰ期与Ⅲ期患者中位PFS比较,差异有统计学意义(P<0.001);Ⅱ期与Ⅲ期患者中位PFS比较,差异无统计学意义(P=0.099,见图2)。
2.2.4早期死亡的影响因素分析19例患者早期死亡。单因素分析结果显示,有无重度贫血〔32%(8/25)与6.2%(11/177),χ2=0.512,P=0.039〕、有无淀粉样变〔66.7%(4/6)与7.7%(15/196),χ2=11.460,P=0.007〕患者早期死亡率比较,差异有统计学意义。以有无重度贫血(有=1,无=0)、有无淀粉样变(有=1,无=0)为自变量,以是否早期死亡(是=1,否=0)为因变量,代入多因素Logistic回归模型,结果显示,淀粉样变是早期死亡的独立影响因素〔β=2.178,SE=0.915,Wald χ2=5.669,P=0.017,OR=8.826,95%CI(1.470,53.002)〕。
2.2.5不同危险因素分层患者的预后根据OS和PFS的共同影响因素及ISS分期对患者进行危险因素分层:(1)ISS分期Ⅱ期及以上合并高龄(≥60岁)、重度贫血、复杂核型、截瘫等因素之一的患者为高危组;(2)ISS分期Ⅱ期及以上不合并上述因素的患者为中危组;(3)ISS分期Ⅰ期不合并上述因素的患者为低危组。202例患者中高危组76例(37.6%)、中危组80例(39.6%)、低危组46例(22.8%),中位OS分别为(44.0±4.1)月、(79.0±3.9)月、(114.0±12.8)月,3组间比较差异有统计学意义(χ2=25.360,P<0.001);其中中危组、低危组患者中位OS较高危组延长,差异有统计学意义(P<0.001);低危组患者中位OS较中危组延长,差异有统计学意义(P<0.001,见图3)。中位PFS分别为(15.0±1.2)月、(36.0±4.4)月、(58.0±14.5)月,3组间比较差异有统计学意义(χ2=33.933,P<0.001);其中中危组、低危组患者中位PFS较高危组延长,差异有统计学意义(P<0.001);低危组患者中位PFS较中危组延长,差异有统计学意义(P<0.001,见图3)。
±s,月)
注:Hb=血红蛋白,MBD分级=骨病分级,ECOG分级=美国东部肿瘤协作组体力状况评分,CR=完全缓解,OS=总生存期
表2MM患者OS影响因素的多因素Cox比例风险回归分析
Table 2Multivariate Cox proportional hazards regression analysis of influencing factors for OS MM patients
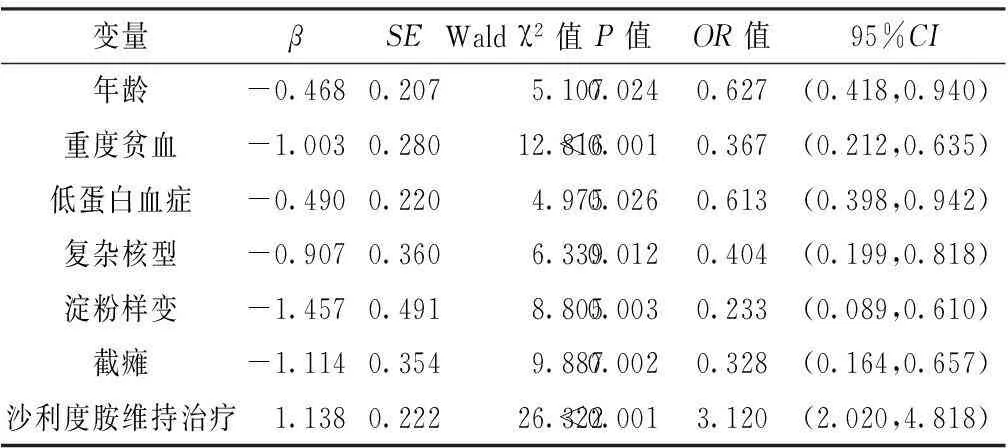
变量βSEWaldχ2值P值OR值95%CI年龄-0.4680.2075.1070.0240.627(0.418,0.940)重度贫血-1.0030.28012.816<0.0010.367(0.212,0.635)低蛋白血症-0.4900.2204.9750.0260.613(0.398,0.942)复杂核型-0.9070.3606.3390.0120.404(0.199,0.818)淀粉样变-1.4570.4918.8050.0030.233(0.089,0.610)截瘫-1.1140.3549.8870.0020.328(0.164,0.657)沙利度胺维持治疗1.1380.22226.322<0.0013.120(2.020,4.818)
表4MM患者PFS影响因素的多因素Cox比例风险回归分析
Table 4Multivariate Cox proportional hazards regression analysis of influencing factors for PFS MM patients
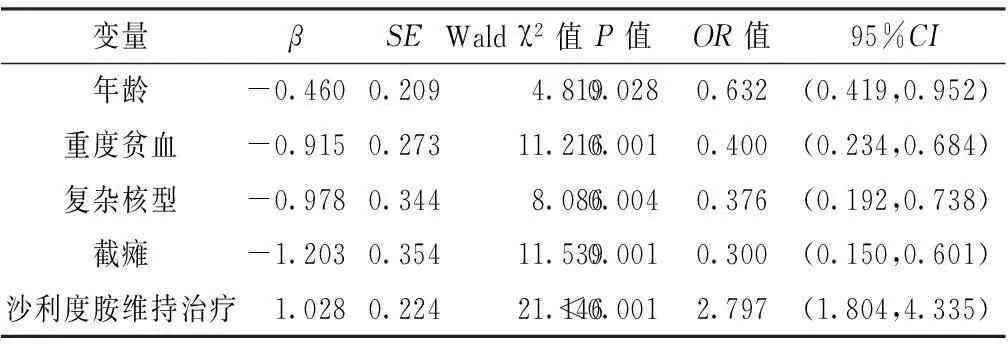
变量βSEWaldχ2值P值OR值95%CI年龄-0.4600.2094.8190.0280.632(0.419,0.952)重度贫血-0.9150.27311.2160.0010.400(0.234,0.684)复杂核型-0.9780.3448.0860.0040.376(0.192,0.738)截瘫-1.2030.35411.5390.0010.300(0.150,0.601)沙利度胺维持治疗1.0280.22421.146<0.0012.797(1.804,4.335)
注:OS=总生存期,PFS=无进展生存期
图1不同DS分期MM患者OS和PFS生存曲线
Figure 1Survival curves of OS and PFS of MM patients of different DS stages system
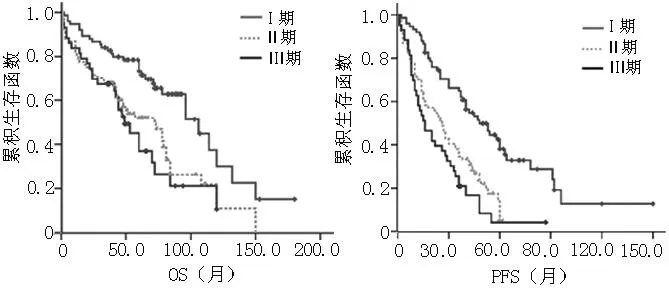
图2 不同ISS分期MM患者OS和PFS生存曲线
Figure 2Survival curves of OS and PFS of MM patients of different ISS stages system
本组患者自2008年开始使用以硼替佐米为主的PD化疗方案,将2008年以后的患者(104例)进行分析:高危组患者采用PD化疗方案19例、未采用PD化疗方案17例,中位PFS分别为(32.0±4.7)月、(18.0±2.1)月,差异有统计学意义(χ2=5.896,P=0.015);中危组患者采用PD化疗方案17例、未采用PD化疗方案19例,中位PFS分别为(33.0±10.3)月、(29.0±4.5)月,差异无统计学意义(χ2=0.965,P=0.323);低危组患者采用PD化疗方案8例、未采用PD化疗方案24例,中位PFS分别为(39.6±5.7)月、(41.1±3.6)月,差异无统计学意义(χ2=0.563,P=0.437)。
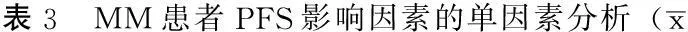
±s,月)
注:PFS=无进展生存期
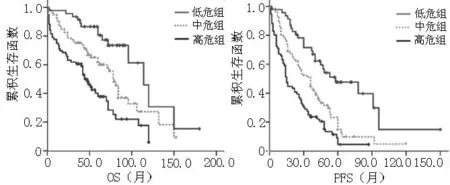
图3 不同危险因素分层MM患者OS和PFS生存曲线
Figure 3Survival curves of OS and PFS of MM patients with different risk gradings
3讨论
MM是增殖活性相对较低但不可治愈的浆细胞恶性肿瘤,患者的生存期差异很大,影响该病预后的因素很多,国内外报道不一致[7-8],目前还没有统一的标准的分层体系。而沙利度胺、雷利度胺、硼替佐米等新药的应用使一些常见的不良预后因素发生改变[9-10]。故在新的治疗环境下如何进行预后分层以指导治疗,是目前研究的方向。本研究从临床特点及实验室指标,包括肿瘤负荷、遗传学改变、疾病分期,并结合靶向新药应用来评估MM患者的预后。
本研究结果显示,202例MM患者中88.1%的患者化疗有效,其中26.2%达到CR。1、3、5、10年生存率分别为80.7%、70.6%、36.1%、7.6%,5年生存率与陶中飞等[8]的数据接近。单因素分析结果显示,在肿瘤负荷和患者自身相关因素方面,年龄、重度贫血、低蛋白血症、复杂核型、淀粉样变、截瘫与OS、PFS相关,其中年龄、重度贫血、复杂核型、截瘫为OS和PFS的共同独立影响因素,与国内外的报道相似[7-8],表明肿瘤负荷大小是决定生存期的重要因素。除常见的与肿瘤负荷相关的因素外,截瘫也是患者OS、PFS缩短的独立影响因素之一,本组14例患者因椎体破坏及椎旁肿物压迫脊髓导致截瘫,其中6例化疗后肌力未能恢复,中位OS仅(14.0±6.9)个月,可见截瘫后即使MM得到较好的控制,患者的生存质量仍不可避免地下降。肾损伤被认为是MM预后不良的独立预后因素[11],本组资料虽显示,肾损伤患者有更短的OS,但不是预后不良的独立影响因素,目前研究认为,这与硼替佐米及新一代的蛋白酶体抑制剂可克服肾损伤有关[12-13],故在蛋白酶体抑制剂的新治疗时代,肾损伤可能不再是独立预后因素。
近年来的研究发现,染色体异常在MM患者和骨髓瘤细胞株中有极高的发生率,且这些染色体的改变与MM的发病、分期、预后及耐药之间有着密切联系[14]。本研究结果显示,复杂核型是独立预后因素,本组患者共19例染色体为复杂核型,涉及多条染色体数目和结构的异常,其中8例患者涉及1号染色体异常,5例患者涉及17号染色体异常,OS明显低于其他患者。国外近年来通过荧光原位杂交技术(FISH)检测也显示不良核型,如涉及1号及17号等染色体异位及相关基因表达的患者预后差,对化疗不敏感,病情易进展[15]。为了进一步区别高危患者的预后和治疗,梅奥诊所(Mayo Clinic)依据细胞遗传学提出了骨髓瘤分层及根据危险程度的治疗策略,将患者进一步分为标危组和高危组,予以不同的治疗,于2014年再次更新[16]。故对高危遗传学的患者给予强化巩固化疗,如予硼替佐米及自体造血干细胞联合治疗以改善预后。
本研究对药物治疗对MM的预后影响进行了研究,通过长达15年的资料分析显示,靶向药物沙利度胺维持治疗患者的中位OS达(108.0±14.1)个月,中位PFS达(42.0±6.1)个月,OS及PFS均显著延长,影响MM患者预后。沙利度胺已被证实具有抗血管增生和免疫调节作用,不仅作用于骨髓瘤细胞,而且作用于骨髓造血微环境,已广泛应用于骨髓瘤的治疗[17]。MM患者化疗后予以沙利度胺维持治疗有助于控制PD,与干扰素维持治疗相比,患者使用更简单,易于被患者接受。此外,另一个重要的靶向药物硼替佐米提高疗效和CR率国内外均有报道[18-19],但其对长期生存影响的报道也相对较少。目前认为,硼替佐米的应用可克服一些细胞遗传学预后不良因素,延长生存期[20]。有研究认为,在加入硼替佐米的不同治疗体系下,预后分层可能会发生改变[21]。本研究对患者进行危险因素分层后显示,硼替佐米治疗可改善高危组的PFS,表明硼替佐米可克服预后不良的因素,延长PFS。本研究从疗效上分析显示,深度缓解有助于改善患者生存,达到CR的患者获得更长的OS和PFS,但达到CR并非独立预后因素,这可能表明,达到深度缓解后的长期维持治疗对预后更为重要。
本研究结果显示,ISS分期与预后关系更密切,与Ⅱ期、Ⅲ期患者相比,Ⅰ期患者具有更长的OS和PFS。而对于DS分期,Ⅰ期患者中位生存期虽长达(114.0±54.0)个月,但与Ⅱ期、Ⅲ期患者并无差异,仅在PFS上与Ⅱ期、Ⅲ期患者有差异。表明在新药治疗时代DS分期对于评估预后的价值已明显减小,但可用来评估肿瘤负荷,ISS分期对于评估预后更有意义。目前认为,ISS分期的β2微球蛋白水平与患者肾功能有关[22],肾损伤患者ISS分期晚,但由于蛋白酶体抑制剂在克服肾功能损害上具有优势,故在硼替佐米以及蛋白酶体抑制剂为主的治疗方案中,ISS分期的预后分层意义未来可能会减弱。
本研究结果显示,9.4%(19/202)患者早期死亡,略低于Beksac等[23]的报道。单因素分析显示,淀粉样变、重度贫血与早期死亡相关,多因素Logistic回归分析显示,只有淀粉样变是早期死亡的唯一独立危险因素。MM合并淀粉样变患者预后较差,尤其是淀粉样变心脏受累,治疗未缓解患者的中位OS仅为6个月[24]。有进展性肾脏疾病及心脏淀粉样变的患者,在血液学缓解后6个月器官病变才缓解[25]。有报道认为,血β2微球蛋白水平是预测早期死亡的独立危险因素[26],血β2微球蛋白水平越高,早期死亡的可能性越大。一些染色体或遗传学的异常,包括p53基因缺失等,也被认为是MM早期死亡的危险因素[27]。但在本研究中,并未得出这些结论,可能还要通过FISH检测进一步研究。
预后分层是为了使患者在规范化基础上进行个体化治疗,以提高整体疗效。随着自体造血干细胞移植、硼替佐米、沙利度胺等靶向药物的应用,患者生存期得到延长,从一定程度上可克服预后不良因素。这需要更多的数据去支持骨髓瘤的预后分层。
综上所述,本研究从临床特征和实验室检查中显示出,年龄、重度贫血、复杂核型、截瘫为OS和PFS的独立预后因素,达到深度缓解有助于改善预后,沙利度胺维持治疗可明显延长OS和PFS;分期上ISS分期较DS分期评估预后更准确;淀粉样变是早期死亡的独立危险因素;根据OS和PFS的共同影响因素及ISS分期对患者进行危险因素分层,以硼替佐米为主的PD化疗方案可延长高危组的PFS。但本研究样本例数较少,还需扩大样本量进一步证实。以细胞和分子遗传学为主的预后分层模式日益受到重视,本组资料仅有部分患者进行FISH检测,未来还需完善FISH检测后进一步总结并纳入到分层体系中。
作者贡献:陆敏秋进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;禇彬、左杏果、吴梦青、石磊、付丽娜、高珊、房立娟、项秋晴进行试验实施、评估、资料收集;白砚霞进行质量控制及审校。
本文无利益冲突。
参考文献
[1]陈世伦,武永吉.多发性骨髓瘤[M].2版.北京:人民卫生出版社,2010:1.
[2]Sonneveld P,Schmidt-Wolf IG,van der Holt B,et al.Bortezomib induction and maintenance treatment in patients with newly diagnosed multiple myeloma:results of the randomized phase Ⅲ HOVON-65/GMMG-HD4 trial[J].J Clin Oncol,2012,30(24):2946-2955.
[3]Rajkumar SV,Dimopoulos MA,Palumbo A,et al.International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma[J].Lancet Oncol,2014,15(12):e538-548.
[4]Smith DB,Scarffe JH,Eddleston B.The prognostic significance of X-ray changes at presentation and reassessment in patients with multiple myeloma[J].Hematol Oncol,1988,6(1):1-6.
[5]Oken M,Creech R,Tormey DC,et al.Toxicity and response criteria of the Eastern Cooperative Oncology Group[J].Am J Clin Oncol,1982,5(6):649-655.
[6]Durie BG,Harousseau JL,Miguel JS,et al.International uniform response criteria for multiple myeloma[J].Leukemia,2006,20(9):1467-1473.
[7]Hose D,Rème T,Hielscher T,et al.Proliferation is a central independent prognostic factor and target for personalized and risk-adapted treatment in multiple myeloma[J].Haematologica,2011,96(1):87-95.
[8]Tao ZF,Fu WJ,Chen YB,et al.Prognostic analysis and assessmenton the clinical staging systems——a report of 206 cases[J].Chinese Journal of Cancer,2006,25(4):461-464.(in Chinese)
陶中飞,傅卫军,陈玉宝,等.206例多发性骨髓瘤预后因素分析及分期评价[J].癌症,2006,25(4):461-464.
[9]Kumar S,Flinn I,Richardson PG,et al.Randomized,multicenter,phase 2 study(EVOLUTION) of combinations of bortezomib,dexamethasone,cyclophosphamide,and lenalidomide in previously untreated multiple myeloma[J].Blood,2012,119(19):4375-4382.
[10]Kouroukis TC,Baldassarre FG,Haynes AE,et al.Bortezomib in multiple myeloma:systematic review and clinical considerations[J].Curr Oncol,2014,21(4):e573-603.
[11]Kyler A,Gertzm A,Witzig TE.Review of 1027 patients with newly diagnosed multiple myeloma[J].Mayo Clin Proc,2003,78(1):21-23.
[12]Yang G,Chen W,Wu Y.Bortezomib,dexamethasone plus thalidomide for treatment of newly diagnosed multiple myeloma patients with or without renal impairment[J].Chin J Cancer Res,2013,25(2):155-160.
[13]Xu Y,An G,Deng SH,et al.Clinical feature and efficacy of patients with multiple myeloma and renal impairment treated with bortezomib based chemotherapy[J].Chinese Journal of Hematology,2013,34(4):304-308.(in Chinese)
徐燕,安刚,邓书会,等.以硼替佐米为基础方案治疗56例伴肾功能损害的多发性骨髓瘤患者疗效分析[J].中华血液学杂志,2013,34(4):304-308.
[14]Biran N,Jagannath S,Chari A.Risk stratification in multiple myeloma,part 2:the significance of genetic risk factors in the era of currently available therapies[J].Clin Adv Hematol Oncol,2013,11(9):578-583.
[15]Biran N,Malhotra J,Bagiella E,et al.Patients with newly diagnosed multiple myeloma and chromosome 1 amplification have poor outcomes despite the use of novel triplet regimens[J].Am J Hematol,2014,89(6):616-620.
[16]Vincent Rajkumar S.Multiple myeloma:2014 update on diagnosis,risk‐stratification,and management[J].Am J Hematol,2014,89(10):999-1009.
[17]De Keersmaecker B,Fostier K,Corthals J,et al.Immunomodulatory drugs improve the immune environment for dendritic cell-based immunotherapy in multiple myeloma patients after autologous stem cell transplantation[J].Cancer Immunol Immunother,2014,63(10):1023-1036.
[18]Li J,Zeng LJ,Zhao Y,et al.Combination of bortezomib and dexamethasone for newly diagnosed multiple myeloma[J].Chinese Journal of Hematology,2009,8(8):543-547.(in Chinese)
李娟,曾丽金,赵莹,等.硼替佐米联合地塞米松治疗初治多发性骨髓瘤[J].中华血液学杂志,2009,8(8):543-547.
[19]Ludwig H,Viterbo L,Greil R,et al.Randomized phase Ⅱ study of bortezomib,thalidomide,and dexamethasone with or without cyclophosphamide as induction therapy in previously untreated multiple myeloma[J].J Clin Oncol,2013,31(2):247-255.
[20]Usmani SZ,Crowley J,Hoering A,et al.Improvement in long-term outcomes with successive total therapy trials for multiple myeloma:are patients now being cured?[J].Leukemia,2013,27(1):226-232.
[21]Avet-Loiseau H,Durie BG,Cavo M,et al.Combining fluorescent in situ hybridization data with ISS staging improves risk assessment in myeloma:an International Myeloma Working Group collaborative project[J].Leukemia,2013,27(3):711-717.
[22]Park S,Han B,Kim K,et al.Renal Insufficiency in newly-diagnosed multiple myeloma:analysis according to International Myeloma Working Group consensus statement[J].Anticancer Res,2014,34(8):4299-4306.
[23]Beksac M,Haznedar R,Firatli-Tuglular T,et al.Addition of thalidomide to oral melphalan/prednisone in patients with multiple myeloma not eligible for transplantation:results of a randomized trial from the Turkish Myeloma Study Group[J].Eur J Haematol,2011,86(1):16-22.
[24]Ohashi T,Kikuchi N,Yamamoto T.Unusual milia amyloidosis as initial signs of multiple myeloma associated systemic amyloidosis[J].Int J Dermatol,2013,52(8):981-982.
[25]Sanchorawala V,Seldin DC,Magnani B,et al.Serum free light-chain responses after high-dose intravenous melphalan autologous stem cell transplantation for AL(primary) amyloidosis[J].Bone Marrow Transplant,2005,36(7):597-600.
[26]Li J,Xu Y,Shen T,et al.Predicting factors for early death in multiple myeloma patients[J].Beijing Medical Journal,2006,28(3):132-134.(in Chinese)
李剑,许莹,沈悌,等.多发性骨髓瘤早期死亡的临床危险因素分析[J].北京医学,2006,28(3):132-134.
[27]Li JT,Zhao YQ,Chang NB,et al.Investigation of correlation between chromosome 13,p53 gene deletion and clinical profile in patients with multiple myeloma[J].Journal of Leukemia & Lymphoma,2009,18(9):548-550.(in Chinese)
李江涛,赵永强,常乃柏,等.13号染色体、p53基因缺失与多发性骨髓瘤的相关性研究[J].白血病·淋巴瘤,2009,18(9):548-550.
(本文编辑:陈素芳)
【关键词】多发性骨髓瘤;预后;影响因素分析
陆敏秋,褚彬,白砚霞,等.多发性骨髓瘤预后的影响因素研究[J].中国全科医学,2016,19(6):658-665.[www.chinagp.net]
Lu MQ,Chu B,Bai YX,et al.Influencing factors for the prognosis of multiple myeloma[J].Chinese General Practice,2016,19(6):658-665.
Influencing Factors for the Prognosis of Multiple MyelomaLUMin-qiu,CHUBin,BAIYan-xia,etal.DepartmentofHematology,BeijingJishuitanHospital,theFourthMedicalCollegeofPekingUniversity,Beijing100035,China
【Abstract】ObjectiveTo investigate the significance of clinical features,laboratory indexes and treatment regimen on the prognosis of multiple myeloma(MM).MethodsEnrolled 202 patients who were newly diagnosed with MM and had complete follow-up data in the Department of Hematology of Beijing Jishuitan Hospital From January 2000 to March 2012.All the patients underwent chemotherapy.Among them,42 patients underwent chemoradiotherapy.The observed indexes included gender,age,typing,having severe anemia or not,blood level of β2-microglobulin,C-reactive protein level,having hypoalbuminemia or not,blood calcium level,lactic dehydrogenase level,proportion of bone marrow plasma cells,bone disease grading(MBD grading),ECOG score,complex karyotype(G banding karyotype analysis),amyloidosis,renal injury,paraplegia,whether treatment achieved complete remission(CR) and whether thalidomide maintenance therapy was conducted or not(treatment duration≥6 months).Follow-up ended in March 2015,lasting for 1.0-180.0 months.Multivariate Cox proportionnal hazards regression analysis and survival curves analysis were conducted on the correlation of DS staging,ISS staging and other factors with the overall survival(OS) and progression free survival(PFS)of MM patients.A total of 19 patients died 6 months after diagnosis,and multivariate Logistic regression analysis was employed to investigate influencing factors for early death.According to common influencing factors for OS and PFS and ISS staging,the patients were divided into three groups:high risk group,average risk group and low risk group.The prognosis of the three groups was analyzed.ResultsAmong 202 MM patients,53(26.2%)patients had CR;96(47.5%)had very good partial response(VGPR);29 (14.4%) patients had partial remission(PR);the overall effective rate was 88.1%.By the end of follow-up,120 patients died.One-year,three-year,five-year and ten-year survival rates were 80.7%,70.6%,36.1% and 7.6% respectively.OS was 1.0-180.0 months,and median OS was 51.0 months;PFS was 1.0-91.0 months,and median PFS was 38.0 months.Multivariate Cox proportional hazards regression analysis showed that age,severe anemia,hypoalbuminemia,complex karyotype,amyloidosis,paraplegia and thalidomide maintenance treatment had regression relation with OS (P<0.05);age,severe anemia,complex karyotype,paraplegia and thalidomide maintenance treatment had regression relation with PFS (P<0.05).Patients with different DS stages were not significantly different in OS (χ2=1.710,P>0.05).Patients with different DS stages were significantly different in PFS (χ2=12.222,P<0.05).Patients with different ISS stages were significantly different in OS and PFS (χ2values were 15.037 and 32.222,P<0.05).Univariate analysis showed that patients with severe anemia 〔32%(8/25) vs.6.2%(11/177),χ2=0.512,P=0.039〕 and amyloidosis 〔66.7%(4/6) vs.7.7%(15/196),χ2=11.460,P=0.007〕 were significantly different from patients without them.Multivariate Logistic regression analysis showed that amyloidosis was an independent influencing factor for early death 〔β=2.178,SE=0.915,Wald χ2=5.669,P=0.017,OR=8.826,95%CI(1.470,53.002)〕.Patients with different risk gradings were significantly different in OS and PFS (P<0.001).ConclusionInfluencing factors for the prognosis of MM patients are complex and diverse,including advanced age,combined severe anemia,hypoproteinemia,complex karyotype,amyloidosis and paraplegia.Patients receiving thalidomide maintenance treatment have longer survival time.ISS staging has greater significance than DS staging in the prognosis.Patients combined with amyloidosis have higher risk for early death.Risk grading by common influencing factors for OS and PFS and ISS staging are of significance in the prognosis of patients.
【Key words】Multiple myeloma;Prognosis;Influence factor analysis
(收稿日期:2015-09-06;修回日期:2015-12-20)
【中图分类号】R 733.3
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.06.008
通信作者:白砚霞,100035 北京市,北京积水潭医院血液科北京大学第四临床医学院;E-mail:bzz0205@sina.com
基金项目:北京市医院管理局临床医学发展专项经费资助(XMLX201502)
作者单位:100035 北京市,北京积水潭医院血液科北京大学第四临床医学院

