亚砷酸钠对皮肤细胞角化相关基因表达的影响
李 煜, 吴 军, 郑玉建, 陈柔锦, 刘 媛, 葛 龙, 郎 曼
(新疆医科大学公共卫生学院劳动卫生与环境卫生教研室, 乌鲁木齐 830011)
亚砷酸钠对皮肤细胞角化相关基因表达的影响
李煜, 吴军, 郑玉建, 陈柔锦, 刘媛, 葛龙, 郎曼
(新疆医科大学公共卫生学院劳动卫生与环境卫生教研室, 乌鲁木齐830011)
摘要:目的探讨亚砷酸钠对人角质形成细胞角化相关因子mRNA表达的影响,为进一步阐述砷致皮肤角化机制的研究提供依据。方法用浓度为0.00(对照)、1.30、3.25、6.50 μmol/L的亚砷酸钠培养基培养HaCaT细胞24、48、72、96 h;采用MTT还原法检测细胞生长情况;采用实时荧光定量PCR法检测HaCaT细胞角蛋白1(Keratin1,K-1)、角蛋白10 (Keratinl0,K-10)的mRNA的表达水平。结果(1)1.30 μmol/L的亚砷酸钠染毒能显著促进HaCaT细胞增殖,3.25 μmol/L、6.50 μmol/L的亚砷酸钠染毒48 h开始抑制HaCaT细胞的增殖,且与对照组相比差异均有统计学意义(P<0.05)。(2)1.30 μmol/L的亚砷酸钠染毒HaCaT细胞24 h能促进K1和K10 mRNA的表达上调,3.25 μmol/L、6.50 μmol/L的亚砷酸钠染毒72 h可使HaCaT细胞中K1、K10 mRNA的表达显著下调,且与对照组相比差异均有统计学意义(P<0.05)。结论亚砷酸钠浓度<1.30 μmol/L时,对人皮肤细胞的促增殖作用明显,促进皮肤角化进程;K1、K10的上调在皮肤细胞增殖和角化的过程中发挥一定作用。
关键词:亚砷酸钠; HaCaT细胞; 角蛋白1; 角蛋白10
地方性砷中毒(简称地砷病)是一种严重危害人类健康的地方病,主要临床表现为皮肤病变。研究发现砷中毒初始期和早期只出现表皮角化而未有色素异常[1]。在表皮细胞分化过程中产生的角蛋白是角质形成细胞的重要组成部分[2],角蛋白的异常可能会导致一系列以角质形成细胞病变为主的皮肤病。占正常皮肤表皮绝大部分的棘层主要表达角蛋白1(K1)和角蛋白10(K10)。K1和K10常被作为表皮正常分化的标志物[3]。作为上皮分化标志的角蛋白,其表达与上皮角质形成细胞的生长分化密切相关。在疾病情况下,角蛋白异常表达会引起细胞增殖和分化的失调[4]。目前角蛋白的表达与皮肤细胞增殖和皮肤角化的联系尚不清楚,需进一步探讨研究。本研究以亚砷酸钠(NaAsO2)作为处理因素,人皮肤角质形成细胞(HaCaT)为研究对象,模拟砷暴露后皮肤细胞形态、增殖的变化,并检测亚砷酸钠处理后HaCaT细胞相关角化基因mRNA的表达,为探讨砷致皮肤角化过度的作用机制奠定基础。
1材料与方法
1.1主要试剂与仪器(NaAsO2)分析纯(北京化学试剂三厂),胎牛血清、DMEM培养基、0.25%胰蛋白酶、青链霉素混合液(美国GIBCO公司),PBS缓冲液 (美国HyClone 公司),75%乙醇、无水乙醇,四噻唑蓝(MTT)粉剂、二甲基亚砜(DMSO)(德国Sigma公司),逆转录试剂盒(美国TAKARA公司),Power SYBR Green PCR Master Mix(美国Applied Biosystems Life技术有限公司),371型CO2细胞培养箱(Thermo Scientific),全自动酶标仪(MC318,上海三科仪器有限公司),CFX 96型实时荧光定量PCR仪(美国Bio-RAD公司)。
1.2细胞培养与染毒生化角质形成细胞株(HaCaT)购买于上海博谷生物科技有限公司。细胞株常规培养于DMEM高糖培养基(含10%胎牛血清、100 U/mL青霉素、100μg/mL 链霉素),在5% CO2、37℃条件下培养;当细胞进入对数生长期、融合率>80%时,以0.25%胰蛋白酶消化传代(1∶2 传代)。亚砷酸钠染毒HaCaT细胞24 h的LC50为65.00 μmol/L。实验分为对照组及染毒组。各组染毒浓度分别为LC50的1/50、1/20、1/10,即1.30、3.25、6.50 μmol/L,对照组为0.00 μmol/L。
1.3细胞增殖活性的测定MTT比色法检测细胞活性。细胞消化后,接种于2×104个/孔的密度96孔板中,每孔100 μL,48 h 后加入含0(对照)、1.30、3.25、6.50 μmol/L 亚砷酸钠的DMEM高糖培养基,分别作用24、48、72 h。待细胞培养至染毒终点时,每孔加入含0.5 mg/mL 的MTT 溶液10 μL;于37℃、5% CO2培养箱中继续孵育4 h 后,吸弃培养基,加入150 μL 的二甲基亚砜(DMSO)作用10 min后,用酶联免疫检测仪(酶标仪)在490 nm波长处测定其光吸收值(OD490值),OD值可间接反映活细胞数量,OD值越大活细胞数量越多。单一实验重复3次,取均值进行统计学处理。细胞增殖抑制率(%)=1-不同浓度染毒组OD490值/对照组OD490值×100%
1.4角化相关基因mRNA表达的检测
1.4.1总RNA的提取及检测用RNA提取试剂盒提取细胞总RNA。使用核酸蛋白检测仪测定总RNA的浓度(ng/μL)和纯度(A280/A260),选择A280/A260比值为1.8~2.0的RNA样品进行后续实验。
1.4.2反转录按照反转录试剂盒说明书进行操作,将RNA反转录为cDNA。反转录条件:42℃ 60 min,70℃ 5 min。反转录产物于-80℃保存备用。
1.4.3实时荧光定量PCR应用引物有K1、K10,PCR引物序列采用Primer Premier 6.0设计,由上海生工生物技术有限公司合成。实时荧光定量PCR根据Power SYBR Green PCR Master Mix试剂盒说明,在CFX96型序列检测仪上进行实时荧光定量PCR分析。扩增条件为:95℃预变性10 min;95℃变性15 s,60℃退火1 min,40个循环。扩增完毕后进行溶解曲线分析,每个标本样品重复3次。并以β-actin基因做为内参基因,运用2-ΔΔCt法分析各基因的mRNA相对表达量,其中,ΔΔCt=[(Ct暴露组目的基因-Ct暴露组内参基因)-(Ct对照组目的基因-Ct对照组内参基因)]。

2结果
2.1HaCaT细胞形态变化HaCaT细胞培养24 h后,对照组(0.00 μmol/L)细胞生长良好,细胞多呈扁平状梭形,细胞边界清晰,融合率达70%左右,生长状态佳;1.30 μmol/L亚砷酸钠染毒48 h后,细胞生长密集,几乎不见细胞空隙状态较好;3.25 μmol/L亚砷酸钠染毒48 h后,细胞无明显增殖,有少量收缩细胞,但染毒72 h后细胞明显收缩变圆变小,边界模糊,细胞膜破裂,细胞质流出,细胞边缘参差不齐;6.50 μmol/L亚砷酸钠染毒48 h后,细胞间隙变大,细胞边缘开始模糊,染毒至72 h,细胞明显不贴壁,大量脱落(图1)。
2.2HaCaT细胞活性变化染毒组与对照组细胞增殖率相比差异有统计学意义(F=90.60,P<0.05);相同染毒浓度不同时间点之间细胞增殖率差异有统计学意义(F=20.96,P<0.05);时间和浓度的交互作用有统计学意义(F=15.74,P<0.05)。染毒24 h时各浓度组OD值均大于对照组,提示细胞增殖率均增高;1.30 μmol/L染毒组随染毒时间的延长细胞增殖率上升;3.25 μmol/L 染毒组随染毒时间的延长细胞增殖率上升但在72 h时开始下降;6.50 μmol/L染毒组随时间延长,细胞增殖率明显下降,见表1和图2。

24 h 0.00 μmol/L染毒组
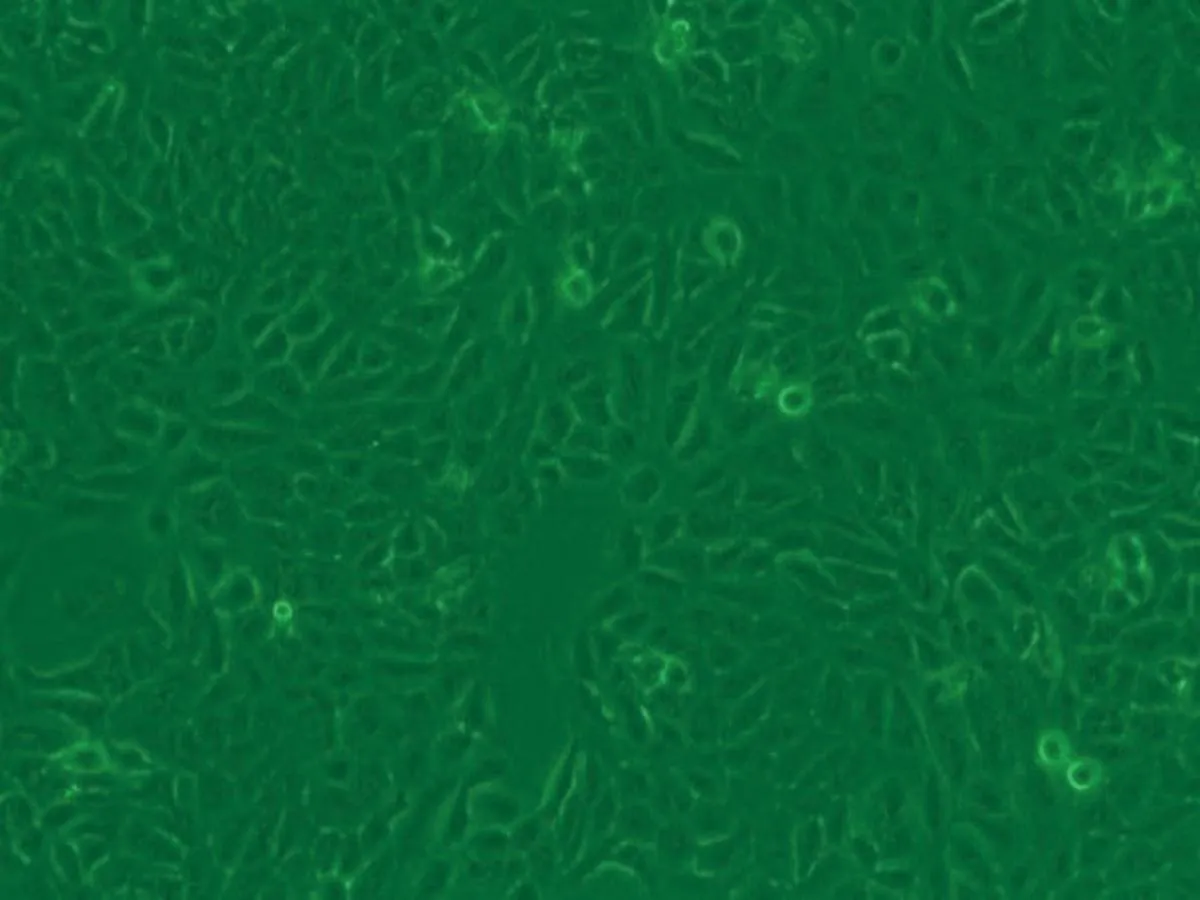
24 h 1.30 μmol/L染毒组

24 h 3.25 μmol/L染毒组

24 h 6.5 μmol/L染毒组
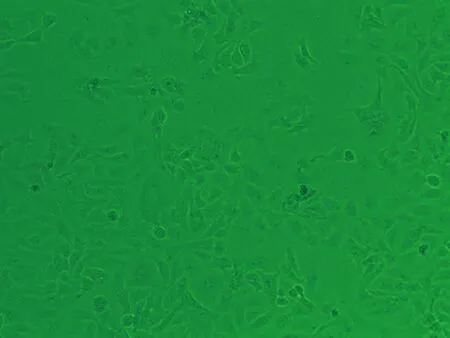
48 h 0.00 μmol/L染毒组
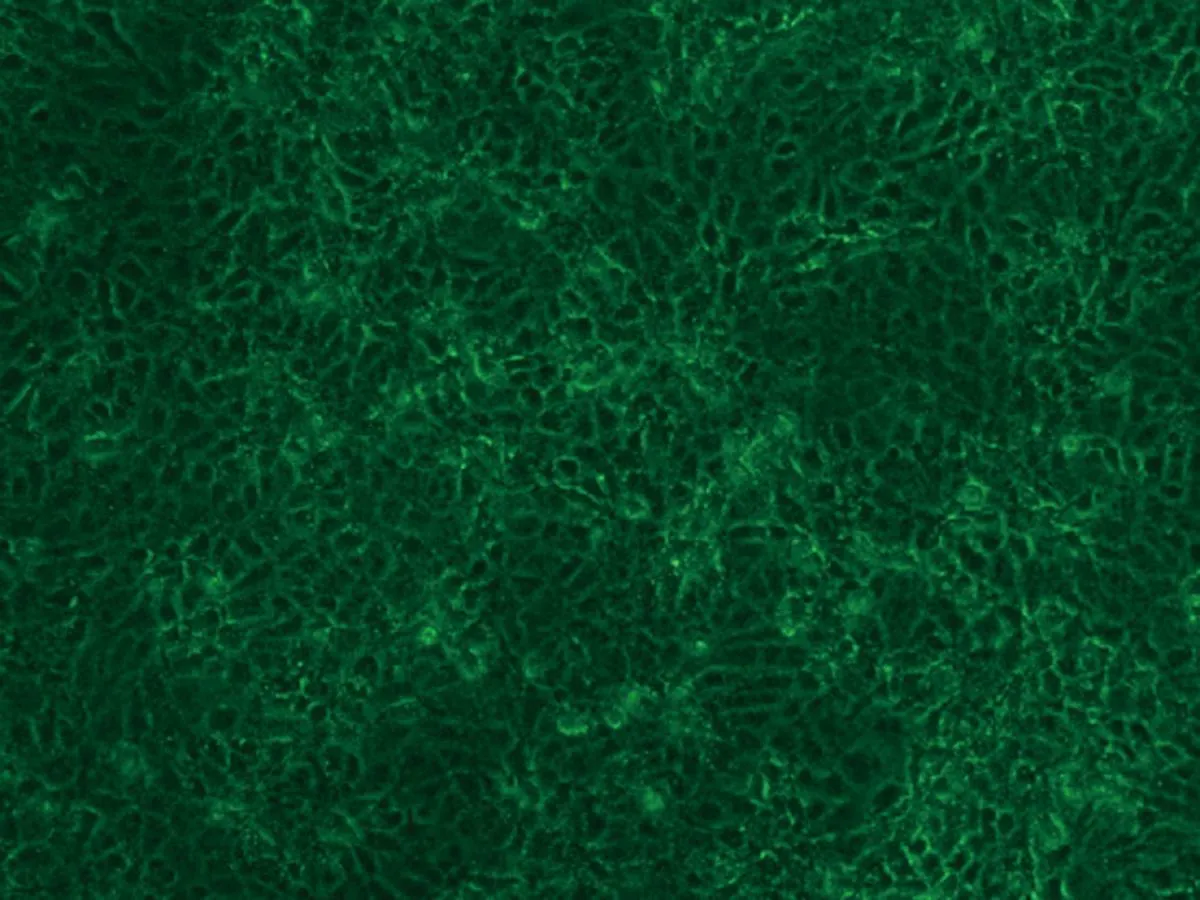
48 h 1.30 μmol/L染毒组
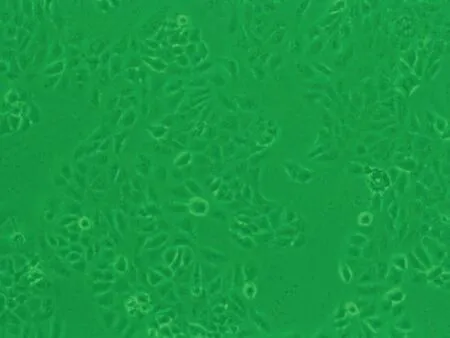
48 h 3.25 μmol/L染毒组
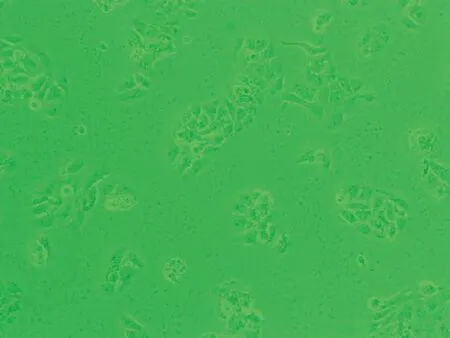
48 h 6.50 μmol/L染毒组

72 h 0.00 μmol/L染毒组

72 h 1.30 μmol/L染毒组

72 h 3.25 μmol/L染毒组
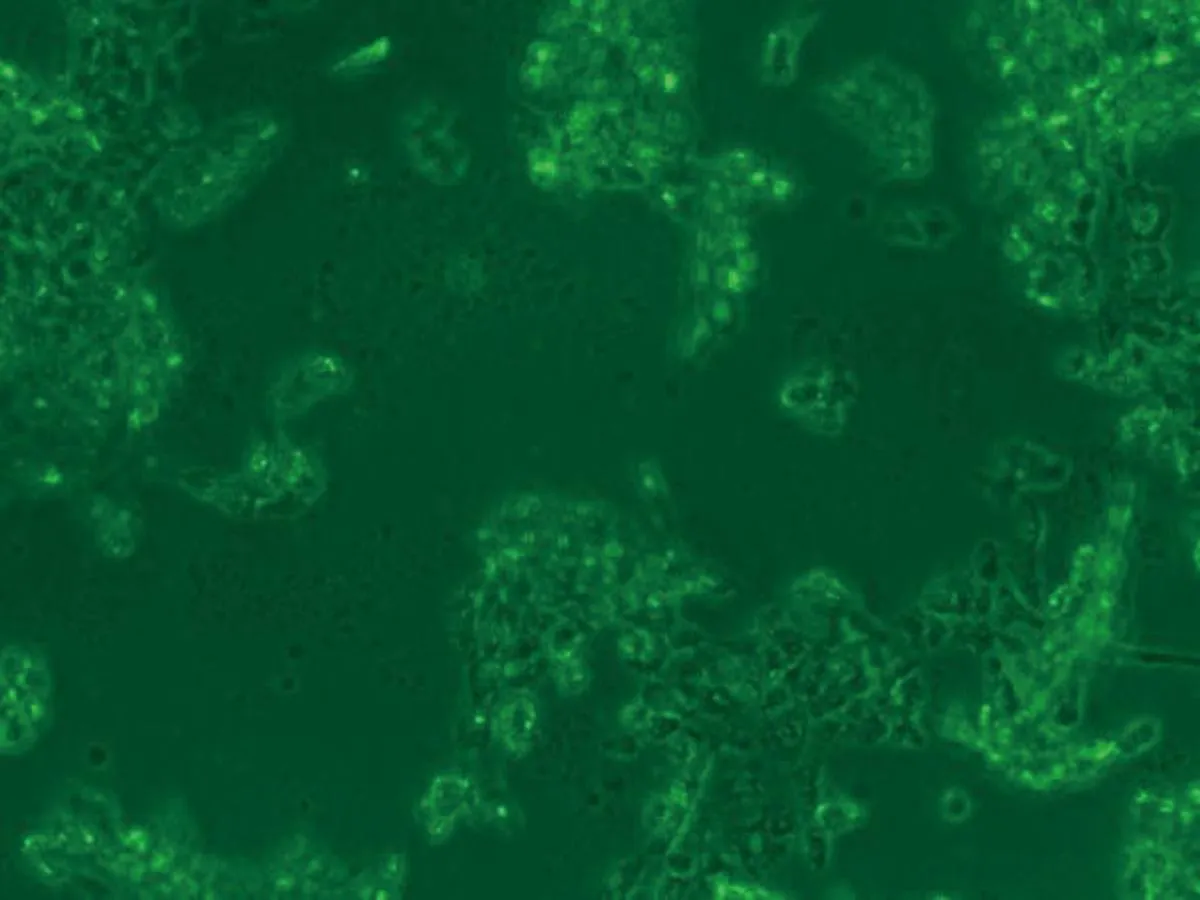
72 h 6.50 μmol/L染毒组

图1 亚砷酸钠染毒HaCaT细胞不同时间后细胞形态学变化图(×10)倍
注:同一时间点与对照组比较,*P<0.05; 同组各时间点与24 h比较,aP<0.05。
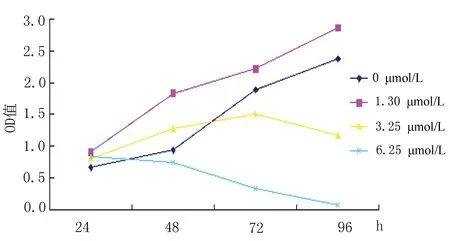
图2 亚砷酸钠不同时间不同浓度染毒HaCaT细胞趋势图
2.3HaCaT细胞K1 mRNA和K10 mRNA表达变化相同染毒浓度不同时间点HaCaT细胞中K1 mRNA表达差异有统计学意义(F=23.62,P<0.05);时间和浓度的交互作用差异有统计学意义(F=12.85,P<0.05)。染毒后细胞K1 mRNA表达总体呈上升趋势。1.30 μmol/L染毒组K1 mRNA表达与对照组相比差异有统计学意义(P<0.05);3.25 μmol/L染毒组的K1 mRNA表达水平呈先上升后下降的趋势并在48 h时表达最高,与对照组相比差异有统计学意(P<0.05);6.50 μmol/L染毒组的K1 mRNA表达水平随着时间的增加而降低,与对照组相比差异有统计学意义(P<0.05)。
相同染毒浓度不同时间点之间细胞中K10 mRNA表达差异有统计学意义(F=40.41,P<0.05);时间和浓度的交互作用有统计学意义(F=6.85,P<0.05)。1.30 μmol/L染毒组HaCaT细胞K10 mRNA表达水平均呈上升趋势与对照组相比差异有统计学意义(P<0.05);3.25 μmol/L染毒组与6.50 μmol/L染毒组在72 h时K10 mRNA表达水平开始下降,各组K10 mRNA表达水平与对照组相比差异均有统计学意义(P<0.05),见表2。

表2 亚砷酸钠染毒对HaCaT细胞中K1mRNA和K10 mRNA表达水平的影响(n=4, ±s)
注:同一时间点与对照组比较,*P<0.05;同组各时间点与24 h比较,aP<0.05。
3讨论
HaCaT来源于正常成人皮肤角质形成细胞,与正常皮肤细胞有许多相似特性,目前已被广泛用于砷化物对皮肤的毒性效应研究[5]。本研究结果显示在低浓度时即1.30 μmol/L组可明显促进细胞增殖;随染砷浓度升高至3.25 μmol/L和6.50 μmol/L时,随染毒时间的延长,细胞增殖率逐渐降低。即不同浓度的亚砷酸钠对HaCaT细胞的增殖率具有双向调节作用,这与一些研究结果相一致:如许熙国[6]研究发现≤2.5 μmol/L亚砷酸钠染毒HaCaT细胞能使增殖率增加,其中染毒浓度为0.15 μmol/L时的增殖率增加最明显;>2.5 μmol/L亚砷酸钠染毒组HaCaT细胞增殖明显抑制;吴顺华[7]等发现亚砷酸钠浓度为1.6 μmol/L时,对人表皮细胞的促增殖作用明显,此后随浓度增加促增殖作用呈递减趋势,浓度高于3.2 μmol/L时表现为生长抑制作用。有研究证实砷的这种促增殖作用与细胞生长因子有关[8]。但胡新欣[9]等研究发现亚砷酸钠浓度在0.001~10.000 μmol/L时可明显增强HaCaT细胞增殖力。这与本研究结论稍有出入,可能与亚砷酸钠作用时间不同有关。
角蛋白是表皮的主要结构蛋白并显示非常具体的上皮细胞类型和分化阶段,对于维护上皮细胞的形态完整性及功能稳定性发挥着重要作用[10]。在本研究中K1与K10的表达与对照组相比升高,这与多数研究结果一致:如Sun等[11]观察到0.10 μmol/L NaAsO2处理20周的HaCaT细胞中K10与K1表达上调:韩冰等[12]和谢汝佳等[13]研究发现,燃煤污染型砷中毒患者血清角蛋白1和角蛋白10表达水平较对照组显著上调。另外,K1是K10的合作伙伴,其参与到皮肤角化的过程中,是中间丝形成的重要成分,因此被认为是皮肤正常开始角化的标志。在本研究中K1与K10的表达上调并呈正相关(P<0.05),这与二者特异性协同表达是一致的,表明K1与K10在砷致细胞角化中有同时异常表达,也提示K1与K10的表达升高可能与HaCaT细胞过度增殖有一定关联。
目前一些研究认为角质形成细胞分化的改变继发于表皮的过度增殖。角蛋白随上皮终末分化的过程而改变,其过表达已被证实是角质细胞过度增殖和过度角化的标志。有研究发现K1的过表达是角质细胞过度增殖的标志,K10的过表达往往表明有上皮的过度分化和角化[14-15]。本研究显示,K1、K10角蛋白表达升高,HaCaT细胞分化异常,同时HaCaT细胞增殖率也升高,提示HaCaT细胞的过度增殖、细胞分化改变和角蛋白表达上调这三者之间可能有联系。随染毒浓度的上升和染毒时间达到72 h,细胞增殖率下降,K1、K10的表达下降,说明一定浓度范围内的亚砷酸钠可以刺激细胞生长,促进皮肤细胞增殖,但超过一定剂量就会抑制细胞增殖。综上所述,由于目前角蛋白在染砷后角质形成细胞中表达情况的相关性研究还比较少,本研究只是作了初步探讨,其具体作用还需要通过更系统更深入的研究来证明,期待以后角蛋白在皮肤角化中的作用研究有更大进展。
参考文献:
[1]马恒之, 王风歧, 郭小娟,等. 内蒙古自治区地方性砷中毒临床调查[J].内蒙古地方病防治研究, 1994, 19(增刊):82-85.
[2]Ramms L, Fabris G, Windoffer R,et al.Keratins as the main component for the mechanical integrity of keratinocytes[J]. Proc Natl Acad Sci USA, 2013,110(46):18513-18518.
[3]Bragulla HH,Homberger DG.Structure and functions of keratin pmteinsin simple,stratified,keratinized and cornified epithelia[J].J Anat,2009,214(4):516-559.
[4]郝小军, 高顺强, 李真,等. 角蛋白17、 19在银屑病皮损中的表达及意义[J]. 中国医师进修杂志, 2011, 34(36):20-22.
[5]Pachauri V, Srivastava P, Yadav A, et al. MiADMSA protects arsenic-induced oxidative stress in human keratinocyte HaCaT cells[J]. Biol Trace Elem Res, 2013, 153(1-3):396-402.
[6]许熙国. 氧化应激在亚砷酸钠诱导人永生化角质形成细胞(HaCaT)适应性反应中的意义[D]. 苏州大学, 2014.
[7]吴顺华, 刘开泰, 杨晓燕, 等. 亚砷酸钠对人皮肤细胞增殖作用的影响[J]. 新疆医科大学学报, 2003, 26(1):6-8.
[8]孙鲜策, 孙贵范, 王路, 等. 亚砷酸钠对角质形成细胞增殖力和周期的影响[J]. 中华劳动卫生职业病杂志, 2004, 22(3):219-220.
[9]胡新欣, 高彦辉, 张微, 等. 亚砷酸钠对人皮肤永生化角质形成细胞角化相关基因和核转录因子红系相关因子2mRNA表达的影响[J]. 中国地方病学杂志, 2012,31(4):365-368.
[10]Farooq SH, Chandrasekharam D, Norra S, et al. Temporal variations in arsenic concentration in the groundwater of Murshidabad District, West Bengal, India?[J]. Environmental Earth Sciences, 2011,62(2):223-232.
[11]Sun Y, Pi J, Wang X, et al. Aberrant cytokeratin expression during arsenic-induc-ed acquired malignant phenotype in human HaCaT keratinocytes consistent with epidermal carcinogenesis?[J]. Toxicology, 2009,262(2):162-170.
[12]韩冰, 杨勤, 罗新华, 等. 燃煤污染型砷中毒患者血清差异蛋白的筛选[J]. 中华医学杂志, 2009,89(21):1450-1454.
[13]谢汝佳, 韩冰, 罗新华, 等. 燃煤污染型砷中毒肝损伤患者血清差异蛋白的筛选[J]. 中国地方病学杂志, 2010,29(6):604-607.
[14]胡新欣.角蛋白1转运髓过氧化物酶在砷致皮肤损伤中的作用[D]. 哈尔滨:哈尔滨医科大学,2012.
[15]Bloor BK, Seddon SU. Morgan PR. Gene expression of differentiation-specific keratins (k4、K13、K1 and K10) in oral nondysplastic keuratoses and lichen planus[J]. Oral Pathol Med,2000, 29(8):376-384.
(本文编辑张巧莲)
Effects of sodium arsenite on skinkeratinocytes related gene expression
LI Yu, WU Jun, CHEN Roujin, LIU Yuan, GE Long, LONG Man
(DepartmentofEnvironmentalHealth,CollegeofPublicHedlth,XinjiangMedicineUniversity,
Urumqi830011,China)
Abstract:ObjectiveTo investigate the effects of sodium arsenite on skin cell keratinocytes related gene expression and provide the basis for further elaboration for arsenic-caused skin keratinization mechanism. MethodsThe HaCaT cells were exposed to 0.00, 1.30, 3.25, 6.25 μmol/L sodium arsenite for 24 h, 48 h, 72 h, respectively. Then, cells growth status were measured with MTT colorimetric assay. Expression levels of K1 and K10 mRNA are detected from HaCaT cells by real-time fluorescence quantitative (Real-Time Quantitative PCR). Results(1) 1.30 μmol/L sodium arsenite can promote HaCaT cell proliferation. 3.25 μmol/L, 6.50 μmol/L sodium arsenite inhibited the growth of HaCaT cells after 48 h, and the difference was statistically significant (P<0.05) compared with the control group. (2) In 1.30 μmol/L sodium arsenite exposure group, HaCaT cells promoted K1 and K10 mRNA upregulation of expression after 24 h. 3.25 μmol/L, 6.50 μmol/L exposure of sodium arsenite in HaCaT cells, K1, K10 mRNA expression downregulated after 72h and the difference was statistically significant (P<0.05). ConclusionConcentration of sodium arsenite <1.30 μmol/L on human skin cells promoted proliferation significantly and promoted skin keratinization process. The upregulation of K1, K10 in skin cell proliferation and cornification process played a role.
Keywords:sodium arsenite; HaCaT cells; K1; K10
[收稿日期:2015-10-30]
doi:10.3969/j.issn.1009-5551.2016.02.009
中图分类号:R34
文献标识码:A
文章编号:1009-5551(2016)02-0164-05
作者简介:李煜(1989-),女,在读硕士,研究方向:砷中毒与皮肤损伤。通信作者:吴军,男,教授,硕士生导师,研究方向:砷中毒与皮肤损伤,E-mail: wuj1997@sohu.com。
基金项目:国家自然科学基金(81560513); 国家自然科学基金(81260410); 教育部高等学校博士学科点基金(20126517110002; 20126517120003)

