磁共振波谱分析应用于脑胶质瘤分级的研究
滕宏伟 薛新潮(通讯作者) 周 静 仇劲松
江苏滨海县人民医院神经外科 滨海 224500
磁共振波谱分析应用于脑胶质瘤分级的研究
滕宏伟薛新潮(通讯作者)周静仇劲松
江苏滨海县人民医院神经外科滨海224500
【摘要】目的探讨脑胶质瘤患者应用磁共振波谱分析疾病分级的效果。方法对我院61例脑胶质瘤患者进行1H-MRS结合MRI诊断,并对不同级别的脑胶质瘤相关指标进行对比分析。结果脑胶质瘤患者Cr轻度下降,NAA呈显著性下降,Cho呈显著增高。低、高级别脑胶质瘤的肿瘤组织与对侧正常脑组织的NAA、Cho值有显著性差异(P<0.05);低级别和高级别脑胶质瘤的肿瘤组织NAA、Cr值有显著性差异(P<0.05)。NAA/Cho和NAA/Cr值反映肿瘤级别较稳定;NAA/Cr、NAA/Cho值呈负相关,Cho/Cr值呈正相关。结论临床上采用1H-MRS结合MRI对脑胶质瘤患者进行诊断准确性高,尤其对胶质瘤代谢特性与肿瘤生长的潜能情况,具有较好的准确性,值得临床推广。
【关键词】磁共振波谱;脑胶质瘤;分级
脑胶质瘤主要为神经胶质瘤,以星形细胞瘤和极性成胶质细胞瘤较为多见[1],其次是少枝胶质细胞瘤、室管膜胶质瘤、髓母细胞瘤。脑胶质瘤占颅脑肿瘤的40%~50%,是最常见的颅内恶性肿瘤,其诊断与治疗一直是临床的难题[2-3]。本文对磁共振波谱分析应用于脑胶质瘤分级的临床效果进行探讨,报告如下。
1资料与方法
1.1一般资料2010-01—2012-12我院收治的脑胶质瘤患者61例,男34例,女27例,年龄23~75岁,平均(42.7±9.8)岁。所有病例经病理活检检查后,证实低级别胶质瘤33例(Ⅰ级胶质瘤10例,Ⅱ级胶质瘤23例),高级别胶质瘤28例(Ⅲ级胶质瘤19例,Ⅳ级胶质母瘤9例)。
1.2检查方法采用GE signa Excite Ⅱ 1.5T超导MR扫描仪,头颅四通道相控阵线圈,采取常规MRI平扫和增强扫描(Gd-DTPA,0.2 mL/kg)。常规MRI平扫:T1WI轴位和矢状位扫描,TR/TE =690 ms/15 ms,层数20,层厚5 mm,层间距1 mm,视野23 cm,激励次数(NEX)2,矩阵192×256;T2WI轴位扫描,TR/TE =4 200 ms/90 ms,层数20,层厚5 mm,层间距1 mm,视野23 cm,激励次数1,矩阵192×256。MRI增强扫描:T1WI轴位、矢状位和冠状位扫描,TR/TE =690 ms/15 ms,层数20,层厚5 mm,层间距1 mm,视野23 cm,激励次数2,矩阵192×256。
1.3图像和数据处理处理波普图像采用GE Function tool分析软件,由2位中级职称以上人员共同阅片以获得不同代谢物的分布图,选择不同感兴趣区的体素,获得1H-MRS曲线[4]。MRS评价指标包括氮-乙酰天门冬氨酸(N-acetylaspartate,NAA)、肌酸(creatine,Cr)和胆碱复合物(choline,Cho)的峰值高度及比值[5-6]。
1.4统计学处理采用EXCEL软件将数据录入、整理后均采用统计软件SPSS 17.0进行分析处理,计量资料采用均数±标准差表示,行t检验,计数资料组间比较采用χ2检验,P<0.05为差异有统计学意义。
2结果
2.1胶质瘤常规MR表现本研究中Ⅰ级胶质瘤10例,T1WI呈低或等信号,T2WI呈高信号,平扫和增强都可以表现不均质;Ⅱ级20例,T1WI呈低信号,T2WI呈高信号,增强无显著变化;Ⅲ级胶质瘤20例,Ⅳ级胶质瘤11例,T1WI呈低、等混杂信号,T2WI呈不均匀高信号,均呈显著不规则环形强化。
2.2各级别胶质瘤不同位置代谢物含量脑胶质瘤患者Cr轻度下降,NAA显著下降,Cho显著增高。低、高级别脑胶质瘤的肿瘤组织与对侧正常脑组织的NAA、Cho值有显著性差异(P<0.05);低级别和高级别脑胶质瘤的肿瘤组织NAA、Cr值有显著性差异(P<0.05)。见表1。
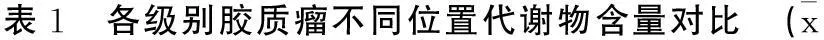
±s)
2.3瘤体区与瘤周区高低级阈值设定情况NAA/Cho和NAA/Cr值反映肿瘤级别较稳定,指标均较高(P<0.05)。见表2。
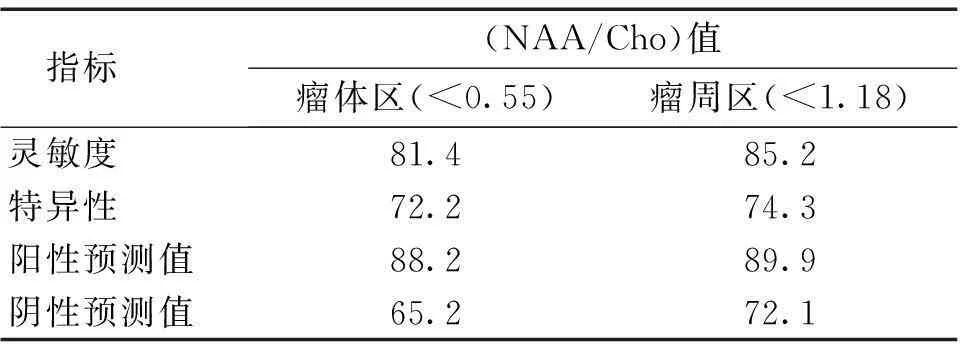
表2 瘤体区与瘤周区高低级阈值设定 (%)
2.4不同磁共振方法区分高低级胶质瘤比较采用MRS鉴别高级胶质瘤的阳性预测值、特异度、敏感度、阴性预测值均大于单独采用MRI各项指标(P<0.05)。见表3。
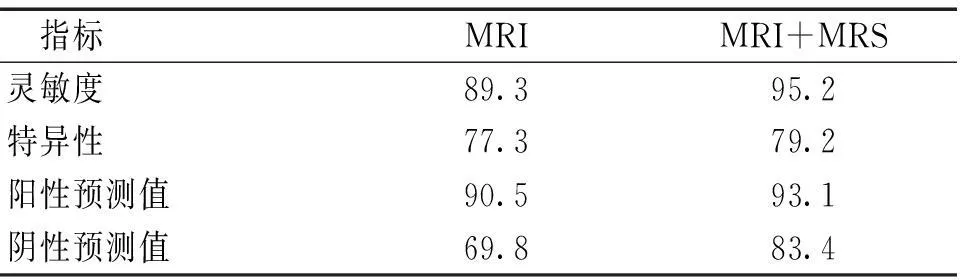
表3 不同磁共振方法区分高低级胶质瘤比较 (%)
3讨论
近年来,随着人们生活方式日趋多样化,临床上胶质瘤的症状频频发生,给该疾病患者带来诸多痛苦,严重威胁生命健康质量[7-8]。由于胶质瘤具有与其他中枢神经系统肿瘤不同的生理机制表现,无论肿瘤级别高低,均未发现明显包膜症状,主要呈浸润性生长模式[9]。相关研究表明[10-12],胶质瘤的生长方式主要有4种表现:(1)瘤细胞以单个或多个同时对患者邻近的脑组织侵袭;(2)室管膜下基膜、肿瘤按照血管、软脑膜等部位分布;(3)肿瘤沿白质纤维不断侵袭;(4)肿瘤通过患者的脑脊液组织而对远处部位波散。由以上不同生长方式可知,胶质瘤与其他中枢神经系统肿瘤相比,具有更强大的侵袭性作用,且随着肿瘤级别的不断增高,该级别的肿瘤侵袭范围随之增大。不同等级的胶质瘤MR表现特征具有多样性[13-15],Ⅰ级胶质瘤T1WI呈低或等信号,T2WI呈高信号,平扫和增强均可表现不均质;Ⅱ级T1WI呈低信号,T2WI呈高信号,增强无显著变化;而Ⅳ级胶质瘤T1WI呈低、等混杂信号,T2WI呈不均匀高信号,均呈显著不规则环形强化,这些表现本文均有一致性表现。
本研究发现,脑胶质瘤患者Cr轻度下降,NAA呈显著性下降,Cho呈显著性增高。低、高级别脑胶质瘤的肿瘤组织与对侧正常脑组织的NAA、Cho值有显著性差异(P<0.05);低级别和高级别脑胶质瘤的肿瘤组织NAA、Cr值有显著性差异(P<0.05)。NAA/Cho和NAA/Cr值反映肿瘤级别较稳定;NAA/Cr、NAA/Cho值呈负相关,Cho/Cr值呈正相关。因此,临床采用1H-MRS结合MRI对脑胶质瘤患者进行诊断准确性高,尤其胶质瘤代谢特性与肿瘤生长的潜能情况。
4参考文献
[1]徐胜生,欧阳羽,罗天友,等.氢质子磁共振波谱联合弥散加权成像对脑胶质瘤分级的临床应用[J].生物医学工程学杂志,2011,28(3):470-474.
[2]湛先发,熊坤林.磁共振波谱分析技术在颅脑疾病中的应用进展[J].现代预防医学,2011,38(19):3 978-3 980.
[3]Regenbogen SE,Lancaster RT,Lipsitz SR,et al. Does the Surgical Apgar Score measure intraoperative performance? [J]. Ann Surg,2008,248(2):320-328.
[4]Callm V,Galanaud D,Le Fur Y,et al.1H MR spectroscopy of human brain tumours: apractical approach[J]. Eur J Radiol,2008,67(2):268-274.
[5]赵东晖,李庆军,何建芳,等.头颅MR、DWI、MRS、术中快速冰冻与脑胶质瘤病理分级对比[J].中国实用神经疾病杂志,2011,14(11):4-7.
[6]闵志刚,刘红娟,李敏,等.磁共振灌注成像对胶质瘤良恶性分级的荟萃分析[J].中华医学杂志,2010,90(41):2 927-2 931.
[7]Soares DP,Law M. Magnetic resonance spectroscopy of the brain: review of metabolites and clinical applications[J]. Clin Radiol,2009,64(1):12-21.
[8]陈晓雷,许百男,王飞,等.功能神经导航及术中磁共振成像在语言区胶质瘤手术中的应用[J].中华外科杂志,2011,49(8):688-692.
[9]李伟,龙晚生,梁英林,等.磁共振波谱分析在脑胶质瘤分级中的应用研究[J].生物医学工程学进展,2011,10(3):153-171.
[10]邢细红,曾晖,王雄伟,等. EGFR信号通路调控人胶质瘤U87细胞侵袭转移的分子机制[J].中国微侵袭神经外科杂志,2012,41(18):1 818-1 820.
[11]郭志旺,漆松涛,王浩,等.胶质瘤及瘤周1HMRS与肿瘤细胞增殖活性分析[J].中国神经精神疾病杂志,2009,35(3):133-136.
[12]吴雪斌,张伟国,谭勇,等.磁共振灌注及波谱成像在鉴别高级别胶质瘤和转移瘤中的应用[J].中国临床医学影像杂志,2010,21(6):381-354.
[13]Callot V,Galanaud D,Le Fur Y.1H MR spectroscopy of human brain tumours: a practical approach[J]. Clin Radiol,2008,67(2):268-274.
[14]姚成军,吴劲松,庄冬晓,等. MRI弥散加权成像对胶质瘤分级的临床价值[J].重庆医学,2008,37(14):1 557-1 564.
[15]阮志兵,范光明,沈金丹,等.磁共振扩散加权成像与氢质子波谱联合应用对脑内环形强化病变的鉴别诊断[J].放射学实践,2012,27(12):1 298-1 303.
(收稿2015-01-20)
【中图分类号】R739.41
【文献标识码】A
【文章编号】1673-5110(2016)03-0076-02

