17β-雌二醇及生长激素在薄型子宫内膜患者冷冻胚胎移植内膜准备中的作用
凌丹丹,施晓波
(中南大学湘雅二医院,长沙 410011)
17β-雌二醇及生长激素在薄型子宫内膜患者冷冻胚胎移植内膜准备中的作用
凌丹丹,施晓波*
(中南大学湘雅二医院,长沙410011)
【摘要】目的探讨17β-雌二醇及生长激素(GH)在薄型子宫内膜患者的治疗应用情况。方法回顾性分析前次补佳乐替代周期因子宫内膜薄而取消周期的66名患者,改用17β-雌二醇或加用生长激素再次准备内膜的80个冻融胚胎移植(FET)周期的临床资料。根据内膜准备方案分为17β-雌二醇组、17β-雌二醇+GH组、补佳乐+GH组,分析各组年龄、不孕年限、移植胚胎数、优胚率、不孕类型构成等基本情况和移植日血清E2水平、移植日内膜厚度、生化妊娠率、临床妊娠率等临床结局情况。结果三组患者移植日内膜厚度较既往失败周期均有提高(分别为8.76±0.35 mm vs.5.65±0.23 mm,7.78±0.19 mm vs.5.23±0.15 mm,8.31±0.24 mm vs. 5.91±0.19 mm),差异均有统计学意义(P<0.01);17β-雌二醇+GH组移植日内膜厚度虽较17β-雌二醇组薄(7.78±0.19 mm vs. 8.76±0.35 mm)、但临床妊娠率更高(54.3% vs. 18.2%),差异均有统计学意义(P<0.01)。结论三种不同方案均能改善补佳乐替代周期中薄型子宫内膜患者子宫内膜厚度及临床结局,其中可能17β-雌二醇+GH是较为理想的替代方案,但仍需更大样本量的研究验证。
【关键词】17β-雌二醇;生长激素;薄型子宫内膜;冷冻胚胎移植;临床妊娠率
薄型子宫内膜是指低于能够获得妊娠的最低厚度的内膜形态,目前对于薄型子宫内膜厚度的界值仍有争议,多数学者认为7 mm是较合适的分界值[1-2]。薄型子宫内膜往往不能充分地增殖与分泌,致使内膜结构、生化物质分泌等方面异常而不能形成有利于胚胎着床的微环境,从而导致子宫内膜容受性降低[3]。因此薄型子宫内膜是导致周期取消、胚胎种植失败的重要因素之一。针对薄型子宫内膜患者,尤其是既往应用常规补佳乐激素替代方案没有达到理想效果而取消周期或移植失败的患者,如何改善其内膜状态一直是生殖医师面临的难题。近年来许多文献报道引入17β-雌二醇、生长激素(GH)等药物的应用有利于提高内膜厚度,改善内膜容受性,从而改善冻融胚胎移植(FET)结局[4-7]。本研究回顾性分析了前次补佳乐替代周期因子宫内膜薄而取消周期的66名患者,改用17β-雌二醇或加用生长激素再次准备内膜的80个冻融胚胎移植(FET)周期的临床资料,了解17β-雌二醇及GH在薄型子宫内膜患者中的治疗效果。
一、资料与方法
1. 研究对象:2014年3月至2015年5月在中南大学湘雅二医院妇产科生殖中心接受FET助孕的患者。
纳入标准:年龄≤49岁;至少一次补佳乐替代周期≥21 d因薄型子宫内膜(<7 mm)而取消周期改用其他内膜准备方案的周期(其中部分患者之前自然周期排卵期子宫内膜<7 mm后改补佳乐替代);不育因素包括输卵管因素、排卵障碍、男方因素等;有1个或以上冻融胚胎;FET周期月经第2~3天抽血查雌二醇(E2)、黄体生成素(LH)、孕酮(P)均在早卵泡期水平(E245.75~607.56 pmol/L;LH 2.4~12.6 U/L; P 0.634~4.755 nmol/L),阴道超声检查子宫及双附件未见异常;无合并其他内外科疾病。
排除标准:宫腔黏连、宫腔积液、子宫内膜息肉、内膜增生病变、双输卵管积水、卵巢肿瘤、其他肿瘤性疾病等。
2. 分组:入选周期根据内膜准备方案分为三组。
17β-雌二醇组:于月经周期3~5天开始口服17β-雌二醇(芬吗通,白片,荷兰苏威制药)2 mg/d,服药第10天B超监测子宫内膜厚度,若子宫内膜厚度<6 mm,维持17β-雌二醇口服剂量不变的同时酌情17β-雌二醇1~2片阴道上药,每3~4 d 行B超监测子宫内膜厚度,当子宫内膜厚度≥8 mm时,给予17β-雌二醇(芬吗通,灰片)4 mg/d,口服。同时注射黄体酮针剂40~60 mg/d,使子宫内膜转化成分泌期,使用黄体酮针剂第5天移植第3天胚胎。之后继续使用芬吗通灰片和黄体酮,至妊娠8周后逐渐减量,妊娠10~12周停药。
17β-雌二醇+重组人GH组:于月经周期3~5天开始口服17β-雌二醇片2 mg/d+GH(安苏萌,安徽安科生物工程)4U Qd/Qod皮下注射,服药第10天B超监测子宫内膜厚度,若子宫内膜厚度<6 mm,维持17β-雌二醇口服剂量不变的同时酌情17β-雌二醇1~2片阴道上药,每3~4 d行B超监测子宫内膜厚度,当子宫内膜厚度≥8 mm时,给予芬吗通(灰片)4 mg/d,口服。同时注射黄体酮针剂40~60 mg/d,使子宫内膜转化成分泌期,同时停用GH,使用黄体酮针剂第5天移植第3天胚胎,黄体支持同前。
补佳乐+重组人GH组:于月经周期3~5天开始口服补佳乐(戊酸雌二醇,德国拜耳)片6~8 mg/d+GH 4U Qd/Qod皮下注射,服药第10天B超监测子宫内膜厚度,若子宫内膜厚度<6 mm增加补佳乐剂量,维持补佳乐口服剂量不变的同时酌情补佳乐1~2片阴道上药,每3~4 d行B超监测子宫内膜厚度,当子宫内膜厚度≥8 mm时,给予补佳乐6~8 mg/d,同时注射黄体酮针剂40~60 mg/d,使子宫内膜转化成分泌期,同时停用GH,使用黄体酮针剂第5天移植第3天胚胎。黄体支持同前。
3. 胚胎冷冻解冻方法:胚胎冷冻采用玻璃化冷冻法,复苏采用快速法,复苏后有≥50%卵裂球存活视为存活胚胎。
4. 妊娠判断标准:胚胎移植后14 d查血人绒毛膜促性腺激素(β-HCG),若阳性即为生化妊娠,移植后28 d进行超声检查。宫内妊娠判断标准:宫内有孕囊及胚芽、胎心搏动,宫外未见异常回声;异位妊娠判断标准:宫内未见明显孕囊回声,而宫外见混合回声;如宫内见孕囊同时宫外见混合回声,诊断为宫内外妊娠。
5. 胚胎分级:采用胚胎形态学评估方法。优质胚胎为第2天正常受精,第3天6~9细胞的1~2级胚胎,且中间无晚裂(晚裂是指D1看到了原核,D2没有卵裂,D3才卵裂)。
6. 统计学分析:研究资料采用SPSS19.0软件进行统计分析,计数资料采用χ2检验,正态分布计量资料采用方差分析,偏态分布计量资料采用Kruskal-Wallis H检验,P<0.05为差异有统计学意义。
二、结果
1. 患者一般情况:本研究3组共纳入80周期,其中重复周期14个,共66名患者;其中17β-雌二醇组22周期,17β-雌二醇+GH组35周期,补佳乐+GH组23周期。66名患者平均年龄(30.7±5.3)岁,平均不孕年限(4.7±3.7)年。三组患者平均年龄、不孕年限、优质胚胎率、不孕类型构成、胚胎移植数目比较,均无统计学差异(P>0.05)(表1)。
2.治疗结局比较:三组患者移植日内膜厚度较既往补佳乐替代周期内膜厚度均有显著提高(P<0.01)。17β-雌二醇组与17β-雌二醇+GH组既往失败的补佳乐替代周期的内膜厚度之间差异无统计学意义(P>0.05),补佳乐+GH组则显著高于17β-雌二醇+GH组(P<0.01);17β-雌二醇+GH组研究周期移植日内膜厚度(7.78±0.19 mm)较17β-雌二醇组(8.76±0.35 mm)及补佳乐+GH组(8.31±0.24 mm)薄,且前两组间差异有统计学意义(P<0.01)。
三组患者移植日E2水平均无统计学差异(P>0.05)。
80个周期生化妊娠率为42.5%,临床妊娠率为37.5%。三组之间生化妊娠率差异无统计学意义(P>0.05)。17β-雌二醇组、17β-雌二醇+GH组及补佳乐+GH组临床妊娠率分别为18.2%、54.3%、30.4%,17β-雌二醇+GH治疗组临床妊娠率显著高于17β-雌二醇组(P<0.01)(表2)。
三、讨论
内膜准备方案中子宫内膜容受性最好的是自然周期,但当自然周期内膜偏薄或患者月经不规则时常选择替代周期,既往大量临床资料表明替代周期也能达到与自然周期相近的妊娠率[8]。既往替代周期方案最常用的药物是补佳乐(戊酸雌二醇),可使大部分患者子宫内膜厚度达到胚胎移植要求,应用方便、经济,便于临床医生很好地掌握胚胎移植时机,是较好的子宫内膜准备方案。但临床上存在部分患者因炎症、反复流产刮宫、机械损伤或宫腔黏连分离等因素,反复使用大剂量戊酸雌二醇片也无法使子宫内膜达到理想的厚度,目前尚无妥善的治疗方案。有研究认为,刺激周期血清HCG日内膜厚度<8 mm时患者的种植率和妊娠率明显降低[9-11],而内膜厚度<7 mm时,妊娠率几乎为零[12]。
表1三组患者基线资料比较[x-±s,n(%)]

组 别周期数年龄(年)不孕年限(年)优胚率不孕类型构成(继发/总数)移植胚胎数(枚)17β-雌二醇2229.7±1.24.9±1.013/46(28.3)18/222.09±0.1117β-雌二醇+GH3530.9±0.74.6±0.624/72(33.3)27/352.03±0.72补佳乐+GH2331.3±1.53.9±0.511/50(22.0)22/232.05±0.13
表2三组临床结局比较[x-±s,n(%)]
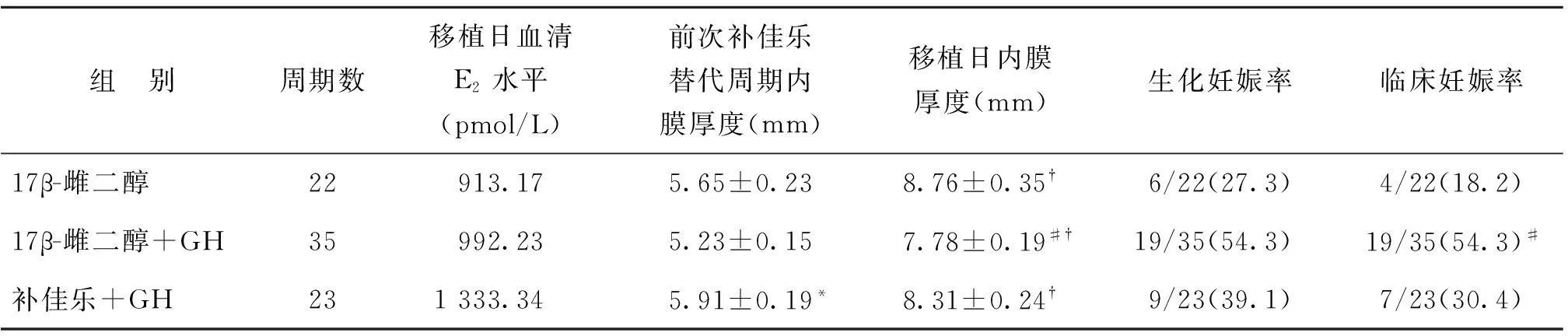
组 别周期数移植日血清E2水平(pmol/L)前次补佳乐替代周期内膜厚度(mm)移植日内膜厚度(mm)生化妊娠率临床妊娠率17β-雌二醇22913.175.65±0.238.76±0.35†6/22(27.3)4/22(18.2)17β-雌二醇+GH35992.235.23±0.157.78±0.19#†19/35(54.3)19/35(54.3)#补佳乐+GH231333.345.91±0.19*8.31±0.24†9/23(39.1)7/23(30.4)
注:移植日血清E2水平为偏态分布资料,采用中位数表示;与17β-雌二醇+GH比较,*P<0.01;与17β-雌二醇组比较,#P<0.01;与前次失败周期比较,†P<0.01;
本研究纳入周期均为既往有补佳乐替代周期21 d以上因内膜薄(<7 mm)取消移植而改用其他方案的FET周期,即纳入对补佳乐反应不良的患者做为研究对象。近年来,针对单纯使用补佳乐仍不能获得满意子宫内膜厚度的患者,有生殖中心使用17β-雌二醇替代或加用GH并取得了理想效果。本中心自2014年3月开始应用17β-雌二醇及重组人GH于替代周期中薄型子宫内膜患者。本研究结果表明,纳入研究周期的移植日内膜厚度较既往补佳乐替代周期平均内膜厚度有明显增加,三种方案都能改善对补佳乐反应不良的患者的内膜增长情况及临床结局。
芬吗通的活性组分17β-雌二醇片为微粒化雌二醇,与补佳乐相比,具有与人体内源性E2相同的化学和生物学特性,不需要经过肝脏脱除戊酸基就能作用于雌激素受体,与人体内的活性雌激素结构完全相同,既可口服也可阴道用药,阴道吸收效果较好[13]。据文献报道,芬吗通阴道用药可以更有效地增加其在子宫中的浓度,芬吗通阴道用药相同剂量的血药浓度约为口服补佳乐相同剂量血药浓度的4倍[14],且能减少全身用药引起的乳房胀痛等副反应[15]。早有研究表明,17-β雌二醇能有效改善单纯使用大剂量戊酸雌二醇仍不能达到理想状态的患者的内膜厚度,并能改善子宫内膜血流。且这种血流的改变主要与血管内皮生长因子(VEGF)有关。VEGF主要表达于子宫内膜上皮细胞,在正常月经周期中,随着血循环中E2水平的增高,诱导子宫内膜上皮细胞表达VEGF,并通过旁分泌方式作用于内皮下的血管网,引起微血管的增殖和通透性的增加,促进血浆自微血管流入到细胞间质。这些血浆富含E2、胰岛素样生长因子(IGF)和其他细胞因子等,为上皮细胞的进一步增殖提供了良好的内环境[16]。也有文献报道芬吗通能调节子宫内膜种植窗的免疫环境,从而改善内膜的容受性[17]。既往有文献报道单纯使用17β-雌二醇,移植日内膜厚度偏薄,临床妊娠率低[18],本研究也得出相似结论。但是偏倚可能来源于芬吗通目前在国内各中心主要应用于补佳乐替代周期薄型子宫内膜或种植失败的患者。
本研究结果显示GH能改善补佳乐替代周期因内膜偏薄而取消周期患者的内膜生长情况及临床结局。GH 作为一种由脑垂体前叶噬酸性细胞分泌的单一肽链的蛋白质激素,既往主要用于治疗儿童生长激素缺乏症,其主要生理功能包括促进神经组织以外的所有其他组织生长,促进机体合成代谢和蛋白质合成,促进脂肪分解等作用。近年随着临床研究深入,发现GH具有广泛的调节作用,可能通过IGF等生长介质或直接作用于靶细胞表面的生长激素受体(GHR)刺激靶细胞生长[19-21]。有研究表明GH 缺乏的妇女,循环中IGF水平下降,雌激素促子宫内膜细胞增殖的信号传导途径被阻断,临床表现为子宫内膜对雌激素反应不良。国外学者在口服雌激素替代妇女的代谢实验中发现口服雌激素能拮抗GH的生物学作用,其不仅能抑制GH引起的IGF水平升高,也可影响脂类及蛋白合成代谢[22],也可直接引起循环中IGF下降[23],并且依赖于雌激素剂量。但GH能间接通过胰岛素样生长因子-I(IGF-I)或直接作用于子宫内膜的GHR,改善子宫内膜局部血液循环,增强雌、孕激素受体敏感性,协调着床因子间相互关系。马新想等[24]对子宫内膜生长不良患者在IVF-ET周期中加用 GH,通过改善子宫内膜容受性而提高 IVF-ET 周期妊娠率。李秀清等[25]研究发现对多次胚胎移植失败的患者促排周期同时使用GH能明显改善患者子宫内膜厚度、形态及内膜血流。本研究结果证实,补佳乐加用GH后能增加子宫内膜厚度,改善妊娠结局;改用17β-雌二醇在内膜达到标准厚度后(8 mm),尽管加用GH组内膜厚度相对较薄,但临床结局相对最好,可能也与GH从多方面改善子宫内膜容受性有关。17β-雌二醇加用GH组内膜较薄的原因可能为两种药物之间相互影响的结果,但也不能排除内膜本身存在药物敏感的差异性,进一步的机制探讨需更加严谨的前瞻性研究设计或基础实验来说明。
综上所述,三种不同方案均能改善补佳乐替代周期中薄型子宫内膜患者子宫内膜厚度及临床结局,其中可能17β-雌二醇加用GH是较为理想的替代方案,但目前数据样本量较小,仍需继续扩大观察样本量,细化分析指标,如用药时间长短、剂量、途径等,排除一些混杂因素后方能得出更有说服力的结论。
【参考文献】
[1]Okohue JE,Onuh SO,Ebeigbe P,et al. The effect of endometrial thickness on in vitro fertilization (IVF)-embryo transfer/intracytoplasmic sperm injection (ICSI) outcome [J]. Afr J Reprod Health,2009,13: 113-121.
[2]El-Toukhy T,Coomarasamy A,Khairy M,et al. The relationship between endometrial thickness and outcome of medicated frozen embryo replacement cycles[J]. Fertil Steril,2008,89: 832-839.
[3]王海燕,孙林,王磊,等.芬吗通在氯米酚促排卵周期子宫内膜薄患者中的应用[J].生殖医学杂志,2015,24:200-203.
[4]赵诗艺,刘英,杨晓葵,等.薄型子宫内膜冻融胚胎移植周期中应用雌二醇/雌二醇地屈孕酮的疗效观察[J]. 实用妇产科杂志,2015,31:270-273.
[5]王佩玉,赵军招,金聪聪,等. 芬吗通和补佳乐在冻融胚胎移植周期中的应用比较[J].温州医科大学学报,2015,45:36-39,44.
[6]Noel S,Herman A,Johnson GA,et al. Ovine placental lactogen specificially binds to endometrial glands of the ovine uterus[J]. Biol Reprod,2003,68:772-780.
[7]项云改,谭丽,赵冬梅,等.生长激素对子宫内膜发育不良患者内膜容受性及体外受精-胚胎移植临床结局的影响[J].医药论坛杂志,2011,32:56-58,60.
[8]陈华,孙海翔,王慧焱,等.自然周期与替代周期准备内膜对冷冻胚胎移植结局的影响[J].南京医科大学学报(自然科学版),2010,30:245-248.
[9]Richter KS,Bugge KR,Bromer JG,et al. Relationship between endometrial thickness and embryo implantation,based on 1,294 cycles of in vitro fertilization with transfer of two blastocyst-stage embryos [J]. Fertil Steril,2007,87:53-59.
[10]Mikolajczyk M,Skrzypczak J. Endometrial receptivity-can it be diagnosed and controlled? And why does it matter?[J].Ginekol Pol,2014,85:149-153.
[11]Yoeli R,Ashkenazi J,Orvieto R,et al. Significance of increased endometrial thickness in assisted reproduction technology treatments[J]. J Assist Reprod Genet,2004,21:285-289.
[12]McWilliams GD,Frattarelli JL. Changes in measured endometrial thickness predict in vitro fertilization success[J].Fertil Steril,2007,88:74-81.
[13]孙林,王磊,柯雪,等. 芬吗通在冻融周期子宫内膜发育不良患者中的应用[J].生殖医学杂志,2014,23:42-47.
[14]陈蓉,吴丽萍.激素补充治疗中不同雌激素的特点[J].中国计划生育和妇产科,2012,4:13-16.
[15]李华,李蓉,刘洋,等.芬吗通改善反复胚胎移植失败患者子宫内膜血流和提高妊娠率的研究[J].生殖医学杂志,2014,23:37-41.
[16]Koos RD.Minireview:Putting physiology back into estrogens’ mechanism of action[J].Endocrinology,2011,152:4481-4488.
[17]Lukassen HG,Joosten I,van Cranenbroek B,et al. Hormonal stimulation for IVF treatment positively affects the CD56bright/CD56dimNK cell ratio of the endometrium during the window of implantaion[J].Mol Hum Reprod,2004,10:513-520.
[18]唐慧珍,高士友,邓朝晖,等.三种内膜准备方案在冻融胚胎移植中的结局分析[J].生殖医学杂志,2015,24:236-239.
[19]Nishiyama K,Sugimoto T,Kaji H,et al. Stimulatory effect of growth hormone on bone resorption and osteoclast differentiation[J]. Endocrinology,1996,137:35-41.
[20]Bannink EM,van der Palen RL,Mulder PG,et al. Long-term follow-up of GH-treated girls with Turner syndrome:BMI,blood pressure,body proportions[J].Horm Res,2009,71:336-342.
[21]Maffei L,Rochira V,Zirilli L,et al. A novel compound heterozygous mutation of the aromatase gene in an adult man:reinforced evidence on the relationship between congenital oestrogen deficiency,adiposity and the metabolic syndrome[J]. Clin Endocrinol (Oxf),2007,67:218-224.
[22]Wolthers T,Hoffman DM,Nugent AG,et al. Oral estrogen antagonizes the metabolic actions of growth hormone in growth hormone-deficient women[J]. Am J Physiol Endocrinol Metab,2001,281:E1191-1196.
[23]Kelly JJ,Rajkovic IA,O’Sullivan AJ,et al. Effects of different oral oestrogen formulations on insulin-like growth factor-1,growth hormone and growth hormone binding protein in post-menopausal women[J]. Clin Endocrinol (Oxf),1993,39:561-567.
[24]马新想,孙莹璞,苏迎春,等. 生长激素在子宫内膜发育不良中的作用[J]. 现代妇产科进展,2009,18:330-332.
[25]李秀清,高小琴,韩雪黎,等.多次胚胎移植失败生长激素对子宫内膜及内膜血流的影响[J].实用医技杂志,2014,21:1333-1335.
[编辑:陆彩玲]
【作者简介】凌丹丹,女,湖南省岳阳人,硕士,生殖内分泌专业.(*通讯作者,Email: shixiaobo8848@aliyun.com)
【收稿日期】2015-06-12;【修回日期】2015-08-14
DOI:10.3969/j.issn.1004-3845.2016.1.015
——MIYOTA薄型GL/N/M系列机心

