刚毛柽柳液泡膜H+-PPase基因的克隆与胁迫下的表达分析
张春蕊,贾园园,王艳敏,2,王玉成,杨传平,王 超*
(1 东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040;2 黑龙江省林业科学研究所, 哈尔滨 150081)
刚毛柽柳液泡膜H+-PPase基因的克隆与胁迫下的表达分析
张春蕊1,贾园园1,王艳敏1,2,王玉成1,杨传平1,王超1*
(1 东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040;2 黑龙江省林业科学研究所, 哈尔滨 150081)
摘要:通过对刚毛柽柳转录组分析,鉴定获得1个液泡膜H+-PPase基因的cDNA序列,命名为ThVP1。该cDNA序列全长3 022 bp,开放阅读框为2 298 bp,编码765个氨基酸,编码蛋白相对分子质量80.37 kD,理论等电点5.25。ThVP1 编码蛋白的疏水性较强,含有13个跨膜区。氨基酸多序列比对结果显示,ThVP1具有典型的液泡膜H+-PPase 家族3个高度保守片段(CS1 、CS2 和CS3),与大豆VP1氨基酸序列一致性最高,为93%。系统进化分析表明,ThVP1属于I型液泡膜H+-PPase基因。实时荧光定量RT-PCR分析显示,NaCl和PEG胁迫下,ThVP1在柽柳根和叶中均呈现明显上调表达,表达量最高达到对照的20.9倍,暗示ThVP1可能在刚毛柽柳抗旱耐盐过程中发挥重要作用。
关键词:刚毛柽柳;液泡膜H+-PPase;胁迫响应;基因表达
高盐和干旱是限制植物生长和发育的主要逆境因素,土壤中大量Na+进入细胞后,会造成植物细胞脱水,细胞的离子平衡紊乱,影响植物正常生理代谢,从而抑制植物的生长发育,严重时可以导致植物死亡[1]。盐生植物主要依靠离子区隔化的方法,通过液泡膜Na+/H+逆向转运蛋白将细胞质中过多的Na+区隔到液泡中[2],从而减轻Na+对细胞质内的各类代谢酶的危害,同时降低了细胞渗透势,进而提高植物的耐盐性和抗旱性。而在此过程中,液泡膜质子泵(H+-ATPase和H+-PPase)为Na+/H+逆向转运蛋白逆浓度梯度将Na+转入液泡中提供质子驱动力[3-4]。
液泡膜H+-PPase,又称液泡膜H+转运无机焦磷酸酶(H+-pyrophosphatase,H+-PPase,EC3.6.1.1),是一种区别于H+-ATPase 的H+转运酶,广泛存在于植物、少数藻类、原生动物、细菌以及原始细菌中[5-6]。在液泡膜上,H+-PPase 能够把无机焦磷酸(PPi)水解为2个Pi,同时产生的自由能催化H+由胞质向液泡的运输,与液泡膜H+-ATPase一起,为各种溶质分子(如阳离子、阴离子、氨基酸和糖类等)的跨液泡膜主动运输提供驱动力,起到质子泵的作用[7-8]。1992年,Sarafian等[9]从拟南芥(Arabidopsisthaliana)中克隆出高等植物的第1个液泡膜H+-PPase基因AVP1(M81892)。1999年,Gaxiola等[10]将拟南芥液泡膜H+-PPase基因AVP1在酵母盐敏感突变体ena1上超表达后,该突变体恢复了耐盐性;随后,Gaxiola 等[11]将带有35S启动子的AVP1基因转入拟南芥,与野生型相比,AVP1超表达的转基因植株能在250 mmol/L NaCl处理下正常生长,耐盐性和耐旱性显著提高,在转基因植株液泡中,包括Na+在内的阳离子的积累明显增加。过表达AVP1基因的番茄(Lycopersiconesculentum)和陆地棉(Gossypiumhirsutum)转基因植株也表现出比野生型植株更强的对干旱和盐胁迫的耐受性[12-13]。这些研究都表明了液泡膜H+-PPase在植物响应逆境胁迫中起着重要作用。
迄今为止,已从许多高等植物中克隆到液泡膜H+-PPase基因[3],然而这些基因大多数都来自抗逆性不强的模式植物或农作物上。刚毛柽柳(Tamarixhispida)是一种具有很强抗逆能力的木本盐生植物,能在含盐量达1%的土壤中形成天然林,因此是研究木本植物耐盐机理和进行耐盐基因克隆的理想材料。本研究通过对刚毛柽柳根部组织转录组数据分析,克隆获得了1条刚毛柽柳液泡膜H+-PPase基因(ThVP1)全长cDNA 序列,并对该序列进行了生物信息学分析,进一步利用实时定量RT-PCR技术分析了其在盐和干旱胁迫下不同时间点的表达模式,以期了解该基因在柽柳非生物胁迫应答中的功能。
1材料和方法
1.1实验材料与处理
刚毛柽柳种子采自中国科学院吐鲁番沙漠植物园。将刚毛柽柳种子播种于V(泥炭土)∶V(沙) =2∶1的混合土壤中,置于平均温度24 ℃、光照/暗时间16 h/8 h、相对湿度70%~75%的温室中培养。选取生长状态良好和长势一致的2月龄刚毛柽柳幼苗,分别用20%(w/v)PEG6000和0.4 mol/L NaCl进行胁迫处理,同时用正常浇水幼苗作为对照。在胁迫3、6、9、12、24、48、72和96 h后取刚毛柽柳的根部组织和地上部分组织,每个处理重复3次,每个样品取20棵幼苗,将其充分混匀,用液氮速冻,置于-80 ℃冰箱用于RNA的提取。
1.2方法
1.2.1总RNA的提取采用CTAB法提取刚毛柽柳在各处理下不同时间点的根部组织和地上部分组织的总RNA,按照Prime ScriptTMRT reagent Kit(TaKaRa)进行反转录合成cDNA,置于-20℃冰箱保存备用。
1.2.2液泡膜ThVP1全长cDNA序列克隆与分析通过对刚毛柽柳转录组测序数据的分析,根据Unigenes功能注释结果获得1条液泡膜H+-PPase基因(ThVP1)的序列。以柽柳cDNA为模板对该基因进行PCR扩增,目的条带经胶回收纯化后,连接到pMD18-T载体上进行测序。利用在线工具ORF founder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析ThVP1的开放读码框;利用ExPASy (http://www.expasy.org/tools/protparam.html)在线软件预测ThVP1编码的氨基酸序列的分子量及理论等电点。利用Bioedit对ThVP1的同源蛋白序列进行多序列比对;利用MEGA5.0软件中Neighbor-Joining方法构建系统进化树;利用二级结构预测软件(https://www.predictprotein.org/)预测ThVP1基因编码的蛋白质的二级结构。利用在线工具TMpred(http://www.genome.cbs.dtu.dk/services/TMHMM/)预测ThVP1可能的跨膜区;利用Protscale(http://web.expasy.org/cgi-bin/protscale/protscale.pl)在线分析ThVP1蛋白质的疏水性。应用WoLF PSORT软件(http://wolfpsort.seq.cbrc.jp/)进行亚细胞定位预测。

表1 实时定量RT-PCR 引物序列
1.2.3实时定量RT-PCR根据ThVP1全长cDNA序列设计定量引物,以刚毛柽柳β-actin (FJ618517)、β-tubulin (FJ618518) 和β-tubulin (FJ618519)基因作为内参基因,引物序列见表1。利用MJ Opticon实时定量PCR仪(Bio-Rad,Hercules,CA)分析ThVP1的表达情况。实时荧光定量RT-PCR使用试剂盒TransStart Top Green qPCR SuperMix(TransGen)进行,反应体系:2×TransStart Top Green qPCR SuperMix 10 μL,上游引物和下游引物(10 μmol/L)各1 μL,稀释后的模板cDNA 2 μL,加灭菌去离子水补足体积至20 μL。反应程序为:94 ℃预变性30 s;94 ℃变性12 s,58 ℃退火30 s,72 ℃延伸45 s,79 ℃读板1 s,45个循环。待PCR反应结束后,将反应温度以0.5 ℃/s的速度从55 ℃升到99 ℃。每个样品重复3次,用2-ΔΔCt方法进行基因的相对定量分析[14-15]。
2结果和分析
2.1ThVP1基因全长cDNA的获得及序列分析
通过对刚毛柽柳转录组数据分析,获得1条编码H+-PPase基因的序列。由于转录组测序获得的基因序列是由小片段拼接而成,为了确保序列的准确性,我们克隆了该基因并进行测序,获得的测序结果与转录组测序拼接的编码序列完全相同。利用NCBI 网站在线软件对该基因编码蛋白进行保守结构域分析,结果显示:其属于H+转运无机焦磷酸酶超家族,具有典型的H+-PPase结构域(图1),将该基因命名为ThVP1(GenBank登录号KU880710)。ThVP1基因cDNA全长为3 022 bp,包含2 298 bp完整的开放读码框,编码765个氨基酸。推测ThVP1编码蛋白质的分子量为80.37 kD,理论等电点为5.25,分子式为 C3670H5772N900O1053S32。
采用Predictprotein软件预测ThVP1编码蛋白的二级结构(图2),结果表明:该蛋白质的二级结构中,α-螺旋和无规则卷曲占主要部分,分别占60.92%和33.86%。疏水结构预测表明,ThVP1编码蛋白质具有明显的疏水区,且均匀分布于整个肽链(图3)。跨膜结构预测显示,该蛋白包含13个跨膜螺旋结构(图4),亚细胞定位预测显示其定位于液泡膜上,表明ThVP1是一个液泡膜跨膜蛋白。
2.2ThVP1同源比对与进化树构建
将ThVP1的氨基酸序列与10种植物液泡膜H+-PPase的氨基酸序列进行同源性比较,结果显示ThVP1与其他植物的VP1氨基酸序列一致性较高,为93%~89%。ThVP1具有H+-PPase家族高度保守的3个结构域(CS1,CS2和CS3),其中CS1 中包含保守的DVGADLVGKVE氨基酸序列, 与H+-PPase家族基因结构一致(图6)[16-17]。
利用MEGA5.0软件对不同植物的H+-PPase基因氨基酸序列构建系统进化树(图5),结果显示ThVP1与南瓜CmVP1等I类液泡膜H+-PPase亲缘关系较近,而与拟南芥VP2等Ⅱ类液泡膜H+-PPase亲缘关系较远,表明ThVP1是柽柳的一个I类液泡膜H+-PPase。
2.3非生物胁迫下ThVP1基因的表达
为了进一步研究ThVP1基因对逆境胁迫的响应情况,采用实时RT-PCR方法分析其在NaCl和PEG胁迫下的表达模式。ThVP1在高盐及干旱胁迫下均呈现为表达上调,但在各胁迫时间点和不同组织中的表达模式有所差异(图7)。在NaCl胁迫下,ThVP1在柽柳根部表达量迅速上升,在胁迫6 h表达量达到最高,表达上调12.2倍,随着胁迫时间的延长,ThVP1表达量又逐渐降低;在地上部组织中,ThVP1表达量在3 和12 h呈现2个高峰,表达分别上调20.9和17.9倍。
在PEG6000模拟干旱胁迫下,ThVP1在柽柳根部和地上组织表达均呈现先上升再下降的趋势。在根部组织中,ThVP1在胁迫12 h表达量达到顶峰,表达上调14.2倍;在地上部组织中,ThVP1表达量在6 h达到最大值,表达上调16.5倍。

图2 ThVP1蛋白质二级结构预测Fig. 2 Secondary structure prediction of ThVP1

图1 ThVP1保守结构域分析Fig. 1 Conserved domain analysis of ThVP1

图3 ThVP1蛋白质的疏水结构预测Fig. 3 Hydrophobicity analysis of ThVP1

图4 ThVP1蛋白质的跨膜结构预测Fig. 4 Transmembrane domain prediction of the antiporter protein ThVP1

标尺代表每单位氨基酸的变化,0.1代表两个序列之间10%的差异; ThVP1. 刚毛柽柳;VrVP1. 绿豆;OsVP1.水稻;HbVP1. 橡胶树;GhVP1. 棉花;NtVP1.烟草;AtVP1. 拟南芥;SbVP1.高粱;AtVP2. 拟南芥;BvVP1. 甜菜;CmVP1. 南瓜;TaVP1. 小麦;HvVP1. 大麦;ZmVP1. 玉米;ZmVP2. 玉米;ThVP2. 盐芥;VvVP2. 葡萄图5 几种植物VP蛋白同源序列的系统进化树分析The scale bar expected the number of substitution per site, 0.1 means 10% changes were observed between two sequences;ThVP1. Tamarix hispida(KU880710); VrVP1. Vigna radiata (AB009077); OsVP1. Oryza sativa(BAD02277.1); HbVP1. Hevea brasiliensis(AY514019); GhVP1.Gossypium hirsutum (ADN96173); NtVP1. Nicotiana tabacum(X77915); AtVP1. Arabidopsis thaliana(M81892); SbVP1. Sorghum bicolor (ADJ67258); AtVP2.Arabidopsis thaliana(AF182813); BvVP1. Beta vulgaris(L32791); CmVP1. Cucurbita moschata (BAA3333149); TaVP1. Triticum aestivum(AY296911); HvVP1. Hordeum vulgare(ACA63883); ZmVP1. Zea mays(CAG29370);ZmVP2. Zea mays(ABK51382); ThVP2. Eutrema halophilum(BAJ33614); VvVP2. Vitis vinifera(CA041672)Fig. 5 Phylogenetic tree analysis of VP proteins from various plant species
综上所述,ThVP1对高盐和干旱胁迫具有明显的响应,在柽柳根部和地上组织中表达量显著上升,表明ThVP1可能参与柽柳抗旱耐盐生理过程。同时发现ThVP1在地上部相对表达量高于根部,推测其主要在柽柳叶和茎中发挥抗逆功能。
3讨论
离子区隔化是植物进行渗透调节的主要方式之一,液泡膜H+-PPase作为质子泵,在植物离子区隔化过程中发挥重要的作用。研究发现,大多数植物H+-PPase基因的开放读码框(ORF)含有2 283~2 319个核苷酸,编码大约761 ~ 773个氨基酸残基,分子量为80~81 kD[18-21],不同物种中的H+-PPase基因具有高度的序列同源性[22]。本研究从刚毛柽柳中克隆到H+-PPase基因ThVP1,其开放阅读框长2 298 bp,编码765个氨基酸,分子量为80.37 kDa。ThVP1具有植物H+-PPase共有的氨基酸序列DVGADLVGKVE,与大豆、菜豆、巨桉、棉花等植物的液泡膜H+-PPase基因具有较高同源性。因此,ThVP1在结构上符合植物液泡膜H+-PPase的特性。

粗线框表示保守结构域CS1;虚线框表示保守结构域CS2;细线框表示保守结构域CS3; 图中从上至下依次代表的是刚毛柽柳、大豆、菜豆、巨桉、棉花、可可树、油棕、马铃薯、苹果、毛果杨的H+-PPase氨基酸序列图6 ThVP1与其他植物H+-PPase同源序列的比较The thick lines stand for conserved domain CS1; dashed box stand for conserved domain CS2; thin box stand for conserved domain CS3;The amino acid sequences in the map which from the top to the bottom represent: Tamarix hispida (KU880710), Glycine max (XP_003542656.1), Phaseolus vulgaris (XP_007155080.1), Eucalyptus grandis (XP_010050115.1), Gossypium hirsutum (ADN96173.1), Theobroma cacao ( XP_007013600.1), Elaeis guineensis (XP_010928300.1), Solanum tuberosum ( XP_006359496.1), Malus domestica (XP_008352108.1) and Populus trichocarpa (XP_006381091.1)Fig. 6 Alignment analysis of ThVP1 with H+-PPase from other plants
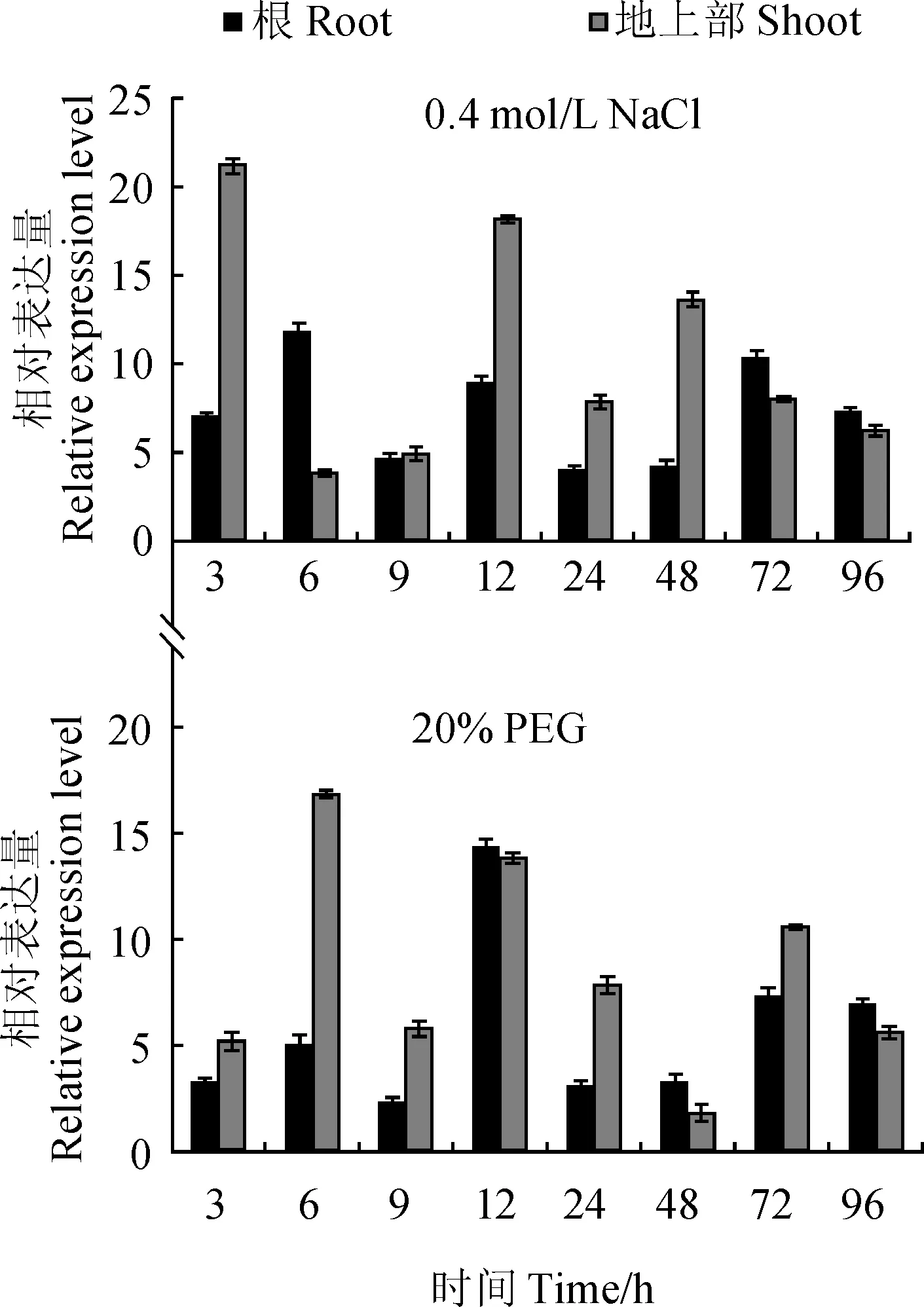
图7 ThVP1基因在不同胁迫下的表达模式分析Fig. 7 Expression analysis of ThVP1 gene under several abiotic stresses
高等植物中存在2种类型的液泡膜H+-PPase:Ⅰ型和Ⅱ型。Ⅰ型依赖K+激活而适度被Ca2+激活,Ⅱ型对K+不敏感而对Ca2+极其敏感[23-24]。这2种类型的H+-PPase在氨基酸序列相似性仅有37%~39%,在细胞中参与不同的生理过程,目前对Ⅰ型功能的研究多于Ⅱ型[25]。本研究中的柽柳ThVP1与大豆、拟南芥等植物的Ⅰ型H+-PPase的氨基酸序列相似性较高(>80%),亲缘关系较近;而与拟南芥Ⅱ型H+-PPase氨基酸序列相似较低(<40%),表明ThVP1属于Ⅰ型液泡膜H+-PPase。
尽管不同物种中的H+-PPase基因具有高度的同源性,但研究发现不同植物的H+-PPase基因转录水平或活性对盐胁迫的响应存在很大差异。Colombo 和Cerana报道盐胁迫可提高胡萝卜悬浮细胞中液泡膜H+-PPase活性[26];Fukuda 等[27]用100 mmol/L NaCl 处理大麦后,其根中H+-PPase基因转录水平显著升高,表明NaCl诱导H+-PPase活性或转录水平增加。然而,有研究发现Na+对一些植物的H+-PPase具有抑制作用。Nakamura 等[28]发现100 mmol/L NaCl 处理下绿豆根部H+-PPase活性受到强烈抑制。NaCl处理下冰叶日中花(Mesembryanthemumcrystallinum)中H+-PPase的含量和活性均下降。这些研究结果表明H+-PPase活性或转录水平的变化可能与植物种类、器官类型、发育状态等诸多因素有关。为了研究液泡膜H+-PPase基因在柽柳非生物胁迫应答中的功能,本研究采用实时RT-PCR方法分析ThVP1在NaCl和PEG胁迫下的表达模式。在NaCl和PEG胁迫处理后,ThVP1基因在柽柳的根部和地上部的表达量均明显增加,特别是在地上部组织中,ThVP1基因在胁迫后呈现高丰度表达。ThVP1在干旱和高盐胁迫下的表达变化也存在器官差异性,其在地上部的相对表达量高于根部,推测其主要在柽柳叶和茎中参与对Na+的隔离,从而提高柽柳的耐盐和抗旱能力。
2001年,Gaxiola等[11]报道了过表达拟南芥液泡膜H+-PPase基因AVP1提高了转基因拟南芥的抗旱耐盐能力。此后,盐芥、盐地碱蓬、沙冬青、盐爪爪的H+-PPase基因的抗逆功能也得到了验证[29-31]。 这些研究表明利用转化液泡膜H+-PPase基因提高植物的耐盐能力,是利用基因工程方法培育耐盐植物新品种的一种有效途径。刚毛柽柳是具有优良抗逆能力的盐生植物,与甜土植物相比,盐生植物的离子区隔化更为明显和有效。ThVP1对干旱和盐分胁迫高度响应,暗示其可能在刚毛柽柳离子区隔化过程中发挥重要作用[32]。 后续研究将把ThVP1转入拟南芥和柽柳中验证其抗逆功能,以期为植物抗逆育种提供有效的基因资源。
参考文献:
[1]ZHU J. Plant salt tolerance[J].TrendsinPlantScience,2001, (6):66-71.
[2]BLUMWALD E ,POOLE R J. Na/H antiport in isolated tonoplast vesicles from storage tissue ofBetavulgaris[J].PlantPhysiology,1985,78(1):163-167.
[3]BLUMWALD E. Tonoplast vesicles for the study of ion transport in plant vacuoles[J].Physiol.Plantarum,1987, (69):731-734.
[4]王延枝. 植物液泡膜上的焦磷酸酶[J]. 植物生理学通讯. 1990,(4): 73-76.
WANG Y Z. Plant vacuole membrane pyrophosphatase[J].PlantPhysiologyCommunications,1990,(4):73-76 .
[5]MAESHIMA M. Vacuolar H+-pyrophosphatase[J].BiochimicaetBiophysicaActa-biomembranes,2000,1 465(1):37-51.
[6]DROZDOWICZ Y M,REA P A. Vacuolar H(+)pyrophosphatases: from the evolutionary backwaters into the mainstream[J].TrendsinPlantScience,2001,6(5):206-211.
[7]BUCHANAN BB G W J R. Biochemistry and Molecular Biology of Plants[M].AmerimanSocietyofPlantPhysiologists,2000:637-638.
[8]包爱科,张金林,郭正刚,等. 液泡膜H+-PPase与植物耐盐性[J]. 植物生理学通讯. 2006, (4): 777-783.
BAO A K, ZHANG J L,GUO Z G,etal. Tonoplast H+-pyrophosphatase involved in plant salt tolerance[J].PlantPhysiologyCommunications,2006,42(4):777-783 .
[9]SARAFIAN V, KIM Y, POOLE R J,etal. Molecular cloning and sequence of cDNA encoding the pyrophosphate-energized vacuolar membrane proton pump ofArabidopsisthaliana[J].ProceedingsoftheNationalAcademyofSciences,1992,89(5):1 775-1 779.
[10]GAXIOLA R A, RAO R, SHERMAN A,etal. TheArabidopsisthalianaproton transporters, AtNhx1 and Avp1, can function in cation detoxification in yeast[J].ProceedingsoftheNationalAcademyofSciences,1999,96(4) :1 480-1 485.
[11]GAXIOLA R A, LI J, UNDURRAGA S,etal. Drought- and salt-tolerant plants result from overexpression of the AVP1 H+-pump[J].ProceedingsoftheNationalAcademyofSciences,2001,98(20): 11 444-11 449.
[12]PARK S ,LI J ,PITTMAN J K,etal. Up-regulation of a H+-pyrophosphatase (H+-PPase) as a strategy to engineer drought-resistant crop plants[J].ProceedingsoftheNationalAcademyofSciences,2005,102(52):18 830-18 835.
[13]PASAPULA V ,SHEN G ,KUPPU S ,etal. Expression of anArabidopsisvacuolar H+-pyrophosphatase gene (AVP1) in cotton improves drought- and salt tolerance and increases fibre yield in the field conditions[J].PlantBiotechnologyJournal,2011,9(1):88-99.
[14]LIVAK K J ,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)] method[J].Methods,2001,25(4):402-408.
[15]VANDESOMPELE J ,De PRETER K ,PATTYN F ,etal. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].GenomeBiology,2002,3(7):H34.
[16]DROZDOWICZYM K J R. AVP2,a sequence-divergent,K+-insensitive H+-translocating in organic pyrophosphatase fromArabidopsis[J].PlantPhysiology,2000,123(1) :353-362.
[17]ZHU J K. Plant salt tolerance[J].TrendsinPlantScience,2001,6(2):66-71.
[18]REA P A, KIM Y, SARAFIAN V,etal. Vacuolar H(+)-translocating pyrophosphatases: a new category of ion translocase[J].TrendsinBiochemicalSciences,1992,17(9):348-353.
[19]MAESHIMA M. TONOPLAST TRANSPORTERS: Organization and function[J].AnnualReviewofPlantPhysiologyandPlantMolecularBiology,2001,52:469-497.
[20]LÜSY J Y P X. cDNA cloning of a vacuolar H+-pyrophosphatase and its expression inHordeumbrevisubulatum(Trin.) Link. in response to salt stress[J].AgriculturalSciencesinChina,2005,4(4): 247~251.
[21]SARAFIAN V, KIM Y, POOLE R J,etal. Molecular cloning and sequence of cDNA encoding the pyrophosphate-energized vacuolar membrane proton pump ofArabidopsisthaliana[J].ProceedingsoftheNationalAcademyofSciences,1992,89(5):1 775-1 779.
[22]NAKANISHI Y, MAESHIMA M. Molecular cloning of vacuolar H(+)-pyrophosphatase and its developmental expression in growing hypocotyl of mung bean[J].PlantPhysiology,1998,116(2):589-597.
[23]SERRANO A, PEREZ-CASTINEIRA J R, BALTSCHEFFSKY M,etal. H+-PPases: yesterday, today and tomorrow[J].IubmbLife,2007,59(2) :76-83.
[24]GAXIOLA RA P M S K. Plant proton pumps[J].FebsLetters,2007,581:2 204-2 214.
[25]MOHAMMED S A, NISHIO S,TAKAHASHI H,etal. Role of vacuolar H+-inorganic pyrophosphatase in tomato fruit development[J].JournalofExperimentalBotany,2012,63(15):5 613-5 621.
[26]R C R C. Enhanced activity of tonoplast pyrophosphatase in NaCl.Grown cells ofDaucuscarota[J].JournalofPlantPhysiology,1993,142(2):226-229.
[27]FUKUDA A C K M M. Effect of salt and osmotic stresses on the vacuolar H+-pyrophosphatase, H+-ATPase subunit A, and Na+/H+antiport from barley[J].JournalofExperimentalBotany,2004,55(397): 585-594.
[28]BREMBERGER C ,LUTTGE U. Dynamics of tonoplast proton pumps and other tonoplast proteins ofMesembryanthemumcrystallinumL. during the induction of crassulacean acid metabolism[J].Planta,1992,188(4) :575-580.
[29]GAO F, GAO Q, DUAN X,etal. Cloning of an H+-PPase gene fromThellungiellahalophilaand its heterologous expression to improve tobacco salt tolerance[J].JournalofExperimentalBotany,2006,57(12) :3 259-3 270.
[30]GUO S, YIN H, ZHANG X,etal. Molecular cloning and characterization of a vacuolar H+-pyrophosphatase gene,SsVP, from the halophyteSuaedasalsaand its overexpression increases salt and drought tolerance ofArabidopsis[J].PlantMolecularBiology,2006,60(1) :41-50.
[31]YAO M, ZENG Y, LIU L,etal. Overexpression of the halophyteKalidiumfoliatumH(+)-pyrophosphatase gene confers salt and drought tolerance inArabidopsisthaliana[J].MolecularBiologyReports,2012,39(8) :7 989-7 996.
[32]BLUMWALD E . Sodium transport and salt tolerance in plants[J].CurrentOpinioninCellBiology, 2000,12(4): 431-434.
(编辑:宋亚珍)
Cloning and Expression Analysis of a Vacuolar H+-PPase Gene fromTamarixhispida
ZHANG Chunrui1,JIA Yuanyuan1,WANG Yanmin1、2,WANG Yucheng1,YANG Chuanping1,WANG Chao1*
(1 State Key Laboratory of Tree Genetics and Breeding, Northeast Forestry University, Harbin 150040,China; 2 Heilongjiang Forestry Academy of Science, Harbin 150081,China)
Abstract:A full length cDNA of a vacuolar H+-PPase gene (named ThVP1) was isolated from the transcriptome cDNA librarys of Tamarix hispida. ThVP1 was 3 022 bp in length, including an open reading frame of 2 298 bp which was predicted to encode a polypeptide of 765 amino acids. The estimated molecular weight and isoelectric points of the putative protein were 80.37 kD and 5.25, respectively. Hydrophobicity analysis and transmembrane domain prediction indicated that the ThVP1 contained 13 potential transmembrane domains with strong hydrophobicity. The amino acids sequence of ThVP1 contains three conservative domains (CS1, CS2 and CS3),which shows 93% identities in amino acids sequence to vacuolar H+-PPase genes from Reaumuria trigyna. Phylogenetic analysis indicates that ThVP1 belongs to class I type vacuolar H+-PPase gene. Quantitative real-time PCR assay revealed that the mRNA level of ThVP1 was significantly up-regulated by more than 20- fold higher than that of control under NaCl and PEG treatments in Tamarix hispida, suggesting that ThVP1 might play an important role in salt and drought tolerance of T. hispida.
Key words:Tamarix hispida; vacuolar H+-PPase; stress responses; gene expression
文章编号:1000-4025(2016)05-0881-07
doi:10.7606/j.issn.1000-4025.2016.05.0881
收稿日期:2016-01-22;修改稿收到日期:2016-04-28
基金项目:国家自然科学基金(31300571);教育部博士点基金(20130062120012)
作者简介:张春蕊(1991-),女,在读硕士研究生,主要从事林木抗逆机理研究。 E-mail. zcr_sherry@163.com *通信作者:王超,博士,副教授,硕士生导师,主要从事林木分子育种研究。E-mail. wzyrgm@163.com
中图分类号:Q786
文献标志码:A

