饲料中玉米赤霉烯酮检测及脱毒技术的研究进展
葛文霞, 柳旭伟*, 张文举, 刘晓娜
(1.石河子大学动物科技学院,新疆石河子 832000;2.新疆农业职业技术学院动物科技学院,新疆昌吉 831100)
饲料中玉米赤霉烯酮检测及脱毒技术的研究进展
葛文霞1,2, 柳旭伟1,2*, 张文举1, 刘晓娜2
(1.石河子大学动物科技学院,新疆石河子 832000;2.新疆农业职业技术学院动物科技学院,新疆昌吉 831100)
摘要玉米赤霉烯酮是由镰刀菌产生的一种类雌激素样真菌毒素,具有极强的毒性,能给人和动物的健康带来极大的危害。结合国内外的最新研究成果,对玉米赤霉烯酮的检测技术以及脱毒方法等方面的研究进展进行了综述。
关键词饲料;玉米;赤霉烯酮;检测;脱毒

玉米赤霉烯酮(Zearalenone,ZEA),又称玉米烯酮、F-2 雌性发情毒素、雌激素因子,首先从有赤霉病的玉米中分离到[1]。ZEA是由镰刀菌产生的一种类雌激素样真菌毒素,产生ZEA最常见的是禾谷镰刀菌,此外还有三线镰刀菌、木贼镰刀菌、雪腐镰刀菌、粉红镰刀菌等[2],目前已知与其相似的衍生物至少有 15 种[3]。ZEA广泛存在于霉变的玉米、高粱、小麦、燕麦、大麦等谷类作物以及奶中,是世界上污染范围最广的一种镰刀菌毒素[4]。ZEA广泛存在于自然界,具有广泛的毒性作用,主要表现为慢性毒性、致癌作用、生殖毒性、发育毒性及遗传毒性,可引起动物流产、死胎、返情等生殖异常现象,是霉菌毒素中污染较严重且对人和动物危害较大的一种毒素[5]。笔者对ZEA的检测以及脱毒方法等方面的研究进展进行了综述。
1玉米赤霉烯酮的基本结构及理化性质
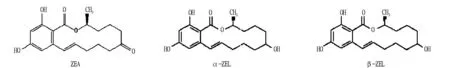
图1 ZEA及其主要代谢产物的结构
ZEA最初于1962年由Stob等[6]从已污染禾谷镰刀菌的发霉玉米中分离得到。1966年Urry[7]用经典化学、核磁共振和质谱技术确定了玉米赤霉烯酮的化学结构,并正式确定其化学名称为:6-(10-羟基-6-氧代-反式-1-十一碳烯基)-β-雷锁酸-内酯,分子式 为C18H22O5,分子量为328。ZEA为白色晶体,结构稳定,熔点为161~163 ℃,微溶于碱性溶液,不溶于水,易溶于甲醇、乙醇、乙醚及苯等有机溶剂[8]。ZEA甲醇溶液在紫外光下呈明亮的绿-蓝色荧光[9]。ZEA是一种取代的2,4-二羟基苯甲酸内醋类化合物,其结构式与苯甲酸内酯类似。ZEA在体内可以被还原成玉米赤霉烯醇(Zearalel,ZEL)。ZEL有2种非对应的立体异构体α和β,其中α-ZEL熔点较低(168~169 ℃),而β-ZEL熔点较高(174~176 ℃)。ZEA及其主要代谢产物的结构[10]如图1所示。
2玉米赤霉烯酮的检测方法
2.1化学检测方法采用化学检测方法可对ZEA及其15种衍生物进行检测,目前常用的化学检测方法有薄层色谱法(TLC)、气相色谱-质谱联用法(GC-MS)、高效液相色谱法(HPLC)、液谱和质谱联用法(LC-MS)。
2.1.1薄层色谱法(TLC)。薄层色谱分析法是较早用于毒素检测的一种方法。从20世纪70年代开始,国外学者就采用TLC法测定小麦、谷类、玉米以及玉米制品等多种样品中的ZEA含量。1995年国际公职分析化学家联合会(AOAC)发布了检测ZEA的TLC方法。1996年我国发布的中华人民共和国进出口商品检验行业标准“出口粮谷中赤霉烯酮检验方法”、2004年发布的国家标准“饲料中玉米赤霉烯酮的测定”以及2005年发布的国家标准“粮食卫生标准”均采用薄层色谱法[11]。Schaafsma等[12]利用TLC测定谷物中的ZEA含量,此方法检出限为200 ng/kg,可以避免ZEA代谢物对测定的干扰。
薄层色谱法操作简便,费用低廉,可以定性、半定量或者定量测定,在检测条件无法满足采用高效液相色谱法的要求时,可采用此法。此外,为了提高抗干扰能力,样品液还可以先通过IAC柱、SPE柱及多功能净化柱等净化。但是,此方法最大的缺点是琐碎费时,且灵敏度、特异性较差,在观察评定中人为因素起主要作用,极易出现较大误差,已不能满足现代检测的要求,目前该方法只在特殊情况下作为仲裁检验[13]。
2.1.2气相色谱(GC)-质谱(MS)联用法。气相色谱(GC)-质谱(MS)联用法检测灵敏度较高,该方法能够同时进行多种毒素检测,也是美国 AOAC的官方指定检测方法。Zhang等[14]建立了免疫亲和柱-GC-MS 方法同时检测α-玉米赤霉醇、β-玉米赤霉醇、玉米赤霉烯酮和玉米赤霉烯醇的方法,发现4种物质的最低检测限和定量限均可达0.5和1.0 ng/kg。GC-MS法的灵敏度较高,但是,因为设备昂贵、需要专业人员的操作,对试验环境要求也较高,所以其使用受到限制。
2.1.3高效液相色谱法(HPLC)。ZEA具有荧光特性,可采用HPLC对样品中的ZEA含量进行检测,灵敏度较高。检测粮食中 ZEA 含量的HPLC方法为:首先用乙腈-水对样品中元素进行提取,经过净化与浓缩后,再运用荧光检测器对 ZEA 元素进行检测;ZEA 元素的定量方法采用外标法。此法 ZEA 元素回收率一般为88%~93%,样品变异系数为1.5%~4.0%,ZEA检测极限10 ng/kg或0.31 μg/kg[15]。
2.1.4液谱和质谱联用法(LC-MS)。与其他化学检测方法相比,LC-MS检测灵敏度更高,检测结果更加精准、可信。但是,此方法的检测过程极为复杂,所需检测设备昂贵,使用成本高,不适合大批量样品的检测以及大范围推广。
Meri等[16]利用HPLC-MS/MS测定小麦、大麦、燕麦中31种真菌毒素,检出限为1.00~1.250 ng/kg,回收率为51%~122%,日内相对标准偏差为2%~6%,日间相对标准偏差为14%~28%。Zollner等[17]采用高效液相色谱-质谱联用法测定小麦以及啤酒中ZEA及其代谢物α-ZOL和β-ZOL,其检测限为0.5 ng/kg。梁颖等[18]应用HPLC-MS测定小麦面粉中的ZEA、脱氧雪腐镰刀菌烯醇和雪腐镰刀菌烯醇3种镰刀菌毒素,检出限分别为5、10和12 ng/kg,RSD均小于10%,回收率达93.7%,具有很好的精密度。
2.2免疫学检测方法
2.2.1酶联免疫吸附测定法(ELISA)。ELISA是目前最为常用的检测ZEA的方法之一,被世界上绝大多数学者所认可。ELISA检测法的准确度高,可用作批量检测。常用的ELISA法有直接竞争酶联免疫吸附法、间接竞争酶联免疫吸附法、间接竞争抑制酶免疫化学发光检测方法(CLIA)和生物素-亲和柱酶联免疫吸附法。
万宇平等[19]于2013年研制的ZEA检测ELISA试剂盒,其线性检测范围为 50~405 μg/L,线性相关系数为0.990 0,IC50为25.1 μg/L,最低检测限为93.5 μg/kg,对玉米赤霉醇有较高的交叉反应率,对饲料样品的回收率为 74.5%~109.9%,样品检测变异系数小于 12.9%,试剂盒可在4 ℃环境下保存 12 个月,具有较高的稳定性。邱云青等[20]于2010年研制的ZEA 酶免疫化学发光检测方法(CLIA),其最低检出浓度和最低检测量分别为0.007 ng/mL和0.15 μg/kg,线性范围为0.01~50.00 ng/mL。
2.2.2免疫胶体金(GICA)快速诊断技术。GICA是一种快速免疫学诊断检测技术,主要用于医学检测,目前临床上已有10余种检测试剂在使用。Anna Y K等[21]采用竞争免疫层析技术检测小麦中的ZEA,抗ZEA单克隆抗体作金标抗体,玉米赤霉烯酮-牛血清白蛋白作检测带,IgG作质控带,制得试纸条。该试纸条的最低检测限为100 μg/kg。李翘等[22]应用胶体金免疫层析技术研制一种玉米等谷物中ZEA残留免疫胶体金快速检测试剂板。该试剂板的最低检测限为100 μg/kg,整个检测过程仅需15 min,与其他霉菌毒素无交叉反应,该试剂板可用于ZEA残留快速检测。GICA具有单样本检测、快速简便、特异性强、灵敏度高、无需辅助的试剂和仪器、可肉眼观察结果、结果可长期保存等特点,特别适用于大量样本的筛检工作,易于普及推广。
2.3其他检测方法时间分辨荧光技术和噬菌体展示技术也是目前比较常用的免疫检测方法。一些研究员使用时间分辨荧光技术进行ZEA检测,使用Eu3+对抗体进行标记,发现该方法能够检测到0.101 ng/L 的毒素,平均回收率达到94.14%。一些研究人员利用噬菌体展示技术进行了真菌毒素检测研究,同时还结合使用ELISA 技术,起到了非常好的效果;同时,还降低了试验成本,保护了实验员健康,该检测方法的引用对建立无毒真菌毒素体系检测有着重要意义[15]。何庆华等[23]以ZEA为研究对象,采用噬菌体展示肽库、分子定向改造技术及外源基因表达等手段构建了ZEA全抗原,并建立了基于ZEA全抗原的固相膜免疫检测方法。此方法对于样品中ZEA的最低检测限为50 μg/kg。
3玉米赤霉烯酮的脱毒方法
霉菌毒素的去除方法从原理上可分为脱毒和解毒2种,按方法可大致分为化学方法、物理方法和生物学方法。霉菌毒素脱毒是指去除或中和被污染饲料中霉菌毒素的方法,霉菌毒素解毒是指去除霉菌毒素毒性的方法。对霉菌毒素污染的饲料进行的任何一种解毒或脱毒方法都应当满足以下条件:①能有效地去除、破坏或灭活霉菌毒素;②在被处理的产品中或采食被处理的饲料的动物所生成的食品中不产生有毒残留物或致癌性/致突变性残留物;③不改变饲料的营养特性和适口性;④在经济和技术方面都可行,不显著影响终产品的成本[24]。
3.1物理脱毒法物理脱毒方法包括高温失活、机械分类处理、提取被污染物或放射处理和吸附剂等。目前,高温失活、机械分类处理、提取污染物或反射处理都存在着许多不足,比如能源耗费量高,饲料原料本身的营养成分被破坏,不宜大批量进行以及脱毒效果差等。在饲料中加入霉菌毒素吸附剂是目前解决霉菌毒素污染的问题的最常用的方法。Polak等[25]在饲料中添加了各种剂量(0.5%~4.0%)的碳酸钠,这些剂量的碳酸钠体外试验表明对减少饲料中ZEA的毒性是有效的,其中2%的添加量能取得最佳效果。常顺华等[26]研究表明在霉变饲料中添加0.2%酯化葡甘露聚糖能有效吸附霉变饲料中的霉菌毒素,提高仔猪生产性能,减少毒素在血液中的残留。应用物理脱毒技术对饲料中的ZEA进行脱毒,还存在许多的问题,还有待于进一步研究。
3.2化学脱毒法化学脱毒方法是利用酸碱溶液、强氧化剂或其他化合物对霉菌毒素进行处理,从而破坏ZEA的化学结构,或使ZEA的活性基团失活,以达到脱毒目的。徐静[27]研究表明在饲料中加入21%的氧化铵(占饲料质量的1.5%),再加水至饲料质量的15%,充分搅拌,装入封闭的容器过夜后,将饲料倒出晾晒15 d,即可达到脱毒目的。Somia等[28]研究发现香精油(肉桂和丁香)在水分活度0.950和温度30 ℃的条件下,对ZEA具有最大的凝集作用。在实际生产中,玉米的水分活度通常在0.995以上,并且ZEA含量较低,所以香精油对玉米中ZEA的聚集作用并不显著。化学脱毒法虽然脱毒快速,但化学脱毒法同样存在诸多弊端(如脱毒工艺复杂、破坏饲料原料中的营养成分、降低了饲料适口性等),同时使用化学法容易造成二次污染且大规模使用价格昂贵,因此化学脱毒法在实际生产中使用范围并不广。
3.3生物脱毒法生物脱毒是目前研究霉菌毒素脱毒的热点,也是目前应用最广泛、前景最好的脱毒技术之一。生物多度是利用微生物以及代谢产物筛选具有降解ZEA能力的微生物,使ZEA被凝集、吸附、转化和分解,从而达到脱毒目的。生物脱毒可分为生物吸附法、生物降解法、转基因技术消除法以及其他一些生物处理法。
3.3.1生物吸附法。生物吸附法是利用生物资源对ZEA进行吸附,以达到脱毒目的的方法。研究表明,多种微生物菌体能够吸附ZEA,例如深红酵母可以吸附葵花籽饼粕中47.7%的ZEA;黏红酵母可以减少玉米饲料中93.2%的ZEA;发酵的地霉酵母可以使配合饲料中ZEA减少45.0%[28]。除酵母外,研究发现链球菌属和肠球菌属也能吸附ZEA毒素,吸附率可达49%,由于在生物吸附脱毒过程中样品中没有检测到ZEA的降解产物,因此推测该脱毒过程可能与菌体细胞壁的吸附作用有关,而细胞壁的吸附作用主体成分是β-D-葡聚糖等多糖[29]。
3.3.2生物降解法。生物降解法是目前脱毒技术的研究热点,是利用具有降解霉菌毒素能力的微生物进行脱毒。这些微生物菌株既有细菌(如杆菌和球菌),也有霉菌和酵母菌等。
3.3.2.1降解ZEA的细菌。能够降解ZEA细菌有以下几种:①芽孢杆菌。Tinyiro S E等[30-31]报道了2株芽孢杆菌在30 ℃供氧条件下与20 μg/L ZEA作用24 h后,能够分别降解81%和100%的ZEA,降解产物无雌激素效应。②乳酸菌。Mokoena M P等[32]报道乳酸菌在发酵的第3天就可以使加入的ZEA降低68%,在第4天可以减低75%,但是也并未降低原有的雌激素毒性。其他乳酸菌类菌株是否能将ZEA降解为无毒的产物,还有待于进一步研究。③不动杆菌。Yu Y等[33-34]从土壤中分离到1株属于不动杆菌属的细菌,该菌株在与ZEA作用12 h后,其降解产物中无ZEA,其代谢产物无雌激素活性。④粉红黏帚菌。粉红黏帚菌可以降解ZEA,经测定其代谢产物为1-(3,5-二羟苯基)-10′-羟基-1′-反式十一碳烯-6′-酮,该降解产物无任何雌激素效应[35]。
生物脱毒有较高的特异性、不会破坏饲料中的营养成分、降解高效以及无二次污染产生,受到国内外学者的广泛关注,具有十分广泛的研究前景。
3.3.3转基因技术消除法。转基因技术消除法是利用转基因技术,对能够降解ZEA的有关酶基因进行克隆后,再转导到适合的载体中进行转化,直接植入农作物中或者应用到更适于生产的微生物,从而达到控制ZEA污染的目的。程波财等[39]通过设计1对特异性引物从粉红聚端孢霉中克隆出1段795 bp大小的DNA片段,命名为ZEA-jjm,并构建E.coli原核表达载体表达,通过检测发现诱导后的细胞裂解上清液在3 h内能完全降解液体中1 μg/mg的ZEA。利用转基因技术对ZEA进行脱毒是生物脱毒法的新突破,该技术具有脱毒彻底、特异性强和无毒副产物等优点,但转基因技术并不成熟,且其安全性存在较大争论,因而在实际生产中使用该技术应保持谨慎。
4展望
从ZEA发现以来,对ZEA的各方面研究就从未停止,世界各国对ZEA的防治也取得了长足的进步,在检测和脱毒方面也取得了较好的研究成果。但是,世界各国的饲料原料、饲料以及粮食中的ZEA的污染情况依旧十分严重,因此加强对粮食、饲料以及饲料原料中的ZEA的检测和脱毒对人和动物的健康以及食品安全都具有十分重要的意义。
参考文献
[1] 张艺兵,鲍蕾,褚庆华.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006:14.
[2] 邓友田,袁慧.玉米赤霉烯酮毒性机理研究进展[J].动物医学进展,2007,28(2):78-82.
[3] 薛勇,姚学军,刘洁,等. 家禽饲料中玉米赤霉烯酮污染情况的检测与分析[J].当代畜牧,2014(2):34-35.
[4] ZINEDINE A,SORIANO J M,MOLTO J C,et al. Review on the toxicity,occu-rrence,metabolism,detoxificationg,regulation and intake of zearleno-ne[J].Food chemical toxical,2007,45(1):1-18.
[5] 张燚,龙淼,李鹏,等.玉米赤霉烯酮对哺乳动物生殖系统影响研究进展[J].畜牧与兽医,2015,47(9):121-123.
[6] STOB M,BALDWIN R S,TUITE J,et a1.Isolation of ananabolic uterotrophic compound from corn infected with Gibberella zeae[J].Nature,1962,196:1318.
[7] URRY W H, WEHRMEISTER H L. The structure of zearalenone[J]. Tetrahedron lettes,1966,7(27):3109-3144.
[8] 邬静,袁莉芸,贺军宇,等.玉米赤霉烯酮毒害作用的研究进展[J].湖南畜牧兽医,2007,39(3):7-9.
[9] 邓友田,袁慧.玉米赤霉烯酮毒性机理研究进展[J].动物医学进展,2007,28(2):89-92.
[10] 单妹,许梓荣.玉米赤霉烯酮研究进展[J].湖南饲料,2005(5):15-17.
[11] 杨小丽,杨美华,欧阳臻.玉米赤霉烯酮及其衍生物分析方法的研究进展[J]. 贵州农业科学, 2011,39(7):234-238.
[12] SCHAAFSMA A W,NICOL R W,SAVARD M E,et al.Analysis of fusarium toxins in maize and wheat using thin layer chromatography[J]. Mycopathologia, 1998,14(22):107-113.
[13] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.饲料中玉米赤霉烯酮的测定:GB/T19540-200 [S].北京:中国标准出版社,2004.
[14] ZHANG W,WANG H WANG J,et al.Multiresidue determination of zeranol and related compoundsin bovine muscle by gas chromatography/mass spectrome-try with immunoaffinity cleanup[J].Journal of AOAC iternational,2006,89(6):1677-1681.
[15] 张羽.粮食中玉米赤霉烯酮检测方法的研究进展和展望[J].中国食品安全, 2015(18):69.
[16] KOKKONEN M K, JESTOI M N.A multicom-pound LC-MS/MS method for the screening of mycotoxins in grains [J].Food analytical methods,2009(2):128-140.
[17] ZOLLNE P.Determination of zearalenone in grains by high perfor-mance liquid chromatography-tandem mass spectrometry after solid-phase extraction with RP-18 columns or immunoaffinity columns[J].Journal of chromatography A,1999,12(2):167-174.
[18] 梁颖,刘邻渭,张春晖.液质联用同时检测小麦中三种镰刀菌毒素[J].中国粮油学报,2006,21(6):160-162.
[19] 万宇平,韩黎,吴鹏,等.玉米赤霉烯酮残留检测ELISA 试剂盒的研制[J].江苏农业学报,2013,29(3):659-663.
[20] 邱云青,王伟,李凤琴.食品中玉米赤霉烯酮化学发光酶免疫方法建立[J].中国公共卫生,2010,26(12):1561-1563.
[21] ANNA Y K,SARAH D S.Development of a colloidal gold!based lateral-flow immunoassay for the rapid simultaneous detection of zearalenone and deoxynivalenol[J].Anal Bioanal Chem,2007,389(7):2103-2107.
[22] 李翘,桑丽雅,陈笑笑,等.玉米赤霉烯酮胶体金快速检测试剂板的研制[J].食品安全质量检测学报,2013,4(2):457-462.
[23] 何庆华,许杨.分子印迹技术在真菌毒素检测中的应用[J].食品科学,2009,30(11):273-275.
[24] 柳永振,朱凤华,宁雪娇,等.饲料中玉米赤霉烯酮毒素脱毒方法研究进展[J].中国饲料,2013(15):3-5,15.
[25] POLAK M,GAJECKI M,KULIK T,et al.The evalution of the efficacy of sodium carbonate as zearalenone destructor in feeding stuffs[J].Pol J Vet Sci,2009,12(1):103-111.
[26] 常顺华,朱连勤,朱凤华,等.酯化葡甘露糖作为霉菌毒素吸附剂的研究[J].饲料研究,2010(5):48-50.
[27] 许静.玉米赤霉烯酮脱毒剂的筛选及脱毒机制初步研究[D].武汉:华中农业大学,2014.
[28] 李溪,王金荣,赵银丽,等.饲料中玉米赤霉烯酮脱毒技术研究[J].饲料研究,2015(13):16-21.
[29] NIDEIKORN V,MORGARI D P,PUJOS E,et al.Screening of fermentative bacteria for their ability to bind and biotransforn deoxynivalenol,zearalenone and fumonisins in an in vitro simulated corn,silare model[J].Food additives and contaminants,2007,24(4):1-27.
[30] TINYIRO S E,YAO W,SUN X,et al.Scavenging of zearalenone by bacillus strins in vitro[J].Res J Microbiol,2011,6(3):304-309.
[31] TINYIRO S E,WOKADALA C,XU D,et al.Adsorption and degradation of zearalenone by Bacillus strains[J].Folia Microbiol,2011,56(4):321-327.
[32] MOKOENA M P,CHELULE P K,GQALENI N.Reduction of fumonisin B1 and zearalenone by lactic acid bacteria in fermented maize Mcal[J].J Food Protetion,2005,68(10):2095-2099.
[33] YU Y,QIU L,WU H,et al.Degration of zearalenone by the extracellular extracts ofAcinetobaclersp.SM04 liquid cultures[J].Biodegradation,2011,22(3):613-622.
[34] YU Y,QIU L,WU H,et al.Oxidation of zearalenone by the extracellular enzymes fromAcinetobaclersp.SM04 into smaller estrogenic products[J].World J Microbiol Biotechnol,2011,27(11):2675-2681.
[35] 蔡雨函,胡延春,赵黑成,等.玉米赤霉烯酮的毒性及生物降解研究进展[J]. 动物医学进展,2012,33(5):102-105.
[36] 吴晖,冼嘉雯,刘冬梅.一株去除玉米赤霉烯酮酵母的初步研究[J].食品工业科技,2009,30(12):215-220.
[37] JARD G,LIBOZ T,MATHIEU F,et al.Transformation of zearalenone to zearalenone-sulfate byAspergillusspp[J].World Mylotoxin J,2010,3(2):183-191.
[38] VARGA J,PETERI Z,TABORI K,et al.Degradation of ochratoxin A and other mycotoxins by Rhizopus isolates[J].Int J Food Microbiol,2005,99(3):321-328.
[39] 程波财,史文婷,罗洁,等.玉米赤霉烯酮降解酶基因(ZEA-jjm)的克隆、表达及活性分析[J].农业生物技术学报,2010,18(2):225-230.
收稿日期2015-12-17
作者简介葛文霞(1981- ),女,江苏泰兴人,副教授,硕士,从事动物营养与饲料加工研究。*通讯作者,副教授,硕士,从事动物传染病的诊断和防治。
基金项目新疆农业职业技术学院科研基金项目(XJNZYKJ2014006);公益性行业(农业)科研专项(201303062)。
中图分类号S 816
文献标识码A
文章编号0517-6611(2016)01-095-03

