健脾生血颗粒遗传毒性研究
赵 刚 张寅静 郭小娟 杨艳霞 夏 纯 黄志军
(1 健民药业集团儿童药物研究院,武汉,430052; 2 湖北省食品药品安全评价中心,武汉,430073)
健脾生血颗粒遗传毒性研究
赵 刚1张寅静2郭小娟1杨艳霞1夏 纯1黄志军1
(1 健民药业集团儿童药物研究院,武汉,430052; 2 湖北省食品药品安全评价中心,武汉,430073)
目的:考察健脾生血颗粒的遗传毒性。方法:分别采用组氨酸营养缺陷性鼠伤寒沙门氏菌TA97a、TA98、TA100、TA102、TA1535回复突变试验(Ames试验),CHO-K1细胞染色体畸变试验,以及小鼠骨髓细胞微核试验考察健脾生血颗粒的遗传毒性。结果:Ames试验结果显示,健脾生血颗粒无论在含有和不含有S9的条件下,在所有评估剂量水平的所有测试菌中均可观察到重复正常生长,且所有剂量的回复突变数与阴性对照组相比均无2倍或以上的显著上调,且无剂量反应关系;CHO-K1细胞染色体畸变试验结果显示,健脾生血颗粒650、130、26 μg/mL 3个剂量组的CHO-K1细胞染色体畸变率均小于5%;小鼠骨髓细胞微核试验结果显示,健脾生血颗粒3个剂量组[2 000、1 000和500 mg/(kg·d)]与阴性对照组间微核率差异均无统计学意义(P>0.05)。结论:在本试验条件下,健脾生血颗粒未见遗传毒性作用。
健脾生血颗粒;遗传毒性;微粒体回复突变试验;染色体畸变试验;微核试验
健脾生血颗粒与健脾生血片是健民药业集团股份有限公司独家产品,二者处方一致,主要成分均为党参、茯苓、黄芪、山药、鸡内金、龟甲、大枣等,临床常用于妊娠期妇女、小儿以及成人缺铁性贫血的治疗,尤其是脾胃虚弱及心脾两虚、气血两虚型贫血。该产品临床应用已有30余载,有效性和安全性得到了充分验证[1-3]。然而,随着产品市场不断扩大,患者安全意识逐渐提高,以及医生对该产品的深入认识需求不断加大,国家鼓励药企对已批准生产的药品进行上市后再评价研究,尤其是安全性评价研究[4]。为了进一步验证其安全性,我们在已有一般毒性研究资料的基础上开展了生殖毒性和遗传毒性试验研究。本课题将通过体外细菌[5]、离体细胞[6]、以及在体动物[7]等载体分别建立试验模型,考察健脾生血颗粒的遗传毒性情况。
1 材料与方法
1.1 实验药品 健脾生血颗粒(健民药业集团股份有限公司生产,批号:140111-18)。溶媒对照为纯水(实验室自制)和二甲基亚砜(DMSO,分析纯)(国药集团化学试剂有限公司生产,批号:20121130)。阳性对照:叠氮钠(Amresco公司生产,批号:0703C083),敌克松(Dr.Ehrenstorfer GmbH公司生产,批号:70321),2-氨基芴(Sigma-Aldrich公司生产,批号:S90850V),1,8-二羟基蒽醌(Dr.Ehrenstorfer GmbH公司生产,批号:10507),环磷酰胺(Sigma-Aldrich公司生产,批号:079K1569),甲磺酸乙酯(Sigma-Aldrich公司,批号:BCBC4573V)。
1.2 菌株及细胞 组氨酸营养缺陷性鼠伤寒沙门氏菌TA97a、TA98、TA100、TA102、TA1535,购于MOLTOX公司。CHO-K1细胞株,购于中国典型培养物保藏中心(武汉大学)。冻存的细胞株复苏后经过传代、培养,细胞密度达到1.5×105~3×105/mL时用于本课题相关试验。
1.3 实验动物 SPF级昆明种雄性小鼠,6~8周龄,体重25~30 g,购于湖北省实验动物研究中心,实验动物使用许可证号:SYXK(鄂)2012-0065,所有动物适应性喂养及检疫期5 d后给药。动物饲养于IVC笼中,每笼3只,垫料为武汉市万千佳禾实验动物养殖有限公司提供的刨花垫料。动物房相对湿度控制范围为45%~58%,温度控制范围为22~25 ℃。光照:10 h明/14 h暗循环交替至实验结束。
1.4 实验方法
1.4.1 Ames试验 取TA97a、TA98、TA100、TA102以及TA1535作为试验菌株,采用平板掺入法,分为含有和不含有大鼠肝匀浆S9两种情况试验。健脾生血颗粒选5个剂量用于试验,分别为65.00、21.67、7.22、2.41和0.80 μg/皿。阳性对照组选用敌克松(50 μg/皿)为TA97a、TA98、TA102菌株不含S9的阳性对照物;叠氮钠(1.5 μg/皿)为TA100、TA1535菌株不含S9的阳性对照物;2-氨基芴(10 μg/皿)为TA97a、TA98、TA100菌株含有S9的阳性对照物;1,8-二羟基蒽醌(50 μg/皿)为TA102菌株含有S9的阳性对照物;环磷酰胺(50 μg/皿)为TA1535菌株含有S9的阳性对照物。同体积(0.1 mL)的溶媒为阴性对照物,自发回变组不对试验菌液做任何处理。所有试验平板在掺入法操作结束后,在(37±2)℃温度下倒置培养(52±4)h,计数菌落数。
1.4.2 CHO-K1细胞染色体畸变试验 健脾生血颗粒选取3个剂量用于试验,分别为650、130和26 μg/ mL,各剂量组受试物制剂无菌条件下配制后用于试验。同时设置2组阴性对照组(分别给予总体积0.5%的DMSO和纯水)和2组阳性对照组,后者给予同体积的20 μg/mL除菌环磷酰胺(+S9)和0.25 μL/mL除菌甲磺酸乙酯(-S9)。大鼠肝匀浆混合液+S9均加入0.5 mL。在含有或不含代谢活化条件的系统(+S9/-S9)下,对正在增殖期的细胞进行给药,给药持续时间4 h,并在给药开始后22 h收获细胞。收获前以秋水仙碱处理细胞培养物4 h。各组细胞培养物分别离心(1 000 r/min)5 min、低渗处理20 min、预固定2 min、固定5 min,1 000 r/min离心富集细胞,染色,以制备染色体于显微镜下观察染色体数量和结构的改变。每个组别至少计数200个分散良好的中期分裂相细胞,计数其染色体畸变率。
1.4.3 小鼠骨髓细胞微核试验 试验小鼠随机分为5组,分别为健脾生血颗粒高、中、低剂量组[给药剂量分别为2 000、1 000和500 mg/(kg·d)]、阴性对照组(给予同体积的纯水)以及阳性对照组(单次腹腔注射给予环磷酰胺10 mL/kg)。除阳性对照组外,其余动物均采取单次灌胃方式给药。阴性对照组及健脾生血颗粒各剂量组中的一半动物于给药开始后24 h处死,另一半于给药开始后48 h处死,阳性对照组动物于给药后24 h处死。处死后的动物取股骨,蘸取少量小牛血清作骨髓涂片,甲醇固定,Gimesa染色,显微镜下观察并对微核进行计数,每只小鼠计数1 000个嗜多染红细胞(PCE),以含微核的PCE千分率计算微核率。
1.5 统计学方法 Ames试验统计分析时的实验单位为平皿数,计数每个平皿的回变菌落数,并统计各剂量3个平皿回变菌落数的均数和标准差。对于某个菌株任一个剂量的健脾生血颗粒所诱导的菌落回变数,与相应的溶媒对照组相比,具有2倍或以上的显著上调,并且该上调具有显著的剂量相关性,则认为该受试物为诱变阳性。CHO-K1细胞染色体畸变试验和小鼠骨髓细胞微核试验均采用χ2检验方法,与阴性对照组进行比较,以P<0.05为差异有统计学意义。
2 结果
2.1 Ames试验结果 菌落计数结果显示,健脾生血颗粒无论在含有和不含有S9的条件下,在所有评估剂量水平的所有测试菌中均可观察到重复正常生长,且所有剂量的回复突变数与阴性对照组相比均无2倍或以上的显著上调,且无剂量反应关系。所有阳性和阴性对照值在可接受范围内,并满足所有有效试验的标准,表明健脾生血颗粒对鼠伤寒沙门氏菌无致突变性。见表1、表2。
2.2 CHO-K1细胞染色体畸变试验 CHO-K1细胞染色体观察结果显示,纯水阴性对照组和DMSO阴性对照组的CHO-K1细胞染色体畸变率均小于5%,而环磷酰胺阳性对照组和甲磺酸乙酯阳性对照组的CHO-K1细胞染色体畸变率均大于10%,验证了该评价系统的有效性。受试物健脾生血颗粒高、中、低3个剂量组的CHO-K1细胞染色体畸变率均小于5%,呈阴性结果,表明在该试验条件下,健脾生血颗粒对CHO-K1细胞染色体无致畸作用。见表3。
2.3 小鼠骨髓细胞微核试验 健脾生血颗粒各剂量组在给药直至取材前,所有动物均未见异常。健脾生血颗粒对小鼠骨髓细胞微核率的影响。结果显示,健脾生血颗粒各剂量组与阴性对照组间小鼠骨髓细胞微核率差异均无统计学意义(P>0.05),结果为阴性,表明健脾生血颗粒无致突变作用。见表4。

表1 健脾生血颗粒Ames试验第1次菌落计数结果(Mean±SD)

表2 健脾生血颗粒Ames试验第2次菌落计数结果(Mean±SD)
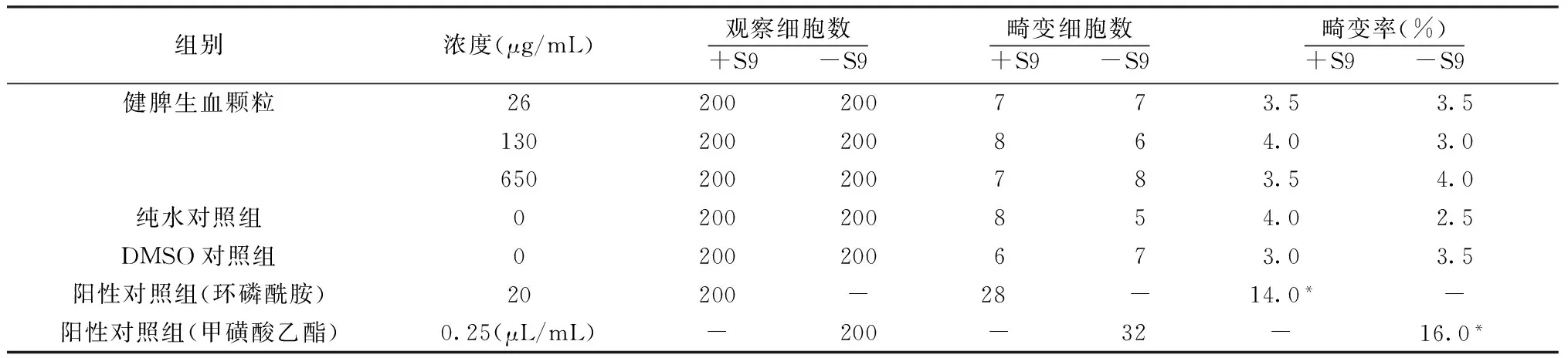
表3 健脾生血颗粒CHO-K1细胞染色体畸变试验结果
注:与纯水对照组比较,*P<0.05。
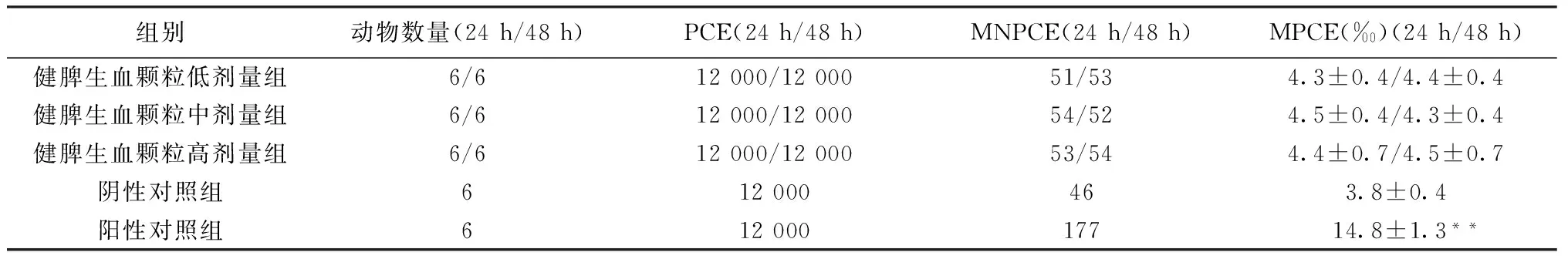
表4 健脾生血颗粒对小鼠骨髓细胞微核率的影响
注:与阴性对照组比较,**P<0.01。
3 讨论
健脾生血颗粒成分主要为党参、茯苓、白术、甘草、黄芪、山药、鸡内金、龟甲、麦冬、南五味子、龙骨、牡蛎、大枣、硫酸亚铁等,无毒性药材,并且多为药食两用药材。从成分分析,该产品几无毒性作用,仅硫酸亚铁可能会引起胃肠道不适[8]。张峰等[9]对硫酸亚铁主要不良反应进行了研究,提示其可能具有的胃肠道刺激作用(包括恶心、口腔异味、腹泻等)。当然,其不良反应与服用剂量有关,剂量越大,发生不良反应的概率越高。此外,硫酸亚铁的不良反应还与联合用药或产品组方也有关,戴琼[10]通过比较健脾生血颗粒(原健脾生血冲剂)与硫酸亚铁颗粒的胃肠道刺激作用,发现前者不良反应远低于后者,其中药部分具有健脾和胃之功,同时还可以降低硫酸亚铁与胃肠壁持续接触的机会,从而降低不良反应的发生率。以上主要基于健脾生血颗粒的一般毒性作用进行分析,本试验则从另一方面证实,该产品未见遗传毒性作用,进一步验证了该产品的安全性,为该产品在临床上各类贫血患者人群的安全应用提供参考。
[1]孙艳.健脾生血颗粒治疗婴幼儿缺铁性贫血50例临床观察[J].中国现代医生,2015,8(3):127-129.
[2]赖鹏程,沈朝霞.健脾生血颗粒治疗小儿缺铁性贫血临床研究[J].儿科药学杂志,2014,20(4):36-38.
[3]白婧.妊娠合并贫血64例临床诊治分析[J].中国实用医药,2014,9(2):137-138.
[4]王永炎,王志飞,谢雁鸣.以再评价为契机的中药上市后系统研究[J].中国中药杂志,2014,39(18):3421-3423.
[5]吴彦,邸莎,李贤煜,等.银菘香的急性毒性及致突变性研究[J].中国药物警戒,2016,13(6):321-324,337.
[6]田逸君,郑怡文,朱玉平,等.雷公藤内酯醇的遗传毒性评价[J].药学实践杂志,2016,34(3):215-218.
[7]吴露露,汪岱迪,宗卫峰,等.木糖醇的小鼠骨髓细胞微核试验[J].海峡药学,2016,28(4):32-33.
[8]周惠琴,周慧霞.缺铁性贫血补铁的给药方法与疗效及不良反应临床观察[J].航空航天医学杂志,2013,24(7):834-835.
[9]张峰,张玲.用不同剂量的硫酸亚铁治疗小儿缺铁性贫血的效果研究[J].当代医药论丛,2015,13(16):132-133.
[10]戴琼.健脾生血冲剂与硫酸亚铁治疗缺铁性贫血比较[J].医药导报,2003,22(1):51-52.
(2016-12-05收稿 责任编辑:王明)
Genotoxicity evaluation of Jianpi Shengxue Granule
Zhao Gang1,Zhang Yinjing2,Guo Xiaojuan1,Yang Yanxia1,Xia Chun1,Huang Zhijun1
(1AcademyofPediatricDrugs,JianminPharmaceuticalGroup,Wuhan430052,China; 2CenteroffoodanddrugsafetyevaluationinHubei,Wuhan430073,China)
Objective:To evaluate the genotoxicity of Jianpi Shengxue Granule.Methods:Genotoxicity of Jianpi Shengxue Granule was studied using Ames test,CHO-K1 cell chromosomal aberration test,and mouse bone marrow cell micronucleus assay,respectively.Results:The Ames test results indicated that Jianpi Shengxue Granule did not affect the normal growth of tested bacteriums at all dosages with or without S9.Compared with the negative control group,all number of reversion mutation had no significant up-regulation,and no dose-response relationship was found.Results of CHO-K1 cell chromosomal aberration test indicated that the aberration rates of Jianpi Shengxue Granule group(650,130,and 26 μg/mL)were all less than 5%.Results of micronucleus assay indicated that there was no statistical difference of micronucleus rate between the Jianpi Shengxue Granule group(2 000,1 000,and 500 μg/mL)and negative group(P>0.05).Conclusion:No genotoxicity of Jianpi Shengxue Granule was found under the conditions of this study.
Jianpi Shengxue Granule; Genotoxicity; Ames test; Chromosomal aberration test; Micronucleus assay
武汉市“汉阳英才计划”项目(编号:A3-17)
赵刚(1983—),男,博士,高级工程师,从事药物新药开发、药理毒理研究,Tel:(027)84523889,E-mail:158200458@qq.com
黄志军(1972—),男,博士,教授级高级工程师,从事中药药理学研究,Tel:(027)84520229,E-mail:542354589@qq.com
R285.5
A
10.3969/j.issn.1673-7202.2016.12.061

